ATP-Molekül
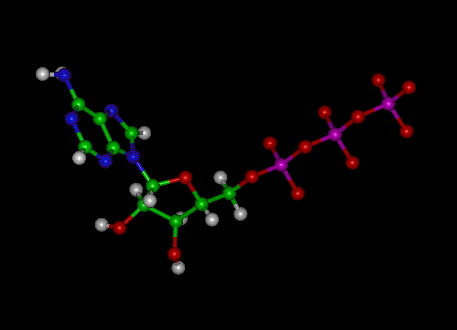
Das Adenosintriphosphat (ATP) -Molekül ist das bekannte Nukleotid in der Biochemie als „molekulare Währung“ des intrazellulären Energietransfers; Das heißt, ATP kann chemische Energie in Zellen speichern und transportieren. ATP spielt auch eine wichtige Rolle bei der Synthese von Nukleinsäuren.
Für die 3-D-Struktur dieses Bildes mit JsmolClick hier
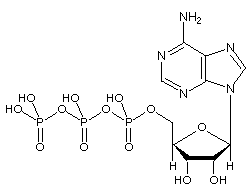
Bild: Molekülstruktur von ATP
Energie wird durch Hydrolyse der dritten Phosphatgruppe freigesetzt. Nachdem diese dritte Phosphatgruppe freigesetzt ist, kann das resultierende ADP (Adenosindiphosphat) Energie absorbieren und die Gruppe zurückgewinnen, wodurch ein ATP-Molekül regeneriert wird. Dadurch kann ATP Energie wie eine wiederaufladbare Batterie speichern.
Phosphorylpositionen
Die Phosphorylgruppen, die mit denen bei AMP beginnen, werden als Alpha-, Beta- und Gammaphosphate bezeichnet.
Physikalische und chemische Eigenschaften
ATP besteht aus Adenosin – bestehend aus einem Adeninring und einem Ribosezucker – und drei Phosphatgruppen (Triphosphat). Die Phosphorylgruppen, beginnend mit der Gruppe, die der Ribose am nächsten liegt, werden als Alpha (α) -, Beta (β) – und Gamma (γ) -Phosphate bezeichnet. Folglich ist es eng mit dem Adeninnukleotid verwandt, einem Monomer der RNA. ATP ist in Wasser gut löslich und in Lösungen zwischen pH 6,8 und 7,4 ziemlich stabil, wird jedoch bei extremem pH schnell hydrolysiert. Folglich wird ATP am besten als wasserfreies Salz gelagert.
ATP ist ein instabiles Molekül in ungepuffertem Wasser, in dem es zu ADP und Phosphat hydrolysiert. Dies liegt daran, dass die Stärke der Bindungen zwischen den Phosphatgruppen in ATP geringer ist als die Stärke der Wasserstoffbindungen (Hydratationsbindungen), zwischen ihren Produkten (ADP und Phosphat) und Wasser. Wenn sich ATP und ADP in Wasser im chemischen Gleichgewicht befinden, wird schließlich fast das gesamte ATP in ADP umgewandelt. Ein System, das weit vom Gleichgewicht entfernt ist, enthält Gibbs freie Energie und ist arbeitsfähig. Lebende Zellen halten das Verhältnis von ATP zu ADP auf einem Punkt, der zehn Größenordnungen vom Gleichgewicht entfernt ist, wobei die ATP-Konzentrationen fünfmal höher sind als die Konzentration von ADP. Diese Verschiebung aus dem Gleichgewicht bedeutet, dass die Hydrolyse von ATP in der Zelle eine große Menge an freier Energie freisetzt. Zwei Phosphoanhydridbindungen (diejenigen, die benachbarte Phosphate verbinden) in einem ATP-Molekül sind für den hohen Energiegehalt von verantwortlich dieses Molekül. Im Zusammenhang mit biochemischen Reaktionen werden diese Anhydridbindungen häufig – und manchmal kontrovers – als hochenergetische Bindungen bezeichnet (obwohl Energie benötigt wird, um Bindungen aufzubrechen). In ATP gespeicherte Energie kann bei Hydrolyse der Anhydridbindungen freigesetzt werden. Die primäre Phosphatgruppe am ATP-Molekül, die hydrolysiert wird, wenn Energie benötigt wird, um anabole Reaktionen anzutreiben, ist die γ-Phosphatgruppe. Es befindet sich am weitesten vom Ribosezucker entfernt und hat eine höhere Hydrolyseenergie als das α- oder β-Phosphat. Die nach der Hydrolyse oder der Phosphorylierung eines Rückstands durch ATP gebildeten Bindungen haben eine geringere Energie als die Phosphoanhydridbindungen von ATP. Während der enzymkatalysierten Hydrolyse von ATP oder der Phosphorylierung durch ATP kann die verfügbare freie Energie von einem lebenden System für die Arbeit genutzt werden.
Jedes instabile System potenziell reaktiver Moleküle könnte möglicherweise als Mittel zur freien Speicherung dienen Energie, wenn die Zelle ihre Konzentration weit vom Gleichgewichtspunkt der Reaktion entfernt hielt. Wie bei den meisten polymeren Biomolekülen wird der Abbau von RNA, DNA und ATP in einfachere Monomere sowohl durch Überlegungen zur Energiefreisetzung als auch zur Erhöhung der Entropie sowohl bei Standardkonzentrationen als auch bei den in der Zelle auftretenden Konzentrationen gesteuert.
Die durch die Hydrolyse von ATP freigesetzte Standard-Energiemenge kann aus den Energieänderungen unter nicht natürlichen (Standard-) Bedingungen berechnet und dann auf biologische Konzentrationen korrigiert werden. Die Nettoveränderung der Wärmeenergie (Enthalpie) bei Standardtemperatur und -druck bei der Zersetzung von ATP in hydratisiertes ADP und hydratisiertes anorganisches Phosphat beträgt –30,5 kJ / mol bei einer Änderung der freien Energie von 3,4 kJ / mol. Die Energie, die durch Abspalten einer Phosphat (Pi) – oder Pyrophosphat (PPi) -Einheit von ATP bei einem Standardzustand von 1 M freigesetzt wird, beträgt:
ATP + H 2O → ADP + Pi ΔG ° = –30,5 kJ / mol (–7,3 kcal / mol) ATP + H 2O → AMP + PPi & Dgr; G ° = –45,6 kJ / mol (–10,9 kcal / mol)
Diese Werte können sein wird verwendet, um die Änderung der Energie unter physiologischen Bedingungen und das zelluläre ATP / ADP-Verhältnis zu berechnen. Es wird jedoch zunehmend ein repräsentativerer Wert (der AMP berücksichtigt) genannt, der als Energieladung bezeichnet wird. Die angegebenen Werte für die freie Gibbs-Energie für diese Reaktion hängen von einer Reihe von Faktoren ab, einschließlich der Gesamtionenstärke und der Anwesenheit von Erdalkalimetallionen wie Mg2 +
und Ca2 +
.Unter typischen zellulären Bedingungen beträgt ΔG ungefähr –57 kJ / mol (–14 kcal / mol).
Synthese
ATP kann durch verschiedene zelluläre Prozesse hergestellt werden, am typischsten in Mitochondrien durch oxidative Phosphorylierung unter dem katalytischen Einfluss der ATP-Synthase oder bei Pflanzen in Chloroplasten durch Photosynthese.
Die Hauptbrennstoffe für die ATP-Synthese sind Glucose und Fettsäuren. Zunächst wird Glucose im Cytosol in Pyruvat zerlegt. Für jedes Glucosemolekül werden zwei ATP-Moleküle erzeugt. Die Endstadien der ATP-Synthese werden im Mitochondrium durchgeführt und können bis zu 34 ATP erzeugen.
ATP im menschlichen Körper
Die Gesamtmenge an ATP im menschlichen Körper beträgt ungefähr 0,1 Mol. Die Energie, die ein Erwachsener täglich verbraucht, erfordert die Hydrolyse von 200 bis 300 Mol ATP. Dies bedeutet, dass jedes ATP-Molekül tagsüber 2000 bis 3000 Mal recycelt werden muss. ATP kann nicht gespeichert werden und daher muss seine Synthese genau seinem Verbrauch folgen.
Andere Triphosphate
Lebende Zellen haben auch andere „hochenergetische“ Nucleosidtriphosphate wie Guanintriphosphat. Zwischen ihnen und ATP kann Energie leicht durch Reaktionen übertragen werden, wie sie beispielsweise durch Nukleosiddiphosphokinase katalysiert werden: Energie wird freigesetzt, wenn die Hydrolyse der Phosphat-Phosphat-Bindungen durchgeführt wird. Diese Energie kann von einer Vielzahl von Enzymen, Motorproteinen und Transportproteinen verwendet werden, um die Arbeit der Zelle auszuführen. Die Hydrolyse ergibt auch freies anorganisches Phosphat und Adenosindiphosphat, das weiter zu einem anderen Phosphation und Adenosinmonophosphat abgebaut werden kann. ATP kann auch direkt unter Bildung von Pyrophosphat zu Adenosinmonophosphat abgebaut werden. Diese letzte Reaktion hat den Vorteil, dass sie in wässriger Lösung ein effektiv irreversibler Prozess ist.
Reaktion von ADP mit GTP
ADP + GTP > ATP + GDP