Fakta o elementech Francium
Chemický prvek francium je klasifikován jako alkalický kov. Objevil ji v roce 1939 Marguerite Perey.

Datová zóna
| Klasifikace: | Francium je alkalický kov |
| Barva: | stříbrno-šedá-kovová (předpokládaná) |
| atomová hmotnost: | (223), žádné stabilní izotopy |
| stav: | pevný |
| Bod tání: | 27 oC, 300 K |
| Bod varu: | 677 oC, 950 K |
| elektrony: | 87 |
| protony: | 87 |
| neutrony v nejhojnějším izotopu: | 136 |
| elektronové granáty: | 2, 8,18,32,18,8,1 |
| Konfigurace elektronů: | 7s1 |
| Hustota @ 20 ° C: | 1,873 g / cm3 |
Zobrazit více, včetně: Teplo, Energie, Oxidace,
Reakce, sloučeniny, poloměry, vodivosti
| Atomový objem: | 71,07 cm3 / mol |
| Struktura: | věřil být bcc: kubický centrovaný na tělo |
| Tvrdost: | – |
| měrná tepelná kapacita | – |
| teplo fúze | 2 kJ mol-1 |
| rozprašovací teplo | 73 kJ mol-1 |
| odpařovací teplo | 64 kJ mol-1 |
| 1. ionizační energie | 384 kJ mol-1 |
| 2. ionizační energie | – |
| 3. ionizační energie | – |
| afinita k elektronům | – |
| minimální oxidační číslo | 0 |
| min. společné oxidační číslo. | 0 |
| maximální číslo oxidace | 1 |
| Max. běžné oxidační číslo | 1 |
| elektronegativita (Paulingova stupnice) | 0,7 |
| polarizovatelnost objem | 48,7 Å3 |
| reakce se vzduchem | – |
| reakce s 15 M HNO3 | – |
| reakce s 6 M HCl | energická, ⇒ H2, FrCl |
| reakce s 6 M NaOH | energická, ⇒ H2, FrOH |
| oxid (y) | – |
| Hydrid (y) | – |
| Chlorid (y) | – |
| Atomový poloměr | – |
| Iontový poloměr (ion 1+) | 194 pm |
| Iontový poloměr (iont 2+) | – |
| Iontový poloměr (3 ionty) | – |
| Iontový poloměr (1 iont) | – |
| Iontový poloměr (2 ionty) | – |
| Iontový poloměr (3 ionty) | – |
| Tepelná vodivost | 3,61 W m-1 K-1 |
| elektrická vodivost | – |
| bod tuhnutí / tání: | 27 oC, 300 K |

Tento vzorek uranové rudy obsahuje přibližně 100 000 atomů francium-223 (3,3 x 10 – 20 g). Francium je radioaktivní; na Zemi v daném okamžiku existuje méně než 30 g. Ref. Obrázku (1)
Objev Francia
Francium objevila Marguerite Perey v roce 1939, když zkoumala radioaktivní rozpad aktinia-227.
Objev se uskutečnil v Curie Institute v Paříži. Prvek odvozuje svůj název od země svého objevu – Francie.
Objev začal v roce 1935, kdy Perey ve věku 26 let přečetl výzkumnou práci, v níž tvrdí, že američtí vědci objevili beta částice emitované aktiniem, měla vyšší množství energie než obvykle.
Perey byla na toto zjištění zvědavá a již jako odbornice na práci související s aktiniem se rozhodla provést vlastní experimenty na aktiniu. Vyrobila ultračistý vzorek aktinia a studovala jeho záření. Perey zjistil, že asi 1% radioaktivity aktinia bylo způsobeno tím, že emitovalo částice alfa, nikoli částice beta.
Perey objevil, že aktinium-227 se může rozpadat emitováním jádra helia (také nazývaného částice alfa) z jeho vlastní jádro. Vytvořené dceřinné jádro bylo dříve neobjeveným prvkem, který se rozhodla pojmenovat francium na počest své domovské země, Francie.
227Ac → 223Fr + 4He
S 87 protony patřil nový prvek do Skupina 1 periodické tabulky, která spojuje dalších pět alkalických kovů: lithium, sodík, draslík, rubidium a cesium.
Objev francium dokončil objevy přirozeně se vyskytujících prvků v lidstvu.
Všechny prvky objevené od té doby byly objeveny, když byl prvek vyroben v laboratoři.

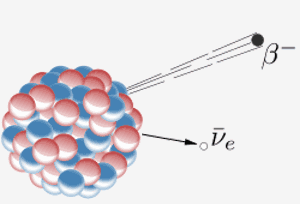
Jádro emituje beta částice ( elektron) a antineutrino. Výsledkem toho je, že neutron v jádře se změní na proton. Když to prvek 87 v periodické tabulce (francium) provede, extra proton znamená, že se stane prvkem 88 (radium).
Vzhled a vlastnosti
Škodlivé účinky:
Francium je vysoce radioaktivní.
Vlastnosti:
Francium je těžký, nestabilní, radioaktivní kov s maximální poločas pouze 22 minut. Má nízkou teplotu tání (27 oC, 81 oF) a pokud by se jich nahromadilo dost, byla by v teplé místnosti kapalná.
Francium je druhým nejvzácnějším prvkem v zemské kůře, vedle astatu. Na Zemi v daném okamžiku existuje méně než třicet gramů francia.
Francium je nejméně elektronegativní ze všech prvků, proto by měl být chemicky nejreaktivnějším alkalickým kovem. Bohužel není k dispozici v dostatečném množství, aby se ukázalo, že reaguje s vodou – vyrábí se v malém množství v urychlovačích částic. Teoreticky by jeho reakce s vodou byla prudší než cesná a mnohem prudší než sodná.
Francium byl naposledy studován na Stony Brook University v New Yorku. Vědci tam zachytili až deset tisíc atomů francium najednou pomocí laserových paprsků v magnetickém poli, aby změřili jejich vlastnosti.
Použití francium
Komerčně neexistuje francium kvůli jeho vzácnosti a nestabilitě. Používá se pouze pro výzkumné účely.
Rozpad Francium
Izotopy Francium, jejichž hmotnost se pohybuje od 200 do 232, se nejčastěji rozpadají alfa nebo beta.
Zde je jen několik příkladů cest rozkladu francium:
Francium-223 je nejdelší izotop prvku. Má poločas rozpadu 22 minut. Může emitovat alfa-částice (jádro helia) za vzniku astatu-219 nebo beta-částice za vzniku radia-223. (Beta-částice je elektron, který je emitován z jádra, když se neutron přemění na proton.)
Francium-221 má poločas 5 minut. Může emitovat alfa-částice za vzniku astatinu-217 nebo beta-částice, aby se stala radiem-221.
Francium-216 má poločas 0,7 mikrosekundy. Může emitovat alfa částice za vzniku astatu-212 nebo pozitron za vzniku radonu-216.
Francium-212 má biologický poločas 19 minut. Může emitovat alfa částice za vzniku astatu-208 nebo zachytit orbitální elektron za vzniku radonu-212. (2) (Během orbitálního elektronového záchytu zachytí jádro jeden z atomů vlastních elektronů a vydá neutrino.)
Hojnost a izotopy
Hojnost zemská kůra: ~ 0 dílů na milion , ~ 0 dílů na milion
Množství solární soustavy: ~ 0 dílů na miliardu hmotnostních, ~ 0 dílů na miliardu molů
Čistá cena: $ za 100 g
Cena, hromadně: $ za 100 g
Zdroj: Francium se přirozeně vyskytuje v důsledku alfa radioaktivního rozpadu aktinia.
Izotopy: Francium má 33 izotopů, jejichž poločasy rozpadu jsou známé, s hromadnými čísly 200 až 232. Žádná není stabilní. 223Fr má nejdelší poločas rozpadu na 21,8 minut.

- Foto Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, vydání 6.
Citovat tuto stránku
Chcete-li online odkazovat, zkopírujte a vložte jednu z následujících položek:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
nebo
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Chcete-li tuto stránku citovat v akademickém dokumentu, použijte následující citace vyhovující MLA:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.