Fakta o prvcích kadmia
Chemický prvek kadmium je klasifikován jako přechodný kov. Objevil jej v roce 1817 Friedrich Stromeyer.

Datová zóna
| Klasifikace: | kadmium je přechodový kov |
| Barva: | modrobílá |
| Atomová hmotnost: | 112.41 |
| Stav: | pevný |
| Bod tání: | 321,1 oC, 594,3 K |
| Bod varu: | 765 oC, 1038 K |
| Elektrony: | 48 |
| Protony: | 48 |
| Neutrony v nejhojnějším izotopu: | 66 |
| elektronové granáty: | 2,8,18,18,2 |
| Konfigurace elektronů: | 4d10 5s2 |
| Hustota při 20 ° C: | 8,65 g / cm3 |
Zobrazit více, včetně: Teplo, Energie, Oxidace, Reakce,
Sloučeniny, Poloměry, Vodivost
| Atomový objem: | 13,1 cm3 / mol |
| Struktura: | hcp: šestihranný těsně zabalený |
| tvrdost: | 2,0 mohs |
| měrná tepelná kapacita | 0,23 J g-1 K-1 |
| fúzní teplo | 6,192 kJ mol-1 |
| Teplo atomizace | 112 kJ mol-1 |
| Teplo vaporizace | 99,87 kJ mol-1 |
| 1. ionizační energie | 867,7 kJ mol-1 |
| 2. ionizační energie | 1631,4 kJ mol-1 |
| 3. ionizační energie | 3616,2 kJ mol-1 |
| elektronová afinita | – |
| minimální oxidační číslo | 0 |
| min. společné oxidační číslo. | 0 |
| maximální číslo oxidace | 2 |
| Max. běžné oxidační číslo | 2 |
| elektronegativita (Paulingova stupnice) | 1,69 |
| polarizovatelnost objem | 7,2 Å3 |
| reakce se vzduchem | mírný, bez h ⇒ CdO |
| reakce s 15 M HNO3 | mírná ⇒ Cd (NO3) 2, NOx |
| reakce se 6 M HCl | mírný, ⇒ H2, CdCl2 |
| reakce s 6 M NaOH | žádný |
| oxid (s) | CdO, CdO2 |
| hydrid (y) | CdH2 |
| Chloridy (chloridy) | CdCl2 |
| Atomový poloměr | 151 pm |
| Iontový poloměr (1+ iont) | – |
| Iontový poloměr (2+ iont) | 109 pm |
| Iontový poloměr (3+ iontový) | – |
| Iontový poloměr (1 iontový) | – |
| Iontový poloměr (2 ionty) | – |
| Iontový poloměr (3 ionty) | – |
| The rmal vodivost | 96,6 W m-1 K-1 |
| elektrická vodivost | 14,7 x 106 S m-1 |
| Bod tuhnutí / tání: | 321,1 oC, 594,3 K |

Malá koule z kovového kadmia s mincí pro označení velikosti.

Friedrich Stromeyer, který objevil kadmium v roce 1817.
Okolí periodické tabulky kadmia
| Skupina 11 |
Skupina 12 | Skupina 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 vstup |
| 6 | 79 Au |
80 Hg |
81 Tl |
Objev kadmia
Kadmium objevil německý chemik Friedrich Stromeyer v roce 1817 jako nečistotu v oxidu zinečnatém. (1)
Stromeyer objevil svůj objev po žádosti vlády o kontrolu lékáren ve městě Hildesheim v Německu.
V té době se oxid zinečnatý používal, jako dosud, k léčbě kožních stavů. Z nějakého důvodu Hildesheimovy lékárny prodávaly uhličitan zinečnatý spíše než obvyklý oxid zinečnatý.
Stromeyer si byl vědom toho, že zahřátím uhličitanu zinečnatého, dokud nebude rozpálený, se jej přemění na oxid. Udělal to se vzorky z lékáren. Zjistil, že brilantní bílý uhličitan se změnil na oxid, který měl být bílý, ale ve skutečnosti byl žlutý / oranžový.
Normálně by tato barva naznačovala kontaminaci železem nebo olovem, ale Stromeyer nemohl najít žádnou stopu těchto prvků.
Navštívil továrnu v Salzgitteru, kde lékárny koupily uhličitan zinečnatý. Zeptal se, proč místo obvyklého oxidu prodávají uhličitan zinečnatý.
Vedoucí mu vysvětlil, že jejich uhličitan zinečnatý byl očekávanou barvou – bílou – a bylo snadné jej prodat.
Když se pokusili přeměnit uhličitan na oxid zahříváním, vždy zožloutlo. Protože oxid zinečnatý by měl být bílý, nemohli jej prodat. Pečlivě to analyzovali na kontaminaci železem, ale nic nenašli.
Stromeyer se poté rozhodl, že bude tento žlutý oxid zinečnatý pečlivě analyzovat sám. Zjistil, že žlutá barva byla způsobena „přítomností zvláštního oxidu kovu, jehož existence dosud nebyla podezřelá.“
Extrahoval tento nový oxid kovu z oxidu zinečnatého a poté ho redukoval, aby izoloval vůbec první kov kadmia na světě. Jeho vzhled přirovnal k platině a měřil jeho hustotu jako 8,75 g / cm3 – velmi blízko dnešní přijal hodnotu.
Provedl další práci a zjistil, že jeho nový kov obsahuje také další sloučeniny zinku. Analyzoval „čistý“ kov zinku a zjistil, že i v tomto je jeho nový kov přítomen.
dhadoval, že nový kov byl v zinku a jeho sloučeninách přítomen mezi 0,1% a 1%, ze kterého dokázal izolovat 3 gramy čistého kadmia.
Stromeyer navrhl název kadmium po „kadmii“ latinský název pro kalamín. Calamine je starý název pro zinkovou rudu.
Kadmium objevil nezávisle německý chemik Karl Hermann v roce 1818. Hermann si všiml neočekávané žluté barvy v sirníku zinečnatém Předpokládalo se, že žlutá pochází z nečistot arsenu, ale Hermann si uvědomil, že to bylo ve skutečnosti kvůli dříve neznámému ele ment. (2)


Telurid kademnatý se používá k výrobě tenkovrstvých solárních článků, které mohou absorbovat více než 90% viditelného světla. Obrázek: NREL
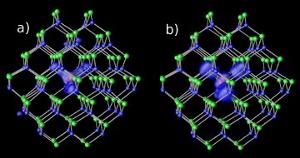
Hořčíkové nečistoty v nanokrystalech kadmia a selenu ve dvou různých úrovních mezery : (a) rezonanční ab) hybridní. Obrázek: NERSC
Vzhled a vlastnosti
Škodlivé účinky:
Kadmium a jeho sloučeniny jsou vysoce toxické.
Charakteristika:
Kadmium je měkký, tvárný, tvárný, modrobílý kov, který lze snadno řezat nožem. Je to vynikající elektrický vodič a vykazuje dobrou odolnost proti korozi a působení chemikálií.
Je v mnoha ohledech podobný zinku ve svých chemických vlastnostech.
Kadmium zakalí na vzduchu a je rozpustný v kyselinách, ale ne v louzích.
Kov hoří na vzduchu za vzniku hnědého oxidu kademnatého (CdO).
Použití kadmia
Hlavní použití kadmia je v bateriích (zejména dobíjecí nikl – kadmium, NiCad, baterie).
Díky nízkému koeficientu tření a vysoké odolnosti proti únavě se kadmium používá ve slitinách pro ložiska. Kadmium se používá ve slitinách s nízkou teplotou tání a je součástí mnoha druhů pájek. Používá se také při galvanickém pokovování.
Sloučeniny obsahující kadmium se používají v černobílých televizních fosforech a v modrých a zelených fosforech pro barevné televizní obrazovky. Sulfid kademnatý se používá jako žlutý pigment a selenid kademnatý se používá jako červený pigment, který se často nazývá kadmiová červená.
Kadmium a tellur lze sloučit do tenkovrstvých fotovoltaických modulů CdTe, jejichž fyzikální vlastnosti jsou ideální pro výroba solárních článků. Jsou relativně nízké náklady a mají téměř dokonalý pás pro získávání sluneční energie.
Hojnost a izotopy
Hojnost zemské kůry: 150 dílů na miliardu hmotnostních, 30 dílů na miliardu molů
Hojnost solárního systému: 6 dílů na miliardu hmotnostních, 70 dílů na bilion molů
Čistá cena: 46 $ za 100 g
Hromadná cena: 0,77 $ na 100 g
Zdroj: Kadmium se nejčastěji vyskytuje v malém množství spojeném se zinkovými rudami, jako je sfalerit (ZnS). Greenockit (CdS) je jediným minerálem kadmia, který má jakékoli důsledky. Téměř všechno kadmium se získává jako vedlejší produkt při rafinaci zinku, mědi a olověné rudy.

- Friedrich Stromeyer, Annals of Philosophy, edited Thomas Thomson, Volume XIII, 1819, Robert Baldwin, p108
- JW Mellor, A Comprehensive Treatise in Anorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Citovat tuto stránku
Pro online odkazy , zkopírujte a vložte jednu z následujících položek:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
nebo
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Do citujte tuto stránku v akademickém dokumentu, použijte prosím následující citaci vyhovující MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.