Fakta o prvcích polonia
Chemický prvek polonium je klasifikován jako chalkogen a metaloid. Objevili ho v roce 1898 Marie a Pierre Curie.

Datová zóna
| Klasifikace: | Polonium je chalkogen a metaloid |
| Barva: | stříbřitě šedá |
| atomová hmotnost : | (209), žádné stabilní izotopy |
| stav: | pevný |
| Bod tání: | 254 oC, 527 K |
| Bod varu: | 960 oC, 1233 K |
| Elektrony: | 84 |
| Protony: | 84 |
| neutrony v nejhojnějším izotopu: | 125 |
| elektronové granáty: | 2,8 , 18,32,18,6 |
| Konfigurace elektronů: | 4f14 5d10 6s2 6p4 |
| Hustota @ 20 ° C: | 9,4 g / cm3 |
Zobrazit více, včetně: Heat, Energies, Ox idace,
Reakce, sloučeniny, poloměry, vodivosti
| atomový objem: | 22,23 cm3 / mol |
| Struktura: | jednoduchá kubická |
| Tvrdost: | – |
| Specifická tepelná kapacita | 0,12 J g-1 K-1 0,12 |
| Teplo fúze | 13 kJ mol-1 |
| atomizační teplo | 142 kJ mol-1 |
| Výparné teplo | 120 kJ mol-1 |
| 1. ionizační energie | 812 kJ mol-1 |
| 2. ionizační energie | – |
| 3. ionizační energie | – |
| afinita k elektronu | 180 kJ mol-1 |
| minimální oxidační číslo | -2 |
| min. běžné oxidační číslo. | -2 |
| maximální číslo oxidace | 6 |
| Max. běžné oxidační číslo | 4 |
| elektronegativita (Paulingova stupnice) | 2.0 |
| polarizovatelnost objem | 6,8 Å3 |
| reakce se vzduchem | mírný, ⇒ PoO2 |
| Reakce s 15 M HNO3 | – |
| Reakce s 6 M HCl | mírná, ⇒ PoCl2 |
| reakce s 6 M NaOH | žádný |
| oxid (y) | PoO2, PoO2 |
| Hydrid (y) | PoH2 |
| Chlorid (s) | PoCl2 |
| Atomový poloměr | 190 pm |
| Iontový poloměr (1+ iont) | – |
| iontový rádius (iont 2+) | – |
| iontový radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Iontový poloměr (2 ionty) | – |
| Iontový poloměr (3 ionty) | – |
| Tepelná vodivost | 0.2 W m-1 K-1 |
| elektrická vodivost | 0,7 x 106 S m-1 |
| Bod tuhnutí / tání: | 254 oC, 527 K |

Marie Curie v roce 1883, 16 let. Polonium bylo prvním prvkem, který objevila o 15 let později.
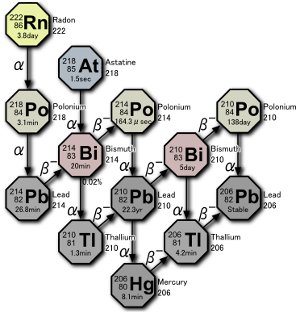
Část série rozpadu uranu. V přírodě se vyrábějí tři izotopy polonia, a to buď rozpadem samotného radonového plynu, nebo rozpadem atomů způsobeným rozpadem radonu. Obrázek Tosaky.
Objev polonia
Polonium bylo prvním prvkem, který objevili Marie a Pierre Curie.
Polonium a poté radium objevili v roce 1898 v Paříži, zatímco zkoumali radioaktivitu ve smolce (oxidu uranu).
Napsali: „Věříme, že látka, kterou jsme extrahovali z pitchblende, obsahuje kov, který dosud nebyl znám, podobný vizmutu v jeho analytických vlastnostech. Pokud je existence tohoto nového kovu potvrzena, navrhujeme, aby nazval polonium podle názvu země původu jednoho z nás. “
V souladu s přáním Curieových je polonium pojmenováno po Polsku, kde se Marie Curie narodila a vyrostla.
Nebezpečí práce s radioaktivními prvky nebylo známo, když Curieovi objevili. Jejich laboratorní notebooky z této doby jsou tak radioaktivní, že jsou nyní uloženy v olověném pouzdru. (1)
Vzhled a vlastnosti
Škodlivé účinky:
Polonium je škodlivé jak svou chemickou toxicitou, tak svou radioaktivitou. Polonium-210 je emitor alfa. Proto je velmi nebezpečné při požití nebo vdechnutí.Vystavení poloniu zvyšuje riziko vzniku různých druhů rakoviny.
Charakteristika:
Polonium je vzácný, stříbřitě šedý, radioaktivní, nízkotající metaloid.
Polonium snadno reaguje se zředěnými kyselinami, ale jen mírně s alkáliemi.
Všechny jeho izotopy jsou radioaktivní.
210Po vyzařuje modrou záři, protože vzduch kolem něj je vzrušen rozpadem produkty. 1 gram Po emituje tolik alfa částic jako 5 kilogramů rádia.
Energie uvolněná rozpadem alfa polonia je značná a ohřívá prostor kolem ní. Uvolněná energie je tak velká (140 W / g), že kapsle obsahující asi půl gramu dosáhne teploty nad 500 ° C.
Použití polonia
Alfa paprsky vyzařované polonium lze použít k eliminaci statické elektřiny produkované během procesů, jako je válcování papíru, drátu a plechu. Zdroje záření beta se však běžněji používají, protože jsou méně nebezpečné.
210Po může být použit jako atomový zdroj tepla, ale kvůli krátkému poločasu izotopu (138,4 dne) neposkytuje energii pro dlouhodobé použití.
Polonium se také používá v antistatických kartáčích k eliminaci prachu na fotografickém filmu. Je uzavřen v kartáčích pro kontrolu radioaktivních emisí.
Hojnost a izotopy
Hojnost zemská kůra: řádově 1 díl na kvadrillion.
Hojnost sluneční soustavy: zanedbatelné
Náklady , čistý: na 100 g
Náklady, hromadné: na 100 g
Zdroj: Polonium je velmi vzácný prvek díky krátkému poločasu rozpadu všech jeho izotopů. Nachází se v uranových rudách v malém množství. Lze jej získat bombardováním přírodního vizmutu 209Bi neutrony, čímž se získá 210Bi, který se poté rozpadne na 210Po rozpadem β. Přibližně 100 g polonia je syntetizováno každý rok.
Izotopy: Polonium má 29 izotopů, jejichž poločasy jsou známy, s hromadnými čísly 190 až 218. Žádný není stabilní. Nejstabilnější izotop je 209Po s poločasem 102 let.

Citovat tuto stránku
Pro online odkazy zkopírujte a vložte jednu z následujících možností:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
nebo
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Chcete-li tuto stránku citovat v akademickém dokumentu, použijte následující citaci vyhovující MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.