Frontiers in Cellularand Infection Microbiology (Čeština)
Úvod
Staphylococcus aureus je důležitý lidský patogen izolovaný od hospitalizovaných pacientů po celém světě, který způsobuje jak nemocniční, tak komunitní infekce ( Lowy, 1998). Tento patogen je etiologickým činitelem několika různých systémových infekcí, postihujících kůži a měkké tkáně, jakož i pohybového aparátu a oběhového systému (Lowy, 1998; Changchien et al., 2016). Bylo oznámeno, že S. aureus může přežít v makrofágech odvozených od lidských monocytů (Kubica et al., 2008). Virulence S. aureus je úzce spojena s řadou vylučovaných enzymů a toxinů produkovaných bakteriemi (Otto, 2014). Hemolysin, leukocidin (Panton – Valentine leukocidin, PVL) a syndrom toxického šoku toxin-1 (TSST-1), usnadňující poškození membrány červených krvinek, poškození fagocytární funkce leukocytů a vyvolání syndromu toxického šoku, jsou rozhodující pro patogenní procesy S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube a Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Nedávné studie prokázaly, že hemolysin se také podílí na tvorbě biofilmu S. aureus (den Reijer et al., 2016). Zvyšující se prevalence multirezistentních kmenů S. aureus v nemocničních a komunitních prostředích dále zvyšuje nebezpečí S. aureus a představuje závažnou výzvu pro klinickou terapii (Voss a Doebbeling, 1995; Evangelista Sde a de Oliveira, 2015).
Nedávno byla v naší nemocnici nalezena řada kmenů patřících do třídy S. aureus s neúplným hemolytickým fenotypem (SIHP). Hemolýza způsobená těmito kmeny SIHP se významně liší od úplného hemolytického kruhu (β-hemolytický fenotyp) produkovaného v jiných kmenech S. aureus. Tyto kmeny SIHP však dosud nebyly identifikovány a komplexně charakterizovány. Abychom prozkoumali mikrobiologické vlastnosti těchto kmenů SIHP, shromáždili jsme 60 kmenů SIHP a studovali je pomocí různých kritérií včetně hemolytického fenotypu, exprese genu pro hemolyzin, vlastností rezistence na léky a virulence. Tato studie ukazuje, že SIHP jsou kmeny rezistentní na meticilin, které vysoce exprimují β-hemolysin a mají vysoký potenciál virulence.
Materiály a metody
Bakteriální kmeny
Šedesát SIHP kmeny byly izolovány od pacientů přijatých do druhé přidružené nemocnice na Soochowově univerzitě v letech 2013 až 2015. Od každého pacienta byly odebrány duplicitní vzorky k analýze. Tyto izoláty byly poté kultivovány na agarových deskách z ovčí krve z krve (CHROMagar Company, Šanghaj, Čína) při 35 ° C v atmosféře obsahující 5% CO2 (v / v). Identita kmenů jako S. aureus byla potvrzena pomocí automatizovaného mikrobiologického systému Phoenix-100 (Becton, Dickinson and Company, USA). Kontrolní kmeny S. aureus s úplným hemolytickým fenotypem byly izolovány od pacientů v naší nemocnici ve stejném časovém období. Zde se S. aureus s úplným hemolytickým fenotypem nazýval kmeny SCHP. Referenční kmen S. aureus ATCC25923 (Šanghajské centrum pro klinickou laboratoř, Čína) má kompletní hemolytický fenotyp a působí také jako kontrolní kmen. Výbor pro lékařskou etiku druhé přidružené nemocnice na Soochowově univerzitě tuto studii schválil a všechny izoláty byly v této studii odebrány se souhlasem pacienta.
Srovnávací analýzy neúplného hemolytického fenotypu
S. aureus kmeny byly kultivovány na komerčních destičkách s krevním agarem od různých společností (CHROMagar, Autobio Diagnostics Co., Ltd., Čína a BioMérieux, Čína), stejně jako samostatně připravené desky s agarem z ovčí krve s použitím práškového krevního agaru Columbia (OXIDE, UK). Bakterie byly kultivovány při teplotě 35 ° C v atmosféře obsahující 5% CO2 (v / v) po dobu 24 hodin a poté prošly sériovým pasážováním. Poté byl pozorován hemolytický jev. Klinicky izolované kmeny s úplným hemolytickým fenotypem a referenčním kmenem ATCC25923 byly také pozorovány jako kontrola pro srovnávací analýzy.
Stanovení úrovní mRNA čtyř hemolysinových genů S. aureus pomocí reverzní transkripce v reálném čase kvantitativní PCR (qPCR)
Extrakce celkové RNA ze SIHP a referenčního kmene ATCC25923 byla provedena, jak bylo popsáno výše (Qin et al., 2014). Zpočátku byly buňky lyžovány pomocí lysostafinu, lysozymu a proteinázy K. RNA byla poté extrahována a purifikována pomocí sady RNeasy Mini Kit (Qiagen) podle protokolu doporučeného výrobcem. Kvalita a koncentrace RNA byla hodnocena pomocí NanoDrop1000. RNA byla poté reverzní – přepsán na cDNA pomocí soupravy pro reverzní transkripci (Thermo Fisher Scientific Inc., USA) podle pokynů výrobce.Stručně qPCR bylo provedeno následovně: pre-denaturace při 94 ° C po dobu 3 minut, denaturace při 94 ° C po dobu 30 s, žíhání při 52 ° C po dobu 30 s, prodloužení při 72 ° C po dobu 40 s, celkem 45 cyklů . Každý vzorek měl tři technické a tři biologické opakování. Transkripční profil každého ze čtyř hemolysinových genů a 16s rRNA genu byl stanoven pomocí metody 2-ΔACt. Úroveň transkripce byla stanovena vzhledem k expresi 16s rRNA genu. Sekvence čtyř genů hemolysinu (hla, hlb, hlgC a hld) byly získány z databáze GenBank. K návrhu primerů byl použit software Primer 5.0 (tabulka 1) a tyto primery byly syntetizovány společností Sangon Biotech Co., Ltd. (Šanghaj, Čína).
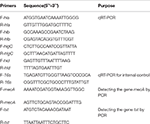
Tabulka 1. Primery použité v této studii.
Pro analýzu dat byl použit SPSS 17.0. Naměřená data jsou uvedena jako x̄ ± s. K porovnání relativní exprese každého ze čtyř hemolysinových genů byl použit T-test pro dva nezávislé vzorky. Statistická významnost byla definována jako p < 0,05.
Detekce exprese α-hemolysinu (Hla) metodou Western Blot
Koncentrace SIHP a referenční kmen S. aureus ATCC25923 byly upraveny na 5,0 McFarland pomocí měřiče zákalu. Celkový protein byl poté extrahován z každého vzorku, upraven na stejnou koncentraci a podroben elektroforéze na gelu SDS-PAGE. Proteiny byly poté přeneseny na nitrocelulózovou membránu a membrána byla blokována 5% odstředěným mlékem po dobu 1 hodiny. Byly přidány kozí anti-stafylokokové polyklonální protilátky proti hemolyzinu (Abcam) v konečné koncentraci 2 μg / ml. Reakční směs byla poté inkubována při 4 ° C přes noc. Po promytí membrány byly přidány králičí anti-kozí IgG protilátky zředěné HRP v poměru 1: 1000 a inkubovány 2 hodiny při 37 ° C. Nakonec byly pro vývoj barev přidány chemiluminiscenční substráty. Exprese a-hemolysinu byla nakonec pozorována pod zobrazovačem.
Testování antimikrobiální citlivosti SIHP
K provedení screeningu antimikrobiální citlivosti byla použita metoda ředění mikrotitrační bujóny. Postup byl proveden podle provozní příručky automatizovaného mikrobiologického systému Phoenix-100. Výsledky tohoto screeningu byly interpretovány pomocí kritérií M100-S24 zavedených Institutem pro klinické a laboratorní standardy (CLSI; Clinical and Laboratory Standards Institute, 2014). Status S. aureus rezistentní na methicilin (MRSA) byl stanoven pomocí MIC (minimální inhibiční koncentrace) dvou antibiotik. U kmenů SIHP byla MIC pro oxalalin ≥ 4 μg / ml a MIC pro cefoxitin ≥ 8 μg / ml.
Detekce genů mecA a tst
Všech 60 SIHP kmeny byly testovány na gen mecA rezistence na léčivo a gen virulence tst. Po buněčné lýze pomocí lysostafinu byla provedena varná extrakce genomové DNA. Geny mecA a tst byly poté amplifikovány z genomové DNA pomocí soupravy DreamGreen Taq. Podmínky PCR byly následující: pre-denaturace při 94 ° C po dobu 3 minut, denaturace při 94 ° C po dobu 30 s, žíhání při 50 ° C po dobu 30 s, extenze při 72 ° C po dobu 1 minuty. Produkty PCR byly sekvenovány a analyzovány metodou BLAST, aby se potvrdilo, že se jedná o očekávané produkty. Sekvence genu mecA rezistentního na léčivo a genu virulence tst S. aureus byly získány z databáze GenBank. K návrhu primerů byl použit software Primer 5.0 (tabulka 1) a tyto primery byly syntetizovány společností Sangon Biotech Co., Ltd. (Šanghaj, Čína).
Detekce přežití kmenů SIHP S. aureus v Makrofágy
Pro srovnání přežití kmenů S. aureus SIHP v makrofázích s přežitím tst negativních kmenů S. aureus SCHP byla udržována lidská monocytová buněčná linie THP-1 v RPMI-1640 obsahujícím 10% (v / v) FBS při 37 ° C v atmosféře obsahující 5% (v / v) CO2. Pro infekci makrofágy byly THP-1 buňky naočkovány v množství 5 x 105 buněk na jamku do 24jamkových misek pro tkáňové kultury a indukovány k diferenciaci 10-7 M forbol 12-myristát 13-acetátem (PMA) po dobu 48 hodin. Přibližně 3 × 108 jednotek tvořících kolonie (CFU) logaritmické fáze (OD600 0,5–0,6) bakterií bylo peletováno centrifugací, dvakrát promyto PBS a resuspendováno v 1 ml RPMI-1640. Poté byly do buněčné monovrstvy přidány bakterie při MOI 20: 1 a centrifugovány po dobu 5 minut při 1000 otáčkách za minutu. Infikované buňky byly inkubovány po dobu 20 minut při 37 ° C, poté byly třikrát promyty předehřátým PBS (pH 7,4) a inkubovány po dobu další 1 hodiny v médiu obsahujícím 100 μg / ml gentamicinu, aby se zabily extracelulární bakterie. Buňky byly promyty a lyžovány za účelem kvantifikace intracelulárních bakterií jako vzorku v čase nula (TO). Další buňky byly shromážděny po 12 nebo 24 hodinách inkubace v přítomnosti čerstvého doplněného média pro tkáňové kultury obsahujícího 12 ug / ml gentamicinu.Růst bakterií v buňkách THP-1 byl stanoven vydělením počtu intracelulárních bakterií po 12 hodinách nebo 24 hodinách počtem v čase 0 (T12 / T0 nebo T24 / T0). Pokus byl nezávisle opakován třikrát.
Detekce cytokinové sekrece makrofágů infikovaných kmeny SIHP S. aureus
Supernatanty kultury makrofágů THP-1 infikovaných po dobu 12 hodin bakteriemi byly shromážděny. Hladiny cytokinů byly měřeny průtokovou cytometrií FACSCalibur (BD) s použitím CBA Human Thl / Th2 Cytokine Kit II (BD) podle pokynů výrobce.
Psaní a analýza multilokusových sekvencí
Výsledky
Hemolytický fenotyp kmenů SIHP na krevních destičkách s ovčím agarem
Jak je znázorněno na obrázcích 1A, B, byl u kontrolní S pozorován kompletní hemolytický kruh (β-hemolytický fenotyp) kmeny aureus po kultivaci kmenů na plotnách s krevním agarem po dobu 24 hodin. U kmenů SIHP však byly zobrazeny různé hemolytické fenotypy (zde nazývané neúplný hemolytický fenotyp). Kromě toho byl neúplný hemolytický fenotyp pozorován u kmenů SIHP, které rostly v různých podmínkách podmínky včetně mikroaerofilních, aerobních a anaerobních podmínek (obrázky 1C – E). Navíc po 10 sériových pasážích byl tento neúplný hemolytický fenotyp stále udržován (obrázek 1F).
relativní Úrovně exprese mRNA čtyř hemolysinových genů
Jak je znázorněno na obrázku 2, hladiny exprese čtyř hemolysinových genů hla, hlb, hlgC a hld v kmenech SCHP nevykazovaly žádné statisticky významné rozdíly (p > 0,05) ve srovnání s kontrolními kmeny ATCC25923. Hladiny exprese hla, hlgC a hld v kmenech SIHP však byly významně potlačeny o 50-, 16,7- a 8,3krát (p < 0,05) ve srovnání s hladinami kontrolní kmeny ATCC25923 a SCHP kmeny, zatímco exprese hlub v kmenech SIHP byla významně zvýšena 7,7krát ve srovnání s kontrolami (p < 0,05).
Detekce α-hemolysinu metodou Western Blot
α-hemolysin kódovaný gen hla je toxin tvořící póry vylučovaný S. aureus a jeho molekulová hmotnost je 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). Analýza Western blot ukázala, že exprese a-hemolysinu v kmenech SIHP byla 40krát nižší než u kmenů SCHP a kontrolních kmenů, což odpovídá údajům qRT-PCR (obrázek 3).

Obrázek 3. Western blot α-hemolysinu u S. aureus. ATCC29213: kontrola S. aureus s úplným hemolytickým fenotypem; SCHP: S. aureus s úplným hemolytickým fenotypem izolovaným z klinických vzorků ve stejném období; SIHP: S. aureus s neúplným hemolytickým fenotypem.
Léková rezistence SIHP
Testována citlivost na léky pomocí zředění mikrotitrační půdy bylo prokázáno, že hodnoty MIC pro oxacilin a cefoxitin byly > 2 a > 8 μg / ml v 60 barvách SIHP . Podle pokynů CLSI M100-S24 je všech 60 kmenů SIHP klasifikováno jako kmeny MRSA. PCR také detekovala gen mecA u všech 60 kmenů.
Testování genu tst
Gen tst je důležitým faktorem virulence u S. aureus. PCR ukázala, že všech 50 kmenů SIHP neslo geny tst.
Schopnost přežití kmenů S. aureus SIHP v makrofágech je větší než schopnost tst negativních S. aureus
Porovnali jsme schopnosti intracelulárního přežití kmenů SIHP a tst negativního kmene SCHP v makrofázích. Počítáním počtu bakterií získaných z destiček jsme zjistili, že schopnost intracelulárního přežití kmene SIHP byla mnohem vyšší než schopnost tst negativního kmene S. aureus po infikovaných makrofágech odvozených od THP-1 12 nebo 24 hodin (obrázek 4). Předběžně jsme spekulovali, že kmeny SIHP mají potenciálně vysokou virulenci, a bylo navrženo, aby SIHP byla věnována větší pozornost v nemocnici.
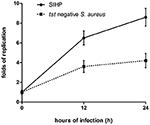
Obrázek 4. Přežití kmenů SIHP a tst negativního S. aureus v makrofágech odvozených od THP-1. Poté, co byly makrofágy infikovány bakteriemi po dobu 12 a 24 hodin, byly makrofágy lyžovány a intracelulární přežívající bakterie byly umístěny na LB agar. Záhyby replikace intracelulárních přežívajících bakterií byly vypočítány podle počtu kolonií na výše uvedené LB agarové plotně.
Sekreční rozdíly cytokinů a chemokinů makrofágů infikovaných kmeny SIHP S. aureus a negativním S. aureus
Porovnat rozdíly v sekreci cytokinů a chemokinů v makrofágech odvozených od THP-1 infikovaných kmenem SIHP a negativním S.kmen aureus jsme detekovali prozánětlivé cytokiny průtokovou cytometrií v kultivačním supernatantu makrofágů infikovaných kmeny SIHP a tst negativním kmenem S. aureus. Výsledky ukázaly významně vyšší indukci IL-2, IL-6 a IL-17A u kmenů SIHP, ale ne u tst negativních S. aureus, což naznačuje, že kmeny SIHP indukují cytokinové / chemokinové reakce v makrofázích (obrázek 5). Ostatní cytokiny IL-4, IL-10, INF-y a TNF vylučované makrofágy nebyly zjevnými rozdíly mezi kmeny SIHP a tst negativními skupinami postiženými S. aureus.
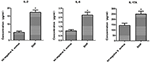
Obrázek 5. Detekce cytokinů a chemokinů vylučovaných makrofágy infikovanými S. aureus. * P < 0,05.
Psaní sekvencí multilocus
Stanovili jsme multilokusový genotyp 60 izolátů SIHP shromážděných od pacientů přijatých do naší nemocnice v letech 2013 až 2014. Bylo použito schéma sedm lokusů doporučené v databázi MLST S. aureus. Analýza MLST ukázala, že všechny kmeny SIHP byly klasifikovány do klonu ST5.
Diskuse
Hemolysin je jedním z nejdůležitějších faktorů virulence pro S. aureus (Wiseman, 1975). Kombinované účinky každého ze čtyř druhů hemolysinu vedou k destrukci membrány červených krvinek, což vede k vytvoření úplného transparentního hemolytického prstence na destičkách krevního agaru. V posledních letech byly SIHP nalezeny v klinických vzorcích druhé přidružené nemocnice Soochow University. V této studii jsme se snažili tyto kmeny identifikovat a studovat jejich vlastnosti v mikrobiologii. Zpočátku jsme k izolaci, inkubaci a sériovému průchodu kmenů použili různé komerční nebo samostatně připravené agarové desky z ovčí krve. Ukázali jsme, že existují některé kmeny, které vykazují a udržují neúplný hemolytický fenotyp i po delší subkultuře. Lze tedy vyloučit možnost, že tento fenotyp je vyvolán nebakteriálními faktory. Naše studie naznačují, že SIHP může být podmnožinou jedinečných kmenů S. aureus.
Předchozí studie naznačovaly, že králičí červené krvinky jsou vysoce citlivé na α-hemolyzin (Hildebrand et al., 1991). Berube et al. uvádí, že účinek α-hemolysinu na lýzu červených krvinek je závislý na koncentraci (Berube a Bubeck Wardenburg, 2013). γ-hemolyzin může poškodit červené krvinky lidí a zvířat (Kaneko a Kamio, 2004). Zatímco δ-hemolyzin poškozuje červené krvinky, pouze při vysokých koncentracích tvoří transmembránový pór, který lyžuje buněčnou membránu (Verdon et al., 2009). V této studii jsme ukázali, že exprese čtyř hemolysinů kmenů SIHP a kmenů SCHP má významně odlišné profily transkripční exprese. Exprese a-, γ-, δ-hemolysinu v kmenech SIHP, které by mohly přímo poškodit červené krvinky, je mnohem nižší než u kmenů SCHP, zatímco β-hemolysin má mnohem vyšší hladiny exprese ve srovnání s kmeny SCHP. Kromě toho byla úroveň exprese proteinu a-hemolysinu dále ověřena westernovým přenosem. Bylo hlášeno, že β-hemolyzin převážně zvyšuje citlivost červených krvinek na jiné toxiny namísto přímé lýzy buněk, pokud nejsou buňky kultivovány při nižších teplotách (Vandenesch et al., 2012). V této studii byla u kmenů SIHP detekována vysoká exprese β-hemolysinu, ale kompletní hemolytický kruh nebyl nikdy pozorován u kmenů SIHP, i když byly inkubovány při 4 ° C. Tyto výsledky naznačují, že pozorovaným neúplným fenotypem kmenů SIHP jsou s největší pravděpodobností účinky všech čtyř hemolysinů, které jsou vyjádřeny odlišným způsobem ve srovnání s kmeny SCHP. Předchozí studie ukázaly, že během chronické patogeneze může kombinovaný účinek selektivních tlaků vyplývajících z antibiotik včetně ciprofloxacinu a trimethoprimu a imunitní reakce hostitele vést ke zvýšené expresi α-hemolysinu, což je velmi důležité pro kolonizaci S aureus na sliznici, zejména při infekcích dýchacích cest (Goerke et al., 2006; Huseby et al., 2010). V této studii byli všichni pacienti infikovaní SIHP dlouhodobě léčeni širokospektrými antibiotiky, ať už tento selektivní tlak vyvolával nadměrnou expresi genů rezistentních na léčiva a interferoval s expresí hemolysinových genů, zůstává možnost, která potřebuje další vyšetření.
Abychom prozkoumali mikrobiologické vlastnosti SIHP, provedli jsme testy antimikrobiální citlivosti a vybrali jsme gen virulence tst, který je spojen s patogenitou S. aureus. Zjistili jsme, že všech 60 kmenů SIHP lze klasifikovat jako kmeny MRSA a nést gen mecA. Výsledky testů antimikrobiální citlivosti ukázaly, že i po 10 pasážích se z těchto 60 kmenů SIHP hodnoty MIC linezolidu a teikoplaninu pouze u tří kmenů SIHP změnily jen málo.Tyto změny hodnot MIC však neměly vliv na hodnocení výsledků antimikrobiální citlivosti. Gen virulence tst kóduje toxin syndromu toxického šoku (TSST-1) (Kreiswirth, 1989). Jako super antigen TSST-1 zvyšuje šokové a imunitní potlačovací reakce vyvolané endotoxiny (Kulhankova et al., 2014). Testování PCR zjistilo, že všech 60 kmenů SIHP vlastnilo gen tst, což naznačuje zvýšenou virulenci. V poslední době mnoho zpráv ukázalo, že S. aureus může přežít v lidských makrofágech odvozených od monocytů a tyto kmeny S. aureus jsou virulentnější (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi a Bishayi, 2016). Proto jsme porovnali schopnosti intracelulárního přežití kmenů SIHP a kmenů SCHP, což je tst negativní S. aureus v makrofázích, a zjistili jsme, že schopnost intracelulárního přežití kmene SIHP byla mnohem vyšší než schopnost tst negativního kmene S. aureus. Analýza údajů o pacientech navíc ukázala, že účinek antiinfekční terapie u většiny pacientů infikovaných kmeny SIHP byl horší než u podobných pacientů infikovaných kmeny SCHP (data nejsou uvedena). Naše studie poskytuje předběžné experimentální důkazy spekulací, že kmeny SIHP mají potenciálně vysokou virulenci.
Během procesu infekce invazivního S. aureus iniciují molekuly spojené s patogeny vrozený imunitní systém vedoucí k aktivaci a náboru neutrofilů a makrofágů a produkce prozánětlivých cytokinů, zejména TNF-a, IL-1β a IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Bylo hlášeno, že sekrece zánětlivých cytokinů IL-6 se zvyšovala se zvyšujícími se koncentracemi S. aureus (Chen et al., 2016). Kromě toho jsou superantigenní S. aureus zvláště účinné při stimulaci produkce IL-17 (Islander et al., 2010). V této studii vykazovaly kmeny SIHP významně vyšší indukci IL-2, IL-6 a IL-17A makrofágů ve srovnání s tst negativními kmeny SCHP, což naznačuje, že kmeny SIHP by mohly indukovat větší sekreci cytokinů proti zabíjejícímu účinku makrofágů. Analýza MLST navíc ukázala, že všechny kmeny SIHP byly klasifikovány do klonu ST5. Kromě toho byly tyto kmeny SIHP seskupeny dohromady v lázeňském typu t2460 (data nejsou uvedena).
Celkově vzato může být SIHP novou podskupinou MRSA s potenciálně vysokou virulencí a měla by být věnována větší pozornost kontrola a léčba těchto kmenů v nemocnicích.
Autorské příspěvky
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl proveden bez komerčních výsledků nebo finanční vztahy, které lze chápat jako potenciální střet zájmů.
Poděkování
Tuto studii podpořila Čínská národní přírodovědecká nadace (81572032, 81401636), Přírodní věda Nadace pro vysoké školy a univerzity v provincii Jiangsu (16KJB320006) a program vědy a technologie v Su-čou (SYSD2014094, SYS201551, SS201638).
Klinické a laboratorní Standards Institute (2014). Výkonové standardy M100-S24 pro testování antimikrobiální citlivosti; Dvacátý čtvrtý informační dodatek. Wayne, PA: CLSI.
Nandi, A. a Bishayi, B. (2016). Intracelulárně přežívající Staphylococcus aureus po fagocytóze jsou virulentnější při indukci cytotoxicity u čerstvých myších peritoneálních makrofágů s využitím TLR-2 jako možného cíle. Microb. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Wiseman, G. M. (1975). Hemolysiny Staphylococcus aureus. Bacteriol. Rev. 39, 317–344.
PubMed Abstract | Google Scholar