Fyzikální geologie
Převážná většina minerálů, které tvoří horniny zemské kůry, jsou silikátové minerály. Mezi ně patří minerály, jako je křemen, živce, slída, amfibol, pyroxen, olivín a velké množství jílových minerálů. Stavebním kamenem všech těchto minerálů je čtyřstěn křemíku, kombinace čtyř atomů kyslíku a jednoho atomu křemíku. Jsou uspořádány tak, že roviny tažené atomy kyslíku tvoří čtyřstěn (obrázek 2.6). Protože křemíkový ion má náboj +4 a každý ze čtyř iontů kyslíku má náboj –2, má čtyřstěn křemíku čistý náboj –4.
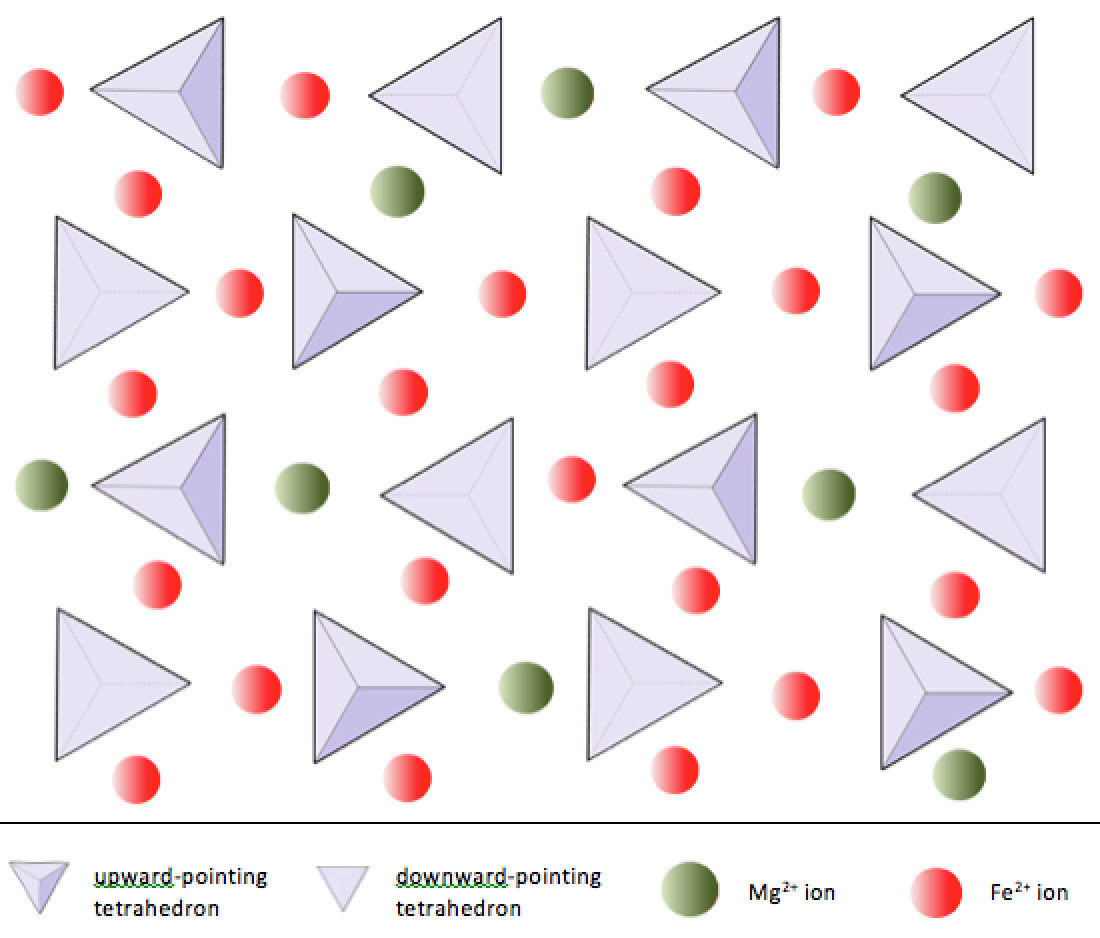
V křemičitých minerálech jsou tyto čtyřstěny uspořádány a propojeny různými způsoby, od jednotlivých jednotek až po složité rámce (obrázek 2.9). Nejjednodušší silikátová struktura, kterou tvoří minerální olivín, se skládá z izolované čtyřstěny vázané na ionty železa a / nebo hořčíku. V olivínu je náboj –4 každého čtyřstěnu oxidu křemičitého vyvážen dvěma dvojmocnými (tj. +2) kationty železa nebo hořčíku. Olivín může být buď Mg2SiO4 nebo Fe2SiO4, nebo kombinace těchto dvou (Mg, Fe) 2SiO4. Dvojmocné kationty hořčíku a železa jsou v okruhu dost blízko (0,73 proti 0,62 angstromu). Kvůli této podobnosti velikostí a protože jsou to dvojmocné kationty (oba mají náboj +2), mohou se železo a hořčík snadno navzájem nahradit v olivínu a v mnoha dalších minerálech.
| Konfigurace čtyřstěnu | Ukázkové minerály | |
|---|---|---|
 |
izolovaný (nesosilikáty) | olivín, granát, zirkon, kyanit |
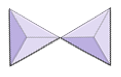 |
páry (sorosilikáty) | epidid, zoisit |
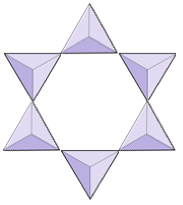 |
kroužky (cyklosilikáty) | turmalín |
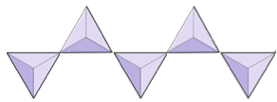 |
Jednotlivé řetězce (inosilikáty) | Pyroxeny, wollastonit |
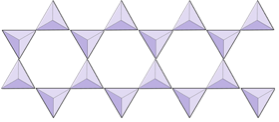 |
Dvojité řetězce (inosilikáty) | Amphiboles |
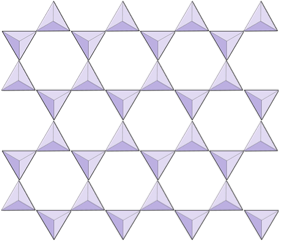 |
Listy (fylosilikáty) | Slídy, jílové minerály, hadec, chloritan |
| trojrozměrný struktura | rámec (tectosilicates) | živce, křemen, zeolit |
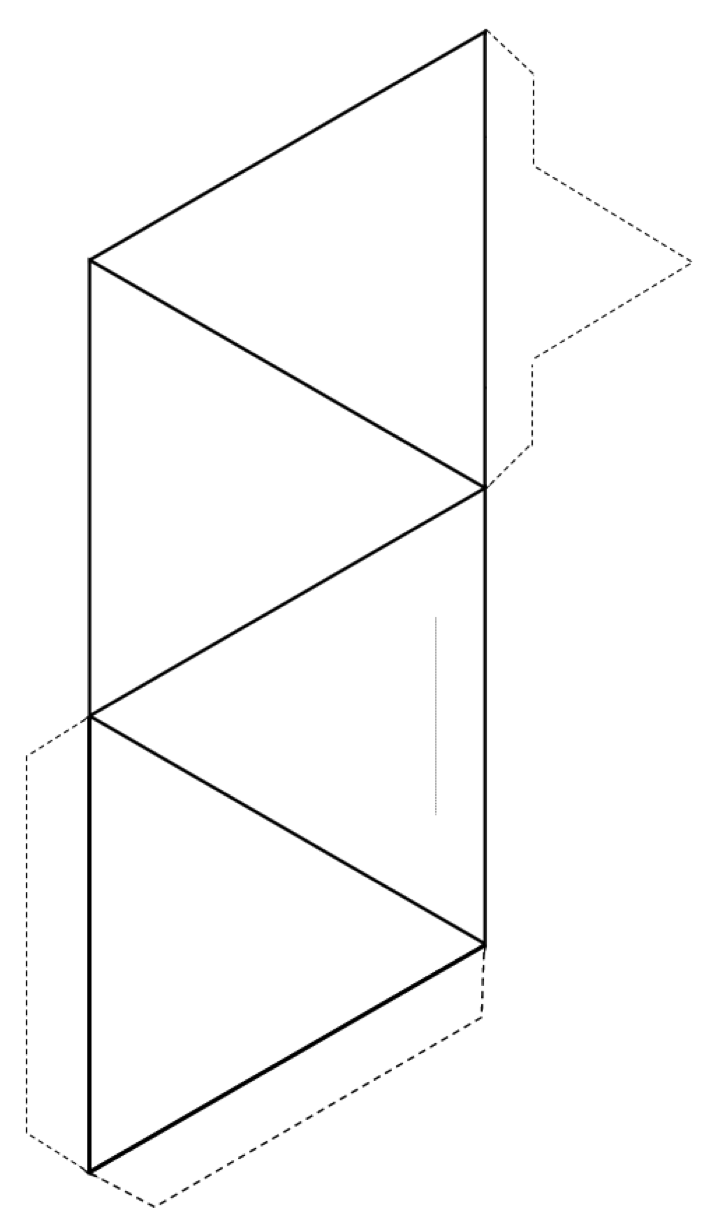
Cvičení 2.3 Vytvořte čtyřstěn
Vystřihněte kolem vnějšku tvaru (plné čáry a tečkované čáry) a potom složením podél plných čar vytvořte čtyřstěn.
Pokud máte lepidlo nebo pásku, zajistěte záložky do čtyřstěnu, aby to drželo pohromadě. Pokud nemáte lepidlo nebo pásku, vytvořte řez podél tenké šedé čáry a vložte špičatou záložku do štěrbiny.
Pokud to děláte v učebně, zkuste spojit svůj čtyřstěn s ostatními do páry, prsteny, jednoduché a dvojité řetězce, listy a dokonce i trojrozměrné rámce.
V olivínu, na rozdíl od většiny ostatních silikátových minerálů, nejsou křemíkové čtyřstěny vázány ke každému jiný. Jsou však vázány na železo a / nebo hořčík, jak je znázorněno na obrázku 2.10.
Jak již bylo uvedeno, +2 ionty železa a hořčíku jsou podobné co do velikosti (i když ne úplně stejné). To jim umožňuje navzájem se nahrazovat v některých silikátových minerálech. Běžné ionty v silikátových minerálech mají ve skutečnosti širokou škálu velikostí, jak ukazuje obrázek 2.11. Všechny zobrazené ionty jsou kationty, s výjimkou kyslíku. Pamatujte, že železo může existovat jako iont +2 (pokud během ionizace ztratí dva elektrony) nebo iont +3 (pokud ztratí tři). Fe2 + je známý jako železné železo. Fe3 + je známý jako železité železo. Iontové poloměry jsou rozhodující pro složení silikátových minerálů, proto budeme na tento diagram odkazovat znovu.

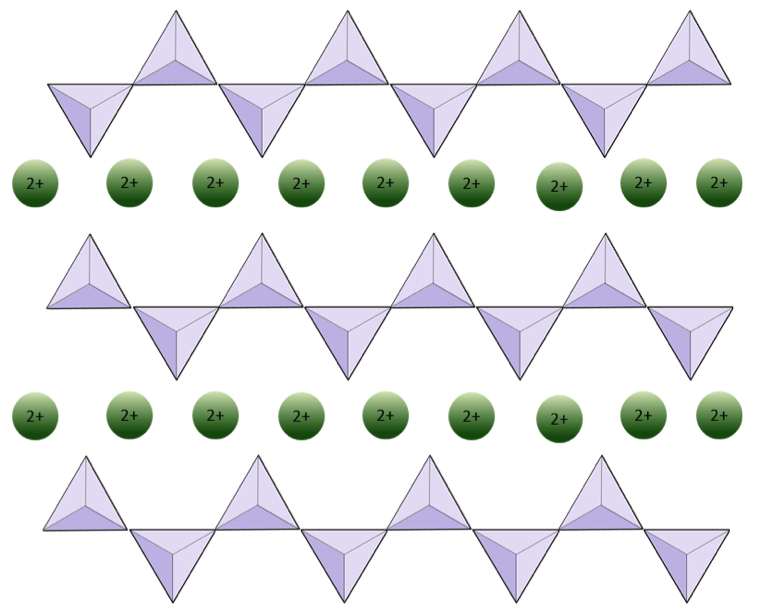
Struktura jednořetězcového křemičitý pyroxen je znázorněn na obrázcích 2.12 a 2.13. V pyroxenu jsou křemíkové čtyřstěny spojeny dohromady v jediném řetězci, kde je jeden kyslíkový iont z každého čtyřstěnu sdílen se sousedním čtyřstěnem, a proto je ve struktuře méně kyslíků.Výsledkem je, že poměr kyslíku k křemíku je nižší než v olivínu (3: 1 místo 4: 1) a čistý náboj na atom křemíku je menší (–2 místo –4), protože je zapotřebí méně kationtů k vyrovnání tohoto poplatku. Pyroxenové kompozice jsou typu MgSiO3, FeSiO3 a CaSiO3, nebo jejich kombinace. Pyroxen lze také psát jako (Mg, Fe, Ca) SiO3, kde prvky v závorkách mohou být přítomny v jakémkoli poměru. Jinými slovy, pyroxen má jeden kation pro každý čtyřstěn křemene (např. MgSiO3), zatímco olivin má dva (např. Mg2SiO4). Protože každý křemíkový iont je +4 a každý iont kyslíku je –2, tři atomy kyslíku (–6) a jeden křemík (+4) dávají čistý náboj –2 pro jediný řetězec čtyřstěnů oxidu křemičitého. V pyroxenu vyvažuje jeden dvojmocný kation (2+) na čtyřstěn ten náboj –2. V olivínu jsou zapotřebí dva dvojmocné kationty k vyrovnání náboje –4 izolovaného čtyřstěnu.
Struktura pyroxenu je více „tolerantní“ než struktura olivinu – což znamená, že kationty se širším rozsahem iontových poloměrů se do ní vejde. Proto mohou pyroxeny obsahovat kationty železa (poloměr 0,63 Å) nebo hořčíku (poloměr 0,72 Å) nebo vápníku (poloměr 1,00 Å).
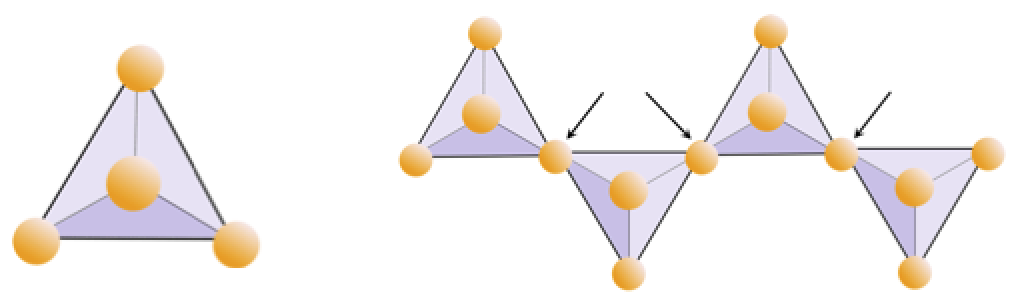
Cvičení 2.4 Deprivace kyslíku
Diagram níže představuje jeden řetězec v silikátovém minerálu. Spočítejte počet čtyřstěn versus počet iontů kyslíku (žluté koule). Každý čtyřstěn má jeden křemíkový iont, takže by to mělo dávat poměr Si k O v jednořetězcových silikátech (např. Pyroxenu).
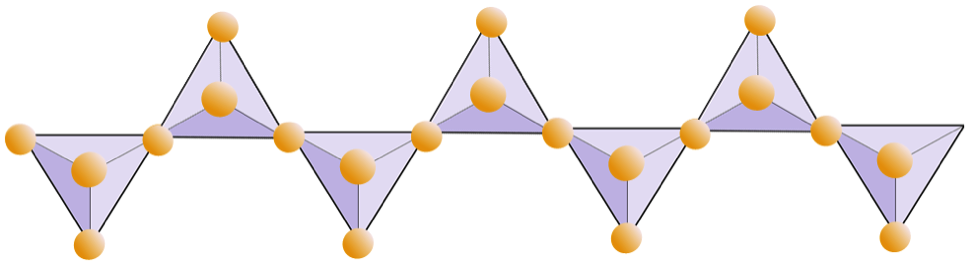
Níže uvedený diagram představuje dvojitý řetězec v silikátovém minerálu. Opět spočítejte počet čtyřstěn versus počet iontů kyslíku. To by vám mělo dát poměr Si k O v dvojřetězcových silikátech (např. Amfibol).
V amfibolových strukturách jsou čtyřstěn křemíku spojeny do dvojitého řetězce, který má poměr kyslíku k křemíku nižší než poměr pyroxenu, a proto je k vyrovnání náboje zapotřebí stále méně kationtů. Amfibol je ještě tolerantnější než pyroxen a jeho složení může být velmi složité. Hornblende může například zahrnovat sodík, draslík, vápník, hořčík, železo, hliník, křemík, kyslík, fluor a hydroxylový ion (OH–).
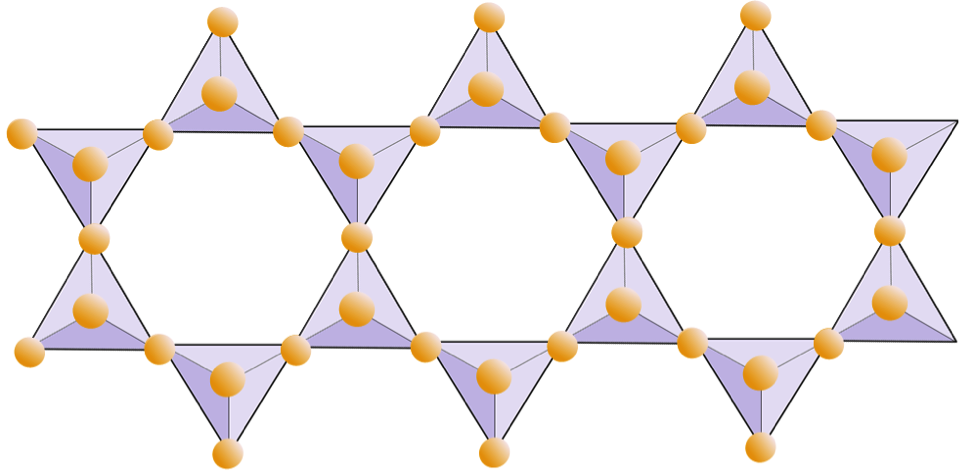
Ve slídových strukturách křemenné čtyřstěny jsou uspořádány do souvislých listů, kde každý čtyřstěn sdílí tři anionty kyslíku se sousedními čtyřstěnmi. Existuje ještě větší sdílení kyslíků mezi sousedními čtyřstěnmi, a proto je pro listové minerály křemičitanu zapotřebí méně kationů vyrovnávajících náboj. Vazba mezi listy je relativně slabá, což odpovídá dobře vyvinutému jednosměrnému štěpení (obrázek 2.14). Biotitová slída může obsahovat železo a / nebo hořčík a to z ní dělá feromagnesiánský silikátový minerál (jako je olivín, pyroxen a amfibol). Chlorit je další podobný minerál, který běžně zahrnuje hořčík. V muskovitové slídě jsou jedinými přítomnými kationty hliník a draslík; proto se jedná o feromagnesiánský křemičitý minerál.

Kromě muskovitu, biotitu a chloritu existuje mnoho dalších plošných silikátů (nebo fylosilikátů), které obvykle existují jako fragmenty velikosti jílu (tj. menší než 0,004 mm). Patří mezi ně jílové minerály kaolinit, illit a smektit, a přestože je obtížné je studovat kvůli jejich velmi malé velikosti, jsou nesmírně důležitými složkami hornin a zejména zemin. minerály mají ve své struktuře také vodu.
Tetrahedry oxidu křemičitého jsou spojeny v trojrozměrných strukturách jak u živců, tak u křemene. Jedná se o neferomagnetické minerály – neobsahují železo ani hořčík.Kromě čtyřstěnů oxidu křemičitého zahrnují živce kationty hliník, draslík, sodík a vápník v různých kombinacích. Křemen obsahuje pouze čtyřstěn křemene.
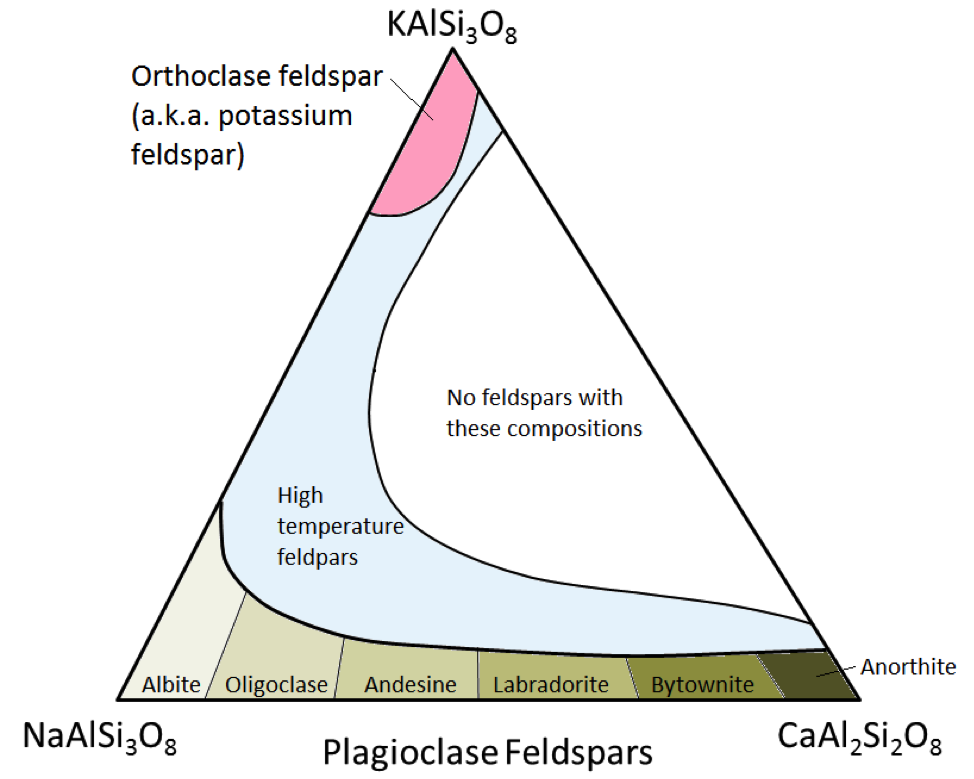
Tři hlavní minerály živců jsou draselný živec (také známý jako K-živce nebo K-spar) a dva druhy živce plagioklasy: albit (pouze sodík) a anorthit (pouze vápník) . Stejně jako v případě železa a hořčíku v olivínu existuje kontinuální řada složení (série tuhých roztoků) mezi albitem a anorthitem v plagioklasu. Důvodem je, že ionty vápníku a sodíku jsou téměř identické co do velikosti (1,00 Å oproti 0,99 Å). Mezi CaAl2Si3O8 a NaAlSi3O8 mohou existovat jakékoli mezilehlé kompozice (obrázek 2.15). To je trochu překvapivé, protože i když mají velmi podobné velikosti, ionty vápníku a sodíku nemají stejný náboj (Ca2 + oproti Na +). Tento problém je vysvětlen odpovídajícím nahrazením Al3 + za Si4 +. Proto je albit NaAlSi3O8 (jeden Al a tři Si), zatímco anorthit je CaAl2Si2O8 (dva Al a dva Si), a živce plagioklasy s mezilehlým složením mají střední podíl Al a Si. Toto se nazývá „vázaná substituce.“
Mezi živci plagioklasu se středním složením jsou oligoklasa (10% až 30% Ca), andesin (30% až 50% Ca), labradorit (50% až 70 % Ca) a bytownit (70% až 90% Ca). K-živce (KAlSi3O8) mají mírně odlišnou strukturu než struktura plagioklasy, a to kvůli větší velikosti iontu draslíku (1,37 Å) a kvůli této velké velikosti , draslík a sodík se navzájem snadno nenahrazují, s výjimkou vysokých teplot. Tyto živec s vysokou teplotou se pravděpodobně vyskytují pouze ve vulkanických horninách, protože rušivé vyvřeliny se ochladí dostatečně pomalu na nízké teploty, aby se živce mohly změnit na jeden z nízkoteplotní formy.
V křemenu (SiO2) jsou křemíkové čtyřstěny spojeny v „dokonalém“ trojrozměrném rámci. Každý čtyřstěn je vázán na čtyři další čtyřstěny (s kyslíkem sdíleným v každém rohu každého čtyřstěnu) a ve výsledku je poměr křemíku k kyslíku 1: 2. Protože jeden křemíkový kation má náboj +4 a dva kyslíkové anionty mají náboj -2, je náboj vyvážený. Není potřeba hliník ani jiné kationty, jako je sodík nebo draslík. Tvrdost a nedostatek štěpení v křemenu je výsledkem silných kovalentních / iontových vazeb charakteristických pro čtyřstěn oxidu křemičitého.
Cvičení 2.5 feromagnetické křemičitany?
Silikátové minerály jsou klasifikovány jako feromagnetické nebo neferomagnetické podle toho, zda mají ve svém vzorci železo (Fe) a / nebo hořčík (Mg). Řada minerálů a jejich vzorce jsou uvedeny níže. U každého uveďte, zda se jedná o feromagnesiánský křemičitan.
| minerální | vzorec | feromagnesiánský křemičitan? |
|---|---|---|
| olivín | (Mg, Fe) 2SiO4 | |
| pyrit | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| pyroxen | MgSiO3 | |
| hematit | Fe2O3 | |
| orthoclase | KAlSi3O8 | |
| křemen | SiO2 |
| minerální | Vzorec * | feromagnesiánský křemičitan? |
|---|---|---|
| amphibole | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetit | Fe3O4 | |
| biotit | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomit | (Ca, Mg) CO3 | |
| granát | Fe2Al2Si3O12 | |
| hadovitý | Mg3Si2O5 (OH) 4 |
- Angstrom je jednotka běžně používaná pro vyjádření atomů – měřítkové rozměry. Jeden angstrom je 10–10 m nebo 0,0000000001 m. Symbol angstromu je Å. Li