Hranice v imunologii
Úvod
Preeklampsie je těhotenství specifické onemocnění postihující 3–5% všech těhotenství (1, 2). Projevuje se nově vzniklou hypertenzí po 20 týdnech těhotenství a proteinurií. Placenta je v patogenezi onemocnění ústřední, protože spojuje matku s plodem (3). Matersko-fetální rozhraní je zóna, kde se setkává geneticky odlišná tkáň fetálního původu s mateřským oběhem, endotelem a imunitním systémem. Obecně přijímaným poznatkem, který se často nazývá nemoc teorií, je, že preeklampsie ovlivňuje mateřský endotel a způsobuje narušení funkce endotelu, což vede k hypertenzi a proteinurii (2). Ve své těžké formě může preeklampsie vést k zpomalení růstu plodu, nedonošenosti a pro matku může způsobit selhání orgánů v ledvinách a játrech a také eklampsii. Preeklampsie může mít navíc dlouhodobé nepříznivé kardiovaskulární důsledky pro matku a novorozence (4). Vývoj placenty je považován za nedostatečný konkrétně v procesu transformace mateřské spirálové tepny, kdy buňky trofoblastu napadají mateřskou stranu do decidua a transformují tepny do vedení s nízkým odporem, což také nahrazuje mateřský endotel (5–7). Tato remodelace děložních tepen obvykle chybí nebo je neúplná, zejména u těžké formy preeklampsie. Vysoká odolnost ve zúžených děložních tepnách způsobuje turbulentní průtok krve do mezilózního prostoru placenty, což způsobuje oxidační stres a mechanické poškození placentárních klků. Výsledné poškození zvyšuje vylučování mikročástic a zánětlivých mediátorů placentou, což vede k generalizované aktivaci a dysfunkci endotelu (8, 9). Tyto následné události v rozhraní matky a plodu vedou k mateřské hypertenzi a dalším příznakům, jak je popsáno výše.
Syndrom HELLP byl poprvé charakterizován v roce 1982 Weinsteinem jako samostatný syndrom, který často představuje společně s preeklampsií, ale je vidět i samostatně (10, 11). Syndrom HELLP je charakterizován hemolýzou, zvýšenými jaterními enzymy a nízkými krevními destičkami. Často vyžaduje pozorování na úrovni intenzivní péče a symptomatickou terapii. Patogeneze syndromu je stále ve stínu. Syndrom HELLP sdílí společné rysy s trombotickými mikroangiopatiemi (TMA), jako je trombotická trombocytopenická purpura (TTP) a hemolyticko-uremický syndrom (HUS). TMA přítomné v rozmanité skupině onemocnění se společnými rysy mikroangiopatické hemolýzy, trombocytopenie a poškození orgánů v důsledku mikrotrombů. U TTP genetická vada nebo jako ve velké většině případů získané autoprotilátky proti dezintegrinu a metaloproteináze s motivem trombospondinu typu 1 13 (ADAMTS13), což je enzym, který štěpí aktivovaný von Willebrandův faktor (vWF), způsobuje tvorbu neobvykle velkého aktivované multimery vWF na endoteliálních buňkách vedoucí k trombům trombocytů v malých cévách a hemolýze. Typický HUS je způsoben bakteriální infekcí produkující Shiga-toxin (zejména Escherichia coli), zatímco atypický HUS (aHUS) označuje typ TMA, u kterého jsou základem genetické nedostatky v regulátorech alternativní dráhy systému komplementu, které v přítomnosti spouště může způsobit klinické onemocnění (12, 13). Léčba aHUS schválená FDA je infuze antagonisty komplementu C5 ekulizumabu, která zabraňuje tvorbě komplexu napadajícího membránu (MAC) (obrázek 1). Klinicky HELLP sdílí stejné příznaky jako klasické TMA: hemolýza, trombocytopenie a orgánová porucha pozorovaná v játrech. V závislosti na použité klasifikaci TMA je syndrom HELLP obvykle kategorizován jako součást sekundárních nebo získaných TMA (tabulka 1).
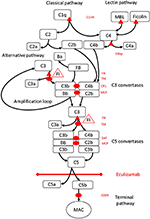
Obrázek 1. Eculizumab inhibuje terminální cestu aktivace komplementu. Aktivace komplementu může být zahájena třemi cestami aktivace, které všechny vedou k tvorbě C5 konvertáz, které mají schopnost aktivovat terminální cestu vedoucí k tvorbě MAC na cílovém povrchu. Toto schematické znázornění systému komplementu ukazuje jeho nejdůležitější aktivátory (černým písmem) a inhibitory (červeně). Aktivátory mohou být vázané na membránu (oválné) nebo rozpustné (trojúhelník). Alternativní cesta se aktivuje spontánně na všech površích, které neumožňují inhibici faktorem H rozpustného regulátoru (FH). FH působí jako kofaktor pro inaktivaci C3b na iC3b faktorem I (FI). Trombomodulin (TM) zvyšuje aktivitu kofaktoru FH. Štěpený faktor B (FB) společně s aktivátorem C3b tvoří alternativní dráhovou konvertázu, která má schopnost štěpit C3 na C3b a vytvářet amplifikační smyčku aktivace alternativní dráhy.Klasická cesta aktivace komplementu může být zahájena například vazbou imunitních komplexů na C1q, zatímco lektinová cesta je aktivována manózami vázajícími lektin (MBL) nebo ficoliny vázajícími se například na vzorce sacharidů na mikrobech. Výsledkem aktivace lektinové dráhy jsou serinové proteázy 1 a 2 asociované s manózou (MASP-1 a MASP-2, bez vyobrazení) štěpící složky komplementu C4 a C2 za vzniku klasické dráhy konvertázy C4bC2b. Inhibitor C1 (C1inh) a C4bp jsou rozpustnými regulátory klasické dráhy, zatímco membránový kofaktorový protein (MCP) a receptor komplementu 1 (CR1) jsou membránově vázané regulátory časných drah komplementu. Tvorba C5 konvertáz iniciuje terminální dráhu aktivace komplementu a štěpení C5 v nepřítomnosti povrchově vázaných regulátorů rozpadu akcelerujícího faktoru (DAF) a MCP. Sestavení MAC je regulováno povrchově vázaným regulátorem CD59 (protectin). Štěpení C3 v časných drahách a C5 v terminální dráze uvolňuje anafylatoxiny C3a a C5a a vede k zánětu. Eculizumab je humanizovaná rekombinantní protilátka proti proteinu komplementu C5, která inhibuje štěpení C5 konvertázami C5, čímž reguluje protrombotické a prozánětlivé účinky aktivace komplementu. Pacient popsaný v této kazuistice byl testován na genetické mutace v genech kódujících Faktor H (CFH), FHR5 a MCP, CFI, CFB, THBD a ADAMTS13 (ADAMTS13), regulátor dráhy vWF koagulační kaskády (ne zobrazeno). Výsledky genetického testování byly negativní.

Tabulka 1. Diagnostická kritéria HELLP a aHUS.
V této případové studii uvádíme pacient s komplikovanou TMA vyvolanou těhotenstvím a úspěšným průběhem léčby.
Prezentace případů
Dvacet devět let stará primigravida byla v gestačním věku 34 + 2 odeslána do helsinské univerzitní nemocnice ambulance s bolestmi v horní části břicha. Zpočátku byl její krevní tlak mírně zvýšený (133/91 mmHg) a měrka byla pozitivní na bílkoviny. Původně uváděná bolest v horní části břicha se postupně zlepšovala. V ultrazvukovém skenování měl plod normální biofyzikální profil (BPP), odhad hmotnosti byl na -2 SD růstové křivce. Kardiotokografie (CTG) byla normální. Hemoglobin v krvi (Hb) byl 115 g / l, trombocyty 158 E9 / L (normální rozmezí 150–360 E9 / L), alaninaminotransferáza (ALT) byla normální (23 U / L). Měrka byla pozitivní na protein (+2) a vypočtená proteinurie byla 1,6 g / 24 h. Bylo rozhodnuto zahájit léčbu kortizonem, aby se usnadnilo zrání plic dítěte. Pacient byl propuštěn s plánem vrátit se další den na kontrolní kontrolu a druhou dávku kortizonu. Jak bylo naplánováno, přišla ke kontrole v gestačním týdnu 34 + 4. Krevní tlak byl 147/87 mmHg, ALT 23, krevní destičky 177, CTG a BPP plodu v ultrazvukovém skenování byly normální. Byla propuštěna a bylo naplánováno další vyšetření. Odpoledne téhož dne se bolest v horní části břicha vrátila a směrem k večeru se neustále zhoršovala. Do nemocnice se vrátila ve 2.20 hod. Pociťovala úzkou bolest v horní části břicha, neklid, dvakrát zvracela a cítila třes. Krevní tlak byl jasně zvýšen na 170/94 mmHg, měrka bílkoviny v moči byla silně pozitivní, ALT byla zvýšena na 159, Hb 122 a trombocyty 172. Byla přijata na prenatální oddělení. Ve 4 hodiny ráno měla bolesti hlavy. Byla zahájena antihypertenzní medikace (Labetalol 100 mg třikrát). Vylučování proteinů močí vyvrcholilo v noci 13 g / 24 h. Následně začala zvracet, měla bolesti v horní části břicha, bolesti hlavy a monitorování CTG ukázalo zpomalení. Pacient byl převezen v 7.11 ráno na porodní oddělení a protože byl děložní čípek rozšířen o tři centimetry, byly plodové membrány uměle rozlomeny kvůli vyvolání porodu. Současně byly laboratorní testy dokončeny pomocí Hb 122, destiček 172. Laktát dehydrogenáza (LD) však byla v tomto okamžiku jasně zvýšena na 1231 U / L. V CTG pokračovala zpomalení a při pokračující bradykardii byl proveden nouzový císařský řez. Dítě kojence (1960 g, -2 SD) se narodilo v 7,25 hodin ráno s hodnotou pH pupečníkové arterie 7,05, BE -6,80, Apgar 1/6/8. Ztráta krve při operaci byla 400 ml.
V 9 hodin po císařském řezu byly krevní destičky matky nízké ve 49, s Hb 102. Odpoledne ALT stoupla na 1800, LD 3570 , hladina kreatininu v séru byla 153 (μmol / L), zatímco počet trombocytů poklesl na 33. Došlo k narušení koagulace indikované nízkou hladinou fibrinogenu (1,1 g / l, referenční hodnoty 2–4 g / l) a vysokou hladinou D -dimer fibrinu (30,2 mg / l, < 0,5 mg / l). Došlo k určitému krvácení z rány císařským řezem, do které byly umístěny další stehy.V tomto okamžiku bylo podáno osm jednotek krevních destiček. Hladina draslíku vzrostla ze 4,7 na 5,6 (mmol / l). Byla jasně pozorována hemolýza. Coombsův test byl negativní. Vylučování močí bylo pouze 10 ml / h. Laboratorní test jasně prokázal závažné onemocnění se známkami poškození ledvin i jater. Kromě toho došlo k narušení koagulačního systému, které současně vykazovalo významnou koagulaci a výraznou fibrinolýzu. Infuze síranu hořečnatého byla zahájena kvůli hyperreflexii, která je považována za prediktivní známku křečí, což je závažná komplikace preeklampsie. Bylo zahájeno intravenózní podání 10 mg dexamethasonu a pacient byl převezen na jednotku intenzivní péče (ICU).
Dále byly vydány laboratorní testy pro účely diferenciální diagnostiky jiných lékařských pohotovostních případů (tabulka 2). Aktivita ADAMTS13 byla normální 62% (40–130%), což vylučuje TTP. Hladiny C3 v séru (0,52 g / l, 0,71–1,41 g / l) a C4 (0,07 g / l, 0,12–0,34 g / l) byly nízké. Hladina rozpustného terminálního komplexu komplementu (C5b-9, 971 ng / ml, < 366 ng / ml) byla zvýšena první den po porodu. Antifosfolipidové protilátky nebyly detekovány, sérologie infekce týkající se hepatitidy B a C a HIV byla negativní. Ze vzorku stolice byly patogeny způsobující typický HUS negativně testovány.

Tabulka 2. Časová osa diagnostiky a léčby nemoci.
Pacient byl léčen výměnou plazmy první a druhý den po porodu a byla v průběhu léčby celkem třikrát hemodialyzována (den 2, 4 a 6 po porodu).
Třetí den po porodu byla pacientka stabilní a byla převezena zpět do zotavovny ženských nemocnic. a symptomatická léčba pokračovala. Hypertenze byla léčena amlodipinem 10 mg dvakrát denně a labetalolem 200 mg třikrát denně. Čtvrtý den po porodu počet krevních destiček pokračoval a pacientovi byla diagnostikována aHUS. aHUS spočívá ve spontánním zotavení pacientů s HELLP obvykle třetí den po porodu. Léčba ekulizumabem byla zahájena (900 mg i.v.). ent byl očkován proti pneumokokům a bylo zahájeno profylaktické antibiotikum (penicilin). Pacientka dostávala dohromady čtyři týdenní dávky ekulizumabu (900 mg) a začala se rychle zotavovat. Po své třetí hemodialýze šestý den po porodu nevyžadovala další hemodialýzu (obrázek 2). Funkce ledvin se postupně upravovala, zvýšil se počet krevních destiček a hemolýza se vyřešila. Čtyři týdny po porodu byly plazmatické hladiny C3 a C4 normalizovány.
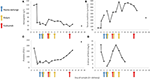
Obrázek 2. Vybrané laboratorní hodnoty pozorované v časných stádiích onemocnění a načasování výměny plazmy, hemodialýzy a podávání ekulizumabu. V panelu (A) je představen vývoj měření krevního hemoglobinu, v panelu (B) hladina kreatininu v séru, v panelu (C) počet krevních destiček a v panelu (D) D-dimer hodnot fibrinu během 17 dnů období sledování.
Při genetickém testování nebyly identifikovány žádné známé genové polymorfismy. Byla testována na mutace v regulátorech komplementu, faktoru H (CFH), proteinu 5 souvisejícím s faktorem H (FHR5) a membránovém kofaktorovém proteinu (MCP), doplňku alternativní dráhy inaktivátoru faktoru I (CFI), aktivátoru alternativní dráhy dráhy B (CFB) ) a následující složky koagulační kaskády: ADAMTS13, trombomodulin (THBD) a intracelulární enzym, diacylglycerolkináza E (DGKE), jejíž mutace jsou známými příčinami aHUS (14). Kromě toho nebyly detekovány ani protilátky proti faktoru H. Nebyl zjištěn žádný nedostatek C4.
Stručně řečeno, náš pacient měl těžkou preeklampsii a splnil diagnostická kritéria pro syndrom HELLP. Ačkoli genetické testy na aHUS zůstaly negativní, klinický průběh onemocnění (zejména těžké akutní poškození ledvin) a reakce na léčbu (zejména ekulizumab) naznačovaly, že náš pacient měl aHUS vyvolaný těhotenstvím.
Diskuse
Primigravida popsaná výše byla diagnostikována s těžkou preeklampsií, HELLP syndromem a těhotenstvím vyvolaným aHUS. Nebyly objeveny žádné známé genové mutace, které by mohly predisponovat k aHUS. Diferenciální diagnostika mezi typy TMA, TTP, HUS / aHUS a sekundárními TMA, jako je syndrom HELLP, je důležitá. Zejména TTP musí být identifikován brzy, protože onemocnění je léčeno rychlou denní výměnou plazmy až do remise (15).
V současné době jsou laboratorní analytické metody pro testování genetických mutací potenciálně způsobujících aHUS schopny ukázat mutace v pouze do 40–60% případů aHUS, přičemž je ponechána možnost falešně negativních případů. Negativní výsledek testu na mutace proto nevylučuje skutečný aHUS (16).Po těhotenství a porodu byl vzácně vyvolán aHUS. V těchto případech se během následujících tří let ~ u 50% vyvinulo chronické onemocnění ledvin (CKD), u některých dokonce v konečné fázi onemocnění ledvin (ESKD). Když byly pozorovány genetické mutace, až u 85% se může vyvinout CKD nebo ESKD (17).
Obecně se uznává, že u hypertenzních poruch těhotenství vede placentární zánět k endoteliální dysfunkci. Pokud je narušena integrita endotelu, má to za následek aktivaci komplementu a koagulaci (18). Předpokládá se také, že narušený mateřský endotel přispívá k morbiditě matky v pozdějším věku spojené s těžkou preeklampsií a jinými hypertenzními poruchami těhotenství (2, 19). Ukázalo se, že poškozený endotel funguje abnormálně i roky po ústupu počátečních diagnostických příznaků (20–23).
Až u 46% pacientů s HELLP byly genové mutace popsány v regulátorech alternativní cesty. systému komplementu (24, 25). V časných stádiích těhotenství, kdy se placenta vyvíjí, je aktivace systému komplementu pozorována u zvýšených hladin Bb v séru u pacientů, u kterých se později vyvinula preeklampsie (26). U těžké preeklampsie a syndromu HELLP byla pozorována aktivace systému komplementu a v moči pacientů se závažnou preeklampsií byly zjištěny zvýšené hladiny terminálního komplexu (C5b-9). U pacientů se syndromem HELLP byla zvýšená aktivace systému komplementu prokázána funkčním testem a dále nedostatkem exprese u CD55 a CD59, což vedlo ke snížené regulaci a exacerbované aktivaci systému komplementu (27–29).
Existuje mnoho podobností sdílených mezi syndromem HELLP a aHUS. U obou stavů je jasně zahrnuta porucha endotelu, následovaná aktivací komplementu a koagulace. U těžké preeklampsie a syndromu HELLP by byl ekulizumab podávaný v časných známkách závažného onemocnění a TMA prospěšný pro ochranu ledvin a mateřského endotelu (30). Zachování endoteliální integrity může potenciálně chránit pacienta před dlouhodobými zdravotními riziky, jako jsou kardiovaskulární onemocnění. Typicky u TMA souvisejících s těhotenstvím klinické nálezy hemolýzy a trombocytopenie vymizí za ~ 3 dny. Pokud aktivita onemocnění trvá déle, je třeba pokračovat v diferenciální diagnostice a teprve poté se zváží alternativní léčba (např. Ekulizumab). Zavedení léčby ekulizumabem dříve by prospělo ženám, protože by bránily poškození ledvin a minimalizovaly turbulence v endotelu a systémový zánět. Eculizumab, podávaný dostatečně brzy a v jedné nebo dvou dávkách, by mohl stačit k zastavení turbulencí a k zastavení kaskády událostí (31). Na jedné straně je ekulizumab velmi drahý lék, ale na druhé straně jsou náklady na intenzivní péči, výměnu plazmy, hemodialýzu, možnou transplantaci ledviny, nemluvě o emocionálních důsledcích pro matky a rodiny, nadále neměnné.
Závěrem bylo, že náš pacient byl těžce nemocný, prožíval hemolýzu, poruchy srážení krve, poškození jater a selhání ledvin vyžadující přijetí na JIP a hemodialýzu. Je možné, že pokud by byl ekulizumab zahájen dříve, při prvních známkách syndromu HELLP, mohl být prospěšný během pozdějšího průběhu onemocnění, což by mohlo zmírnit poškození ledvin, a tak zabránit potřebě hemodialýzy a později CKD. Mohli bychom tedy v této éře moderní imunologické medicíny udělat pro matky a rodiny víc než jen čekat a doufat v to nejlepší?
Etické prohlášení
Etický přezkum a schválení nebylo požadované pro studium lidských účastníků v souladu s místní legislativou a institucionálními požadavky. Pacienti / účastníci poskytli písemný informovaný souhlas s účastí v této studii.
Autorské příspěvky
AL a JH-E vyvinuli myšlenku k rukopisu a napsali rukopis. JH-E a MH se podíleli na diagnostické a terapeutické péči o pacienta. Všichni autoři rukopis zkontrolovali a upravili a schválili jeho finální verzi ke zveřejnění.
Konflikt zájmů
Autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by lze vykládat jako potenciální střet zájmů.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Nepříznivé výsledky těhotenství a budoucí kardiovaskulární onemocnění matek. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The “ velké porodnické syndromy “jsou spojeny s poruchami hluboké placentace. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10,1016 / j.ajog.2010.08.009
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systémové zánětlivé primování v normálním těhotenství a preeklampsii: role cirkulujících syncytiotrofoblastových mikročástic. J. Immunol. (2007) 178: 5949–56. doi: 10,4049 / jimmunol.178.9.5949
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Aktualizace extracelulárních vezikul odvozených od syncytiotrofoblastů v normálním těhotenství a preeklampsii. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Weinstein L. syndrom hemolýzy, zvýšené hladiny jaterních enzymů a nízký počet krevních destiček počet: závažný důsledek hypertenze v těhotenství. Jsem J. Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Diferenciace těžkého syndromu HELLP a trombotická mikroangiopatie, trombotická trombocytopenická purpura a další imitátory. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Porucha funkce endotelu u žen s anamnézou preeklampsie: ukazatel kardiovaskulárního rizika. Am J Physiol Hear Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Zaměstnanci AC. Endoteliální funkce a cirkulující biomarkery jsou po preeklampsii narušeny u žen a dětí. Hypertenze. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Stanhewicz AE. Reziduální vaskulární dysfunkce u žen s preeklampsií v anamnéze. Am J Physiol Regul Integr Comp Compiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. Germinální mutace v alternativní dráze komplementu předisponují k syndromu HELLP. Pohled JCI. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, nová potenciální léčba akutního poškození ledvin spojená s preeklampsií / HELLP syndromem. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | CrossRef Full Text | Google Scholar