Hranice ve fyziologii
Úvod
Arteriální baroreceptory slouží jako senzory první linie k detekci změn krevního tlaku v krevním řečišti. Změny krevního tlaku stimulují mechanosenzitivní nervová zakončení, která jsou lokalizována v arteriálních stěnách. Mechanická síla je přenášena na elektrické signály na nervových zakončeních, což má za následek odpálení akčního potenciálu závislého na tlaku v neuronech baroreceptorů. Nervové signály se poté šíří do kardiovaskulárního kontrolního centra v mozkovém kmeni pro baroreflexní regulaci krevního tlaku (Levy MN, 2007). Kromě toho mají nadrední struktury, včetně klínovitého jádra středního mozku a ventrální mediální prefrontální kůry, také inhibiční roli v regulaci baroreflexu (Verberne et al., 1997).
Existují dva arteriální baroreceptory, jmenovitě: aoreální baroreceptory a karotické baroreceptory, které se nacházejí ve vrstvě adventitia aortálního oblouku a krčních tepen. Aortální baroreceptory detekují krevní tlak v aortě. Buněčná těla (soma) aortálních baroreceptorů jsou umístěna v nodózním ganglionu (NG) (obrázek 1). Nervové signály z nervových zakončení aortálního baroreceptoru jsou přenášeny do uzlového ganglia prostřednictvím senzorického nervu s názvem aortální depresivní nerv (ADN) (obrázek 1). Karotické baroreceptory detekují krevní tlak v krční tepně, který dodává krev do mozku. Nervové zakončení karotických baroreceptorů jsou umístěny bilaterálně na bifurkacích krční tepny, v blízkosti vnitřní krční tepny. Nervové signály z karotických baroreceptorů cestují podél krčních sinusových nervů (CSN) do jejich soma lokalizovaných v petrosal ganglion (PG). Petrosal ganglion vyčnívá za krční foramen (obrázek 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly a Rigual, 2000; Weijnen et al., 2000) . Protože aortální baroreceptory snímají krevní tlak v aortě, který dodává krev do celého systémového oběhu, očekává se, že tyto baroreceptory budou hrát důležitou funkční roli při udržování celkového systémového krevního tlaku. Na druhé straně karotické baroreceptory detekují tlak krve dodávané do mozku. Tyto baroreceptory mohou být důležitější pro udržení stabilního krevního tlaku a průtoku krve mozkem.
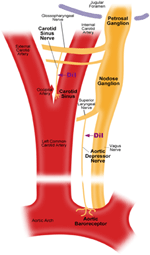
Obrázek 1. Schematický diagram terminálů a nervů baroreceptorů aorty a karotidy. Diagram ilustrující anatomické polohy aortálních a karotických baroreceptorů nervových zakončení, jejich nervových vláken a somatických oblastí. Terminály aortálního baroreceptoru jsou umístěny v aortálním oblouku. Jeho aferentní nervové vlákno je aortální depresorový nerv. Soma je v nodózním ganglionu (NG). Karotický baroreceptor je umístěn ve vnitřní krční tepně vedle bifurkace karotidy. Jeho aferentní nerv je karotický sinusový nerv. Soma se nachází v petrosal ganglion (PG).
Existují protichůdné zprávy o tom, které baroreceptory, aortální baroreceptory nebo karotida baroreceptory, jsou citlivější na změnu krevního tlaku. Někteří vědci uvádějí, že karotické baroreceptory jsou citlivější na tlak (Donald a Edis, 1971; Fadel et al., 2003), zatímco jiní věří, že aortální baroreceptory jsou citlivější na tlak (Glick a Covell, 1968; Pickering et al., 2008), a další neuvádějí žádný rozdíl v citlivosti na tlak mezi těmito dvěma baroreceptory (Hainswor et al., 1970; James a Daly, 1970). Téměř všechny tyto předchozí studie však jako konečné body pro test citlivosti na baroreceptory používaly pouze odpovědi baroreflexu (jako je srdeční frekvence a aktivita sympatiku ledvin). Stále neexistuje žádná studie, která by přímo zaznamenávala a porovnávala tlakovou citlivost neuronů aortálních a karotických baroreceptorů jako takových.
Zde jsme použili vysokorychlostní tlakovou svorku ke změně hydrostatického tlaku uvnitř neuronů baroreceptorů a měřili odpovídající elektrofyziologické odpovědi těchto neuronů upnutím náplastí celé buňky. Rovněž jsme použili jednoosou napínací komoru k protažení neuronů baroreceptorů a změřili jsme odpovídající změny v cytosolickém Ca2 + v těchto neuronech. Kromě toho jsme pro studie na zvířatech in vivo měřili aktivační potenciál vyvolaný tlakem v aortálním depresoru a karotických sinusových nervech, což jsou senzorické nervy aoreálních a karotických baroreceptorů.
Materiály a metody
Zvířata
Všechny pokusy na zvířatech byly prováděny na základě oprávnění vydaného vládou hongkongské zvláštní administrativní oblasti a se souhlasem Etické komise pro experimenty na zvířatech, Čínské univerzity v Hongkongu.Samci krys Sprague-Dawley (S / D) (180–200 g) poskytlo Centrum laboratorních zvířecích služeb na Čínské univerzitě v Hongkongu.
Primární kultura
S / D krysy byly anestetizovány pentobarbitalem sodným (100 mg / kg). Levá cervikální oblast byla exponována řezem ve střední linii za sterilizovaného stavu. Jak je znázorněno na obrázku 1, byl vystaven nerv aortální deprese nebo nerv karotický sinus a 2–3 mm nervu byly opatrně odděleny od okolních tkání tupou disekcí. Fluorescenční lipofilní indikátor 1,1-dioktadecyl-3,3,3 ‚, 3‘-tetramethylindokarbocyanin (DiI), krystaly (Invitrogen) byly naneseny na nerv a pokryty Kwik-Sil (World Precision Instruments, USA). Poté byl řez sešitý. Krysy se nechaly zotavovat po dobu 5–7 dnů, aby se umožnilo barvivu DiI difundovat retrográdně podél aortálního depresivního nervu nebo nervu karotického sinu do somaty umístěné v uzlinovém ganglionu nebo ganglionu petrosal.
Nodose nebo petrosal ganglion neurony byly izolovány z potkanů značených DiI a rozřezány na kousky v ledově studeném EBSS. Byli vystaveni 1 h digesci při 37 ° C trypsinem (1 mg / ml) a kolagenázou IA (1 mg / ml). Jednotlivé neurony byly dispergovány jemnou triturací pipetou Glass Pasteur, následovanou centrifugací. Neurony byly resuspendovány a kultivovány v médiu DMEM / F-12 doplněném 5% FBS, 1% antibiotikum-antimykotikum a 7S NGF (100 ng / ml). Cytosin arabinofuranosid (Ara-C; 10 μM) byl přidán do kultivačního média k inhibici růstu dělících se buněk. Neurony byly před experimenty kultivovány alespoň 3 dny. Pro záznam akčního potenciálu byly neurony čerstvě izolované a inkubovány ve F12 alespoň 30 minut před experimenty. U všech experimentů byly buňky inkubovány na skleněných sklíčkách předem potažených 0,1 mg / ml poly-L-lysinu, s výjimkou experimentů s protahováním buněk, ve kterých byly silikonové komory předem potaženy 2% želatinou.
Patch Clip Náplastové pipety s odporem 3–5 MΩ byly naplněny pipetovým roztokem (v mM): 130 K-glukonát, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 podle KOH. Buňky byly vykoupány v umělé mozkomíšní tekutině (ACSF) (v mM): 120 NaCl, 2 KCl, 1,2 MgS04 · 7H20, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glukóza, ekvilibrováno karbogenem (95% O2 a 5 % CO2). Při současném záznamu svorek byly buňky udržovány na klidovém membránovém potenciálu. K zajištění přetlaku do buňky pomocí mikropipety byl použit vysokorychlostní tlakový upínací systém (HSPC-1, ALA Scientific Instruments, USA). Záznamy byly vzorkovány při 50 kHz a filtrovány při 5 kHz. Data byla analyzována pomocí PulseFit (HEKA). Všechny experimenty byly prováděny při pokojové teplotě.
Zobrazování vápníku
Měření cytosolického Ca2 + bylo prováděno jak je popsáno jinde (Wong et al., 2010). Stručně řečeno, do buněk bylo na 40 minut přidáno 5 uM Fluo-4 / AM. Měření cytosolického Ca2 + bylo prováděno s HEPES-pufrovaným roztokem (v mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2, 10 HEPES, 10 glukózy, pH 7,4 pomocí NaOH. Cytosolická změna Ca2 + v reakci na jednoosé protažení byla provedena systémem STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Buňky byly stimulovány 10, 20 nebo 30% jednosměrného natažení po dobu 1 s. Cytosolická odpověď Ca2 + byla měřena při teplotě místnosti. Fluorescence Fluo-4 byla zaznamenána a analyzována konfokálním zobrazovacím systémem laserového skenování FV1000. Změna cytosolické fluorescenční odezvy Ca2 + byla vyjádřena jako poměr (Fx / F0) fluorescence v reálném čase, kde Fx je signál fluo-4 / AM v reálném čase a F0 je základní signál fluo-4 / AM před natažením.
Záznam aktivity nervů
Krysy byly anestetizovány 100 mg / kg pentobarbitalu sodného. Cervikální oblast byla vystavena řezem ve střední linii. Pravá krční tepna byla izolována a kanylována katétrem, který byl připojen k převodníku tlaku (ML221, ADInstruments, USA) pro záznam krevního tlaku. Levá femorální žíla byla kanylována pro injekci fenylefrinu a SNP. Levý aortální depresorový nerv nebo nerv karotického sinu byl připojen k bipolární stříbrné elektrodě, následovaný zesilovačem (Model 1700 Differential AC Amplifier, A-M Systems Inc., USA). Jak krevní tlak, tak nervová aktivita byly průběžně zaznamenávány v grafu 5.0 (nástroje AD). Nervová aktivita byla zesílena 10 000krát a filtrována při pásmovém propusti 100–5 000 Hz. Hodnoty průměrného arteriálního tlaku, srdeční frekvence a špičkové frekvence v reakci na fenylefrin byly analyzovány pomocí softwaru Chart 5.0. Byla vypočtena změna frekvence špičky (frekvence špičky po fenylefrinu – frekvence špičky před fenylefrinem) v reakci na maximální změnu krevního tlaku (průměrný arteriální krevní tlak po fenylefrinu – průměrný arteriální krevní tlak před fenylefrinem) po injekci fenylefrinu (Lau et al., 2016) .
Statistická analýza
Reprezentativní stopy byly vyneseny jako stopy časového průběhu. Data ze všech experimentů byla shrnuta do sloupcového grafu, který byl vyjádřen v průměru ± sem jednotlivých experimentů. Pro statistickou analýzu byl použit Studentův t-test. V případě potřeby byl použit párový t-test.
Výsledky
Vlastnosti neuronů depresoru aorty a neuronů karotického sinu
Dil byl aplikován buď na aortální depresorový nerv, nebo na karotický sinusový nerv. Proto Dil-značené neurony v nodózním ganglionu zahrnovaly baroreceptorové neurony, které inervují aortální oblouk, a chemoreceptorové neurony, které inervují aortální tělo. Na druhou stranu, Dil-značené neurony v petrosal ganglion zahrnoval baroreceptorové neurony inervující karotický sinus a chemoreceptorové neurony inervující karotické tělo. Nejprve jsme zkoumali základní vlastnosti těchto Dil-značených neuronů. DiI-značené neurony v nodose a petrosal ganglion byly kultivovány odděleně a vystaveny depolarizujícímu elektrickému proudu jako zobrazené na obrázku 2. Byly zaznamenány dva typy odpovědí, jeden reagoval s jediným akčním potenciálem a druhý s kontinuálním akčním potenciálem po depolarizačním proudu (obrázek 2) (Belmonte a Gallego, 1983). Tyto neurony byly následně podrobeny protokolu hydrostatického tlaku, aby se otestovala jejich citlivost na změny hydrostatického tlaku. Rampa pozitivního hydrostatického tlaku byla intracelulárně aplikována přes skleněnou mikropipetu vysokorychlostním tlakovým upínacím systémem (HSPC-1, ALA Scientific Instruments, USA), dokud nebyly vyvolány akční potenciály. Výsledky ukázaly, že 45% neuronů aortického baroreceptoru vystřelilo kontinuální akční potenciály v reakci na depolarizující elektrický proud (tabulka 1A). Z nich 91% (41% / 45%) také reagovalo na změnu hydrostatického tlaku a vykazovalo vystřelení akčního potenciálu závislého na tlaku (tabulka 1A). Zbývajících 55% aortálních baroreceptorových neuronů vypálilo pouze jeden akční potenciál v reakci na depolarizační proud (tabulka 1A) a mezi nimi 40% (22% / 55%) mohlo reagovat na změnu tlaku (tabulka 1A). U neuronů karotického baroreceptoru poskytlo 45% buněk kontinuální akční potenciály, když byly stimulovány depolarizačním proudem (tabulka 1B). Z nich 82% (37% / 45%) bylo také citlivých na změnu tlaku (tabulka 1B). Kromě toho mezi neurony karotického baroreceptoru, které v reakci na depolarizující proud vystřelily pouze jeden akční potenciál, mohlo 24% (13% / 55%) reagovat na změnu tlaku (tabulka 1B).
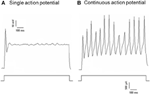
Obrázek 2. Záznam akčního potenciálu z kultivovaného aortálního depresoru a neuronů karotického sinu. Zobrazeny jsou stopy akčních potenciálů, které byly zaznamenány ze dvou reprezentativních neuronů aortálního depresoru / karotického sinu po depolarizujícím proudu. (A) Reprezentativní neurony, které při aktuální stimulaci vystřelí pouze jeden akční potenciál; (B) Reprezentativní neurony, které při aktuální stimulaci vypalují pouze kontinuální akční potenciály. Dolní panel: protokol pro aktuální injekci. Měřítko, horizontální, 100 ms, vertikální, 10 mV (horní stopy) a 500 pA (spodní stopy). n = 27 a n = 38 pro aortální depresor a neurony karotického sinu.

Tabulka 1. Vlastnosti aortálního depresoru a neuronů karotického sinu.
Bez ohledu na to, zda vypálily jediný akční potenciál nebo kontinuální akční potenciál, bylo zjištěno, že 63% neuronů aortálního baroreceptoru značených Dil je citlivých na změnu tlaku, zatímco pouze 50% neuronů karotických baroreceptorů značených Dil změna tlaku (tabulka 1).
Citlivost na natažení neuronů aortální a karotické baroreceptorové
Byla analyzována mezní hodnota tlaku pro výboj akčního potenciálu. Jak je znázorněno na obrázku 3, neurony aortálního baroreceptoru měly nižší prahovou hodnotu tlaku (24 ± 4 mm Hg) než neurony karotických baroreceptorových neuronů (39 ± 4 mm Hg).

Obrázek 3. Citlivost neuronů aortálního a karotického baroreceptoru na hydrostatický tlak. (A, B) Horní panel, reprezentativní časové stopy ilustrující aktivaci akčního potenciálu závislého na tlaku v neuronech aoreální (A) a karotické (B) baroreceptorové. Rampa tlaku (spodní panel) byla aplikována na vnitřek buněk pomocí mikropipety pomocí vysokorychlostního tlakového upínacího systému (HSPC). Měřítko vodorovné, 1 s, svislé, 20 mV a 20 mmHg. (C) Souhrn ukazující prahovou hodnotu tlaku, která iniciuje střelbu akčního potenciálu v neuronech aortálních a karotických baroreceptorů. n = 13 pro aortální baroreceptorové neurony an = 15 pro karotické baroreceptorové neurony. *** p < 0,01, Studentův t-test.
Stretch-indukovaná odpověď Ca2 + v baroreceptorových neuronech
Kultivovaný aortální depresor nebo neurony karotického sinu byly podrobeny 10, 20 nebo 30% jednoosého protažení systémem STREX Cell Stretching System, který se pokouší napodobit protažení cév pod krevním tlakem. Výsledky ukázaly, že jednoosý úsek o 20% vyvolal výrazné zvýšení fluorescence cytosolického Ca2 + v neuronech baroreceptorů aorty, ale ne v neuronech karotických baroreceptorů (obrázky 4A – C). Kromě toho vzrostla velikost fluorescence Ca2 + v reakci na 30% jednoosé protažení byla mnohem vyšší v neuronech baroreceptorů aorty než v neuronech karotidových baroreceptorů (obrázky 4A – C).
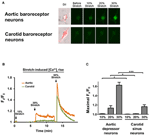
Obrázek 4. Citlivost aortálního depresoru a neuronů karotického sinu na jednoosé protažení. Buňky byly naplněny fluorescenčním barvivem Fluo-4 / AM citlivým na Ca2 +. Zobrazeny jsou reprezentativní obrazy (A) a stopy časového průběhu (B) relativního cytosolického vzestupu Ca2 + v reakci na jednoosý úsek 10, 20 a 30% délky buněk v aortálním depresoru a neuronech karotického sinu. (C) Souhrn maximálního cytosolického vzestupu Ca2 + v reakci na různý stupeň roztažení. Změna v cytosolickém Ca2 + byla vyjádřena jako Fx / F0, kde Fx je signál fluo-4 / AM v reálném čase a F0 je základní signál fluo-4 / AM před natažením. Průměr ± s.m. (n = 5). * p < 0,05, *** p < 0,01 ve srovnání s odpovídající kontrolou pomocí párového t-testu.
Nervová aktivita baroreceptoru in vivo
Nervová aktivita dvou baroreceptorů byla zkoumána in vivo. Fenylefrin byl injikován intravenózně. Změny krevního tlaku po aplikaci fenylefrinu jsou uvedeny v horním panelu na obrázcích 5A, B. Sekvenční změny v aktivitě baroreceptorového nervu jsou zobrazeny ve spodním panelu (obrázky 5A, B). Nervová aktivita indukovaná tlakem byla mnohem vyšší u nervu aortální deprese než u nervu karotického sinu (obrázky 5A, B). Změna frekvence hrotu na zvýšení mmHg je shrnuta na obrázku 5C. Výsledek ukázal, že aortální baroreceptory jsou citlivější na hydrostatický tlak než karotické baroreceptory in vivo.
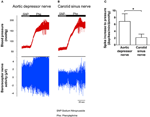
Obrázek 5. Baroreceptorová nervová aktivita u potkanů in vivo. (A, B) Reprezentativní stopy ukazující změnu aktivity aortálního depresivního nervu (A) a aktivity karotického sinu (B) po zvýšení krevního tlaku. U obou (A, B) byla na horním panelu změna krevního tlaku před a po aplikaci Phe, jak je naznačeno vodorovnými pruhy. Dolní panel byla odpovídající změna nervové aktivity. (C) Souhrnná data ukazující změnu nervové aktivity na jednotku změny krevního tlaku. Průměr ± s.m. (n = 8). * p < 0,05 ve srovnání s kontrolou v aortálních baroreceptorech, párovým t-testem.
Exprese kanálů TRP
Bylo hlášeno, že několik kanálů TRP je mechanicky citlivých, včetně TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O „Neil a Heller, 2005; Christensen a Corey, 2007; Pedersen a Nilius, 2007; Patel a kol., 2010; Lau a kol., 2016). Zde jsme zkoumali možnou roli těchto mechanosenzitivních kanálů TRP ve vztahu k aortě a citlivost karotidového baroreceptoru. Byly porovnány exprese mRNA těchto kanálů v nodózním a petrosálním gangliu. Bylo zjištěno, že exprese TRPV4 a TRPC6 byly vyšší v nodózním ganglionu ve srovnání s petrosálním ganglionem (obrázek 6). Je možné, že vyšší vyjádření mechanosenzitivních kanálů v uzlinovém ganglionu může přispět k vyšší citlivosti.
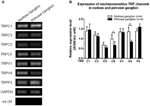
Obrázek 6. Vyjádření mechanosenzitivní TRP kanály v nodózním a petrosálním gangliu. (A) Reprezentativní gelové obrazy porovnávající hladinu exprese mRNA mechanosenzitivních TRP kanálů (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) mezi nodózními a petrosálními gangliovými neurony. Ke srovnání úrovní exprese mRNA několika kanálů TRP ve srovnání s expresí mRNA GAPDH byla použita semikvantitativní analýza RT-PCR. Výsledky 9 experimentů byly shrnuty v (B). Hodnoty byly v průměru ± sem. * p < 0,05, pomocí párového t-testu.
Diskuse
V této studii byly porovnány mechanosenzitivní vlastnosti aoreálních a karotických baroreceptorů. Celobuněčné svorkové studie prokázaly, že ve srovnání s neurony karotického sinu bylo vyšší procento neuronů depresoru aorty citlivé na roztažení. Dále bylo zjištěno, že prahová hodnota tlaku, která by mohla iniciovat odpálení akčního potenciálu, byla nižší v neuronech aortického baroreceptoru než v neuronech karotického baroreceptoru. Rovněž byl srovnán jednoosý protahování vyvolaný cytosolickým Ca2 + mezi aortálním depresorem a neurony karotického sinu.Velikost cytosolického vzestupu Ca2 + v reakci na jednoosý úsek byla mnohem vyšší v neuronech aortálního baroreceptoru než v karotických baroreceptorových neuronech. Neurony aortálního baroreceptoru také vykazovaly nižší práh cytosolických odpovědí Ca2 + na jednoosý úsek. V další sérii experimentů jsme zjistili, že tlakem indukované zvýšení aktivačních akčních potenciálů bylo vyšší v nervu aortální deprese než v nervu karotického sinu. Celkově vzato, naše data poskytují silné důkazy o tom, že aortální baroreceptory jsou citlivější na krevní tlak než karotické baroreceptory.
Dříve bylo vynaloženo značné úsilí k pochopení rozdílu v citlivosti mezi těmito dvěma baroreceptory. Výsledky jsou však kontroverzní. Některé zprávy dospěly k závěru, že aortální baroreceptory jsou citlivější na změnu tlaku (Glick a Covell, 1968; Fan et al., 1996; Pickering et al., 2008), zatímco jiné uvedly, že karotické baroreceptory jsou citlivější na změnu tlaku (Donald a Edis, 1971; Fadel a kol., 2003). Téměř všechny tyto předchozí studie však zahrnovaly velmi komplikované chirurgické zákroky a nakonec využívaly odpovědi baroreflexu, jako je srdeční frekvence a renální sympatický výstup, jako konečné body pro test citlivosti na baroreceptory. Složité chirurgické zákroky jsou náchylné k zavádění experimentálních chyb, které mohou vést ke kontroverzním závěrům. Kromě toho je také možná variace citlivosti baroreceptorů závislá na druhu zvířete. Odpověď baroreflexu navíc není ovlivněna pouze citlivostí baroreceptoru, ale také mnoha dalšími faktory, včetně nervového vedení, centrální mediace, kontraktility krevních cév a funkce srdce. Důkazy z předchozích studií jsou proto nepřímé a stěží ideální. Doposud chybí přímé studie srovnávající tlakovou citlivost neuronů aortální vs. karotické baroreceptorové neurony. V této studii byla mechanosenzitivita studována přímo v neuronech baroreceptorů. Data silně naznačují, že aortální baroreceptory jsou citlivější na tlak než karotické baroreceptory. Tyto informace mohou mít důležitý fyziologický význam v regulaci krevního tlaku.
Není jasné, jaké mechanismy jsou základem rozdílu v citlivosti na tlak mezi aortálními a karotickými baroreceptory. Porovnali jsme úroveň exprese několika mechanosenzitivních TRP kanálů (obrázek 6) (O „Neil a Heller, 2005; Christensen a Corey, 2007; Pedersen a Nilius, 2007; Patel a kol., 2010). Naše výsledky ukázaly, že neurony aortálního baroreceptoru mají vyšší expresi několika mechanosenzitivních TRP kanálů včetně TRPV4 a TRPC6. Je možné, že vyšší exprese TRPV4 a / nebo TRPC6 může přispět k vysoké tlakové citlivosti aortálních baroreceptorů. K ověření role těchto iontových kanálů jsou zapotřebí další studie.
Dříve se uvádělo, že nodózní ganglion a petrosální ganglion obsahují dva různé typy neuronů (Belmonte a Gallego, 1983). Jeden z nich poskytuje kontinuální akční potenciály při elektrické stimulaci, zatímco druhý dává pouze jedinou akci Potenciál při stimulaci. Autoři přiřadili první jako neurony citlivé na tlak a druhý přidělili jako chemo-citlivé neurony. Naše výsledky naznačují, že to nemusí být vhodné Přiřadit neurony citlivé na tlak a neurony citlivé na tlak pouze na základě toho, zda v reakci na depolarizační proud aktivují jediný akční potenciál nebo kontinuální akční potenciály. Ve skutečnosti je velké procento buněk, které v reakci na elektrickou stimulaci aktivují jediný akční potenciál, také citlivé na tlak, a proto patří k baroreceptorovým neuronům snímajícím tlak (obrázek 2 a tabulka 1).
Stručně řečeno, tato studie poskytuje důkaz, že aortální baroreceptory jsou citlivější na tlak než karotické baroreceptory, a přidává nové informace k pochopení základní fyziologie.
Autorské příspěvky
EL a XY navrhují experimenty a zpracovávají rukopis. EL, CL a YY provádějí experimenty. XY, YH, AM a LJ rukopis revidovali. Všichni autoři schválili finální verzi rukopisu.
Financování
Tato práce byla podpořena granty hongkongského výzkumného grantového výboru CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 a RGC-NSFC Joint Grant N_CUHK439 / 13.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl proveden při absenci jakýchkoli obchodních nebo finančních vztahů, které by mohly být považovány za potenciální střet zájmů.
James, JEA a Daly, MDB (1970). Porovnání reflexních vazomotorických reakcí na samostatnou a kombinovanou stimulaci karotického sinu a baroreceptorů klenby aorty pulzním a nepulzativním tlakem u psa. J. Physiol. 209, 257–293. doi: 10,1113 / jphysiol.1970.sp009165
PubMed Abstract | CrossRef Full Text | Google Scholar
Levy MN, P. A. (2007). Kardiovaskulární fyziologie. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. a Luciano, D. S. (1998). Fyziologie člověka: mechanismus tělesné funkce. Boston, MA: WCB McGraw-Hill.