Molekula ATP
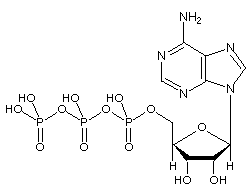
Molekula adenosintrifosfátu (ATP) je známý nukleotid v biochemii jako „molekulární měna“ přenosu intracelulární energie; to znamená, že ATP je schopna ukládat a přepravovat chemickou energii v buňkách. ATP také hraje důležitou roli při syntéze nukleových kyselin.
Pro 3D strukturu tohoto obrázku pomocí JsmolClick klikněte zde
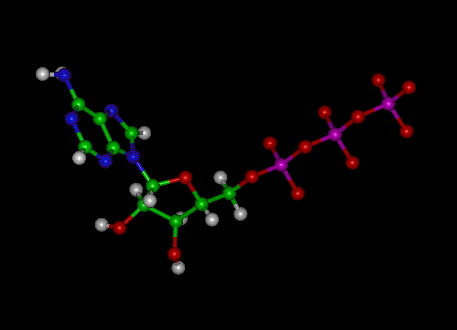
Obrázek: Molekulární struktura ATP
Energie se uvolňuje hydrolýzou třetí fosfátové skupiny. Po uvolnění této třetí fosfátové skupiny může výsledný ADP (adenosindifosfát) absorbovat energii a znovu získat skupinu, čímž regeneruje molekulu ATP; to umožňuje ATP ukládat energii jako dobíjecí baterii.
Pozice fosforylu
Fosforylové skupiny začínající na AMP se označují jako alfa, beta a gama fosfáty.
Fyzikální a chemické vlastnosti
ATP se skládá z adenosinu – složeného z adeninového kruhu a ribózového cukru – a tří fosfátových skupin (trifosfát). Fosforylové skupiny, počínaje skupinou nejblíže k ribóze, se označují jako alfa (α), beta (β) a gama (γ) fosfáty. V důsledku toho úzce souvisí s adenin nukleotidem, monomerem RNA. ATP je vysoce rozpustný ve vodě a je poměrně stabilní v roztocích mezi pH 6,8 a 7,4, ale při extrémním pH je rychle hydrolyzován. Proto se ATP nejlépe skladuje jako bezvodá sůl.
ATP je nestabilní molekula ve vodě bez pufru, ve které hydrolyzuje na ADP a fosfát. Je to proto, že pevnost vazeb mezi fosfátovými skupinami v ATP je menší než pevnost vodíkových vazeb (hydratačních vazeb), mezi jejich produkty (ADP a fosfáty) a vodou. Pokud jsou tedy ATP a ADP ve chemické rovnováze ve vodě, téměř veškerý ATP bude nakonec převeden na ADP. Systém, který je daleko od rovnováhy, obsahuje Gibbsovu volnou energii a je schopen vykonávat práci. Živé buňky udržují poměr ATP k ADP v rovnovážném bodě o deset řádů, přičemž koncentrace ATP jsou pětkrát vyšší než koncentrace ADP. Toto vytěsnění z rovnováhy znamená, že hydrolýza ATP v buňce uvolňuje velké množství volné energie.
Dvě fosfoanhydridové vazby (ty, které spojují sousední fosfáty) v molekule ATP jsou zodpovědné za vysoký obsah energie v tato molekula. V kontextu biochemických reakcí jsou tyto anhydridové vazby často – a někdy kontroverzně – označovány jako vysokoenergetické vazby (navzdory skutečnosti, že k rozbití vazeb je zapotřebí energie). Energie uložená v ATP může být uvolněna hydrolýzou anhydridových vazeb. Primární fosfátová skupina na molekule ATP, která se hydrolyzuje, když je potřeba energie k řízení anabolických reakcí, je γ-fosfátová skupina. Nachází se nejdále od ribózového cukru a má vyšší energii hydrolýzy než α- nebo β-fosfát. Vazby vytvořené po hydrolýze – nebo fosforylace zbytku pomocí ATP – mají nižší energii než fosfoanhydridové vazby ATP. Během hydrolýzy ATP katalyzované enzymy nebo fosforylace pomocí ATP může živá soustava využít dostupnou volnou energii k práci.
Jakýkoli nestabilní systém potenciálně reaktivních molekul by mohl sloužit jako způsob skladování volného energie, pokud si buňka udržovala svoji koncentraci daleko od rovnovážného bodu reakce. Nicméně, jak je tomu u většiny polymerních biomolekul, je rozklad RNA, DNA a ATP na jednodušší monomery řízen jak úvahami o uvolňování energie, tak o zvýšení entropie, a to jak ve standardních koncentracích, tak i v těch koncentracích, které se vyskytují v buňce.
Standardní množství energie uvolněné z hydrolýzy ATP lze vypočítat ze změn v energii za nepřirozených (standardních) podmínek, poté korigovat na biologické koncentrace. Čistá změna tepelné energie (entalpie) při standardní teplotě a tlaku rozkladu ATP na hydratovaný ADP a hydratovaný anorganický fosfát je -30,5 kJ / mol, se změnou volné energie 3,4 kJ / mol. Energie uvolněná štěpením buď fosfátové (Pi) nebo pyrofosfátové (PPi) jednotky z ATP při standardním stavu 1 M jsou:
ATP + H
2O → ADP + Pi ΔG ° = −30,5 kJ / mol (−7,3 kcal / mol)
ATP + H
2O → AMP + PPi ΔG ° = −45,6 kJ / mol (−10,9 kcal / mol)
Tyto hodnoty mohou být slouží k výpočtu změny energie za fyziologických podmínek a poměru buněčných ATP / ADP. Stále častěji se však používá reprezentativnější hodnota (která zohledňuje AMP) nazývaná Energetický náboj. Hodnoty udávané pro Gibbsovu volnou energii pro tuto reakci závisí na řadě faktorů, včetně celkové iontové síly a přítomnosti iontů kovů alkalických zemin, jako jsou Mg2 +
a Ca2 +
.Za typických buněčných podmínek je ΔG přibližně -57 kJ / mol (-14 kcal / mol).
Syntéza
ATP může být produkován různými buněčnými procesy, nejčastěji v mitochondriích oxidační fosforylace za katalytického vlivu ATP syntázy nebo v případě rostlin v chloroplastech fotosyntézou.
Hlavními palivy pro syntézu ATP jsou glukóza a mastné kyseliny. Zpočátku se glukóza v cytosolu štěpí na pyruvát. Pro každou molekulu glukózy jsou generovány dvě molekuly ATP. Terminální fáze syntézy ATP se provádějí v mitochondriích a mohou generovat až 34 ATP.
ATP v lidském těle
Celkové množství ATP v lidském těle je asi 0,1 mol. Energie používaná denně dospělým vyžaduje hydrolýzu 200 až 300 molů ATP. To znamená, že každá molekula ATP musí být během dne recyklována 2 000 až 3 000krát. ATP nelze skladovat, a proto jeho syntéza musí pečlivě sledovat jeho spotřebu.
Jiné trifosfáty
Živé buňky mají také další „vysokoenergetické“ nukleosid trifosfáty, jako je guanin trifosfát. Mezi nimi a ATP lze energii snadno přenášet reakcemi, jako jsou reakce katalyzované nukleosiddifosfokinázou: Energie se uvolňuje při hydrolýze fosfát-fosfátových vazeb. Tuto energii mohou využívat různé enzymy, motorické proteiny a transportní proteiny k provádění práce buňky. Hydrolýza také poskytuje volný anorganický fosfát a adenosindifosfát, který lze dále štěpit na další fosfátový iont a adenosinmonofosfát. ATP lze také rozložit na adenosinmonofosfát přímo za vzniku pyrofosfátu. Výhodou této poslední reakce je, že se jedná o efektivně nevratný proces ve vodném roztoku.
Reakce ADP s GTP
ADP + GTP > ATP + GDP