Molekula cyklohexan
Cyklohexan je cykloalkan s molekulárním vzorcem C6H12. Cyklohexan se používá jako nepolární rozpouštědlo pro chemický průmysl a také jako surovina pro průmyslovou výrobu kyseliny adipové a kaprolaktamu, což jsou meziprodukty používané při výrobě nylonu. V průmyslovém měřítku se cyklohexan vyrábí reakcí benzenu s vodíkem. Díky svým jedinečným chemickým a konformačním vlastnostem se cyklohexan také používá v laboratořích při analýze a jako standard.
Molekula cyklohexanu používající Jsmol viz – Pro 3D struktury
Struktura cyklohexanu Molekula
Šestivrstevný prsten neodpovídá tvaru dokonalého šestiúhelníku. Konformace plochého 2D rovinného šestiúhelníku má značné úhlové napětí v důsledku skutečnosti, že jeho vazby nejsou 109,5 stupňů; torzní napětí by také bylo značné kvůli všem zatměným vazbám. Proto pro snížení torzního namáhání používá cyklohexan trojrozměrnou strukturu známou jako konformace křesla. Nová konformace staví uhlíky pod úhlem 109,5 °. Polovina vodíků je v rovině prstence (rovníková), zatímco druhá polovina je kolmá k rovině (axiální). Tato konformace umožňuje nejstabilnější strukturu cyklohexanu. Existuje další konformace cyklohexanu, známá jako lodní konformace, ale interkonvertuje k mírně stabilnější formaci křesla. Pokud je cyklohexan monosubstituován velkým substituentem, bude pravděpodobně nalezen substituent připojený v rovníkové poloze, protože se jedná o mírně stabilnější konformaci.
Cyklohexan má nejnižší úhel a torzní napětí všechny cykloalkany, v důsledku čehož byl cyklohexan považován za hodnotu 0 v celkovém namáhání kruhu, což je kombinace úhlového a torzního namáhání. Díky tomu je cyklohexan nejstabilnější z cykloalkanů, a proto bude při spalování produkovat nejmenší množství tepla ve srovnání s jinými cykloalkany.
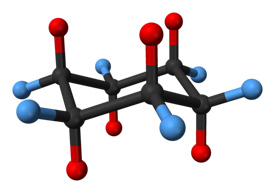
Molekula cyklohexanu v konformaci židle. Atomy vodíku v axiálních polohách jsou zobrazeny červeně, zatímco atomy v rovníkových polohách jsou modře.
Reakce s cyklohexanem
Čistý cyklohexan je sám o sobě poněkud nereaktivní, je nepolární, hydrofobní uhlovodík. Může reagovat s velmi silnými kyselinami, jako je superkyselinový systém HF + SbF5, což způsobí vynucenou protonaci a „praskání uhlovodíků“. Substituované cyklohexany však mohou být reaktivní za různých podmínek, z nichž mnohé jsou důležité pro organickou chemii. Cyklohexan je vysoce hořlavý.
Deriváty cyklohexanu
Specifické uspořádání funkčních skupin v derivátech cyklohexanu a skutečně ve většině molekul cykloalkanu je mimořádně důležité při chemických reakcích, zejména při reakcích zahrnujících nukleofily. Substituenty na kruhu musí být v axiální formaci, aby mohly reagovat s jinými molekulami. Například reakce bromcyklohexanu a běžného nukleofilu, hydroxidového aniontu, by vedla k cyklohexenu.
Tato reakce, běžně známá jako eliminační reakce nebo dehalogenace (konkrétně E2), vyžaduje, aby byl substituent bromu v axiální formaci, oponovat dalšímu axiálnímu atomu H, aby reagoval. Za předpokladu, že bromocyklohexan byl ve vhodné formaci pro reakci, by reakce E2 začala jako taková:
- Vazba elektronového páru mezi C-Br se přesune na Br, vytvoří Br∠a nastaví ji bez cyklohexanu
- Nukleofil (-OH) dává elektronový pár sousednímu axiálnímu H, uvolní H a naváže se na něj, aby vytvořil H2O
- Vazba elektronového páru mezi sousedním axiální H se přesouvá do vazby mezi dvěma CC, což je C = C
Poznámka: Všechny tři kroky probíhají současně, charakteristické pro všechny reakce E2.
Reakce výše bude generovat převážně reakce E2 a ve výsledku bude produktem většinou (~ 70%) cyklohexen. Procento se však mění v závislosti na podmínkách a obecně soutěží dvě různé reakce (E2 a Sn2). Ve výše uvedené reakci by Sn2 reakce místo toho nahradila brom za hydroxylovou (OH-) skupinu, ale opět musí být Br v reakci, aby reagoval. Jakmile je substituce SN2 dokončena, nově substituovaná skupina OH by se rychle (~ 1 milisekundu) vrátila zpět do stabilnější rovníkové polohy. Použití
Komerčně se většina produkovaného cyklohexanu převádí na směs cyklohexanon-cyklohexanol katalyticky oxidace. KA olej se poté používá jako surovina pro kyselinu adipovou a kaprolaktam. Prakticky, pokud je obsah cyklohexanolu v KA oleji vyšší než cyklohexanon, je pravděpodobnější (ekonomický), že se přemění na kyselinu adipovou, a naopak je pravděpodobnější výroba kaprolaktamu. Takový poměr v KA oleji lze regulovat výběrem vhodných oxidačních katalyzátorů. Část cyklohexanu se používá jako organické rozpouštědlo.
Cyklohexan ve výzkumu
Ačkoli je o tomto cyklickém uhlovodíku již mnoho známo, stále se provádí výzkum směsí cyklohexanu a benzenu a cyklohexanu v pevné fázi za účelem stanovení výtěžku vodíku ze směsi při ozáření při 195 ° C.
Historie
Na rozdíl od sloučenin, jako je benzen, cyklohexan nelze snadno získat z přírodních zdrojů, jako je uhlí. Ke konci devatenáctého století museli raní chemičtí vyšetřovatelé záviset na organické syntéze. Zpracování detailů jim trvalo 30 let. V roce 1867 Marcellin Berthelot redukoval benzen s kyselinou jodovodíkovou při zvýšených teplotách. Nesprávně identifikoval reakční produkt jako n-hexan nejen z důvodu vhodné shody v bodu varu (69 ° C), ale také proto, že nevěřil, že benzen je cyklická molekula (jako jeho současník August Kekule), ale spíše nějaká asociace acetylenu. V roce 1870 jeden z jeho skeptiků Adolf von Baeyer zopakoval reakci a vyslovil stejný reakční produkt hexahydrobenzen a v roce 1890 se Vladimír Markovnikov domníval, že je schopen destilovat stejnou sloučeninu z kavkazského ropného oleje a nazvat jeho směs hexanaphtene.
V roce 1894 Baeyer syntetizovaný cyklohexan počínaje Dieckmannovou kondenzací kyseliny pimelové s následnou vícenásobnou redukcí. a ve stejném roce E. Haworth a W.H. Perkin Jr. (1860 – 1929) udělal totéž při Wurtzově reakci 1,6-dibromhexanu. Překvapivě se jejich cyklohexany vařily vyšší o 10 ° C než hexahydrobenzen nebo hexanaphten, ale tuto hádanku vyřešili v roce 1895 Markovnikov, NM Kishner a Nikolay Zelinského, když znovu diagnostikovali hexahydrobenzen a hexanaften jako methylcyklopentan, výsledek neočekávané přesmykové reakce.