ATP-molekyle
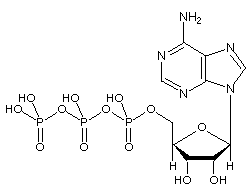
Adenosintrifosfat (ATP) -molekylet er det kendte nukleotid i biokemi som den “molekylære valuta” af intracellulær energioverførsel; ATP er i stand til at lagre og transportere kemisk energi inden i celler. ATP spiller også en vigtig rolle i syntesen af nukleinsyrer.
For 3D-struktur af dette billede ved hjælp af JsmolKlik her
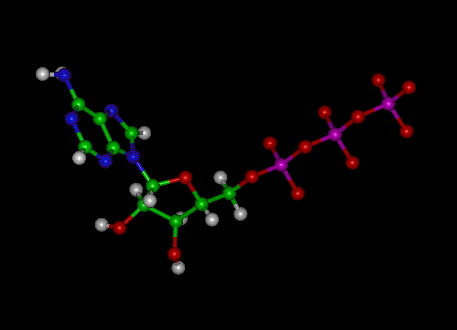
Billede: ATP’s molekylære struktur
Energi frigøres ved hydrolyse af den tredje phosphatgruppe. Efter at denne tredje phosphatgruppe er frigivet, kan det resulterende ADP (adenosindiphosphat) absorbere energi og genvinde gruppen og regenererer således et ATP-molekyle; dette gør det muligt for ATP at lagre energi som et genopladeligt batteri.
Phosphorylpositioner
Phosphorylgrupperne, der starter med den på AMP, betegnes alfa-, beta- og gamma-phosphaterne.
Fysiske og kemiske egenskaber
ATP består af adenosin – sammensat af en adeninring og et ribosesukker – og tre fosfatgrupper (triphosphat). Phosphorylgrupperne, der starter med den gruppe, der er tættest på ribosen, betegnes alfa (α), beta (β) og gamma (γ) phosphater. Derfor er det tæt beslægtet med adeninnukleotidet, en monomer af RNA. ATP er meget opløseligt i vand og er ret stabilt i opløsninger mellem pH 6,8 og 7,4, men hydrolyseres hurtigt ved ekstrem pH. Derfor lagres ATP bedst som et vandfrit salt.
ATP er et ustabilt molekyle i ubufret vand, hvor det hydrolyserer til ADP og fosfat. Dette skyldes, at styrken af bindingerne mellem phosphatgrupperne i ATP er mindre end styrken af hydrogenbindingerne (hydratiseringsbindinger) mellem dets produkter (ADP og phosphat) og vand. Således, hvis ATP og ADP er i kemisk ligevægt i vand, vil næsten alt ATP til sidst blive konverteret til ADP. Et system, der er langt fra ligevægt, indeholder Gibbs fri energi og er i stand til at udføre arbejde. Levende celler opretholder forholdet mellem ATP og ADP ved et punkt på ti størrelsesordener fra ligevægt, med ATP-koncentrationer fem gange højere end koncentrationen af ADP. Denne forskydning fra ligevægt betyder, at hydrolysen af ATP i cellen frigiver en stor mængde fri energi.
To phosphoanhydridbindinger (dem, der forbinder tilstødende phosphater) i et ATP-molekyle er ansvarlige for det høje energiindhold i dette molekyle. I forbindelse med biokemiske reaktioner kaldes disse anhydridbindinger ofte – og undertiden kontroversielt – kaldet højenergibindinger (på trods af at det kræver energi at bryde bindinger). Energi lagret i ATP kan frigives ved hydrolyse af anhydridbindingerne. Den primære fosfatgruppe på ATP-molekylet, der hydrolyseres, når der er behov for energi til at drive anabolske reaktioner, er γ-fosfatgruppen. Placeret længst væk fra ribosesukkeret, har det en højere energi til hydrolyse end enten α- eller β-phosphat. Bindingerne dannet efter hydrolyse – eller phosphorylering af en rest med ATP – har lavere energi end ATP’s phosphoanhydridbindinger. Under enzymkatalyseret hydrolyse af ATP eller phosphorylering med ATP kan den tilgængelige frie energi udnyttes af et levende system til at udføre arbejde.
Ethvert ustabilt system af potentielt reaktive molekyler kan potentielt tjene som en måde at lagre fri energi, hvis cellen holdt deres koncentration langt fra ligevægtspunktet for reaktionen. Men som det er tilfældet med de fleste polymere biomolekyler, er nedbrydningen af RNA, DNA og ATP i enklere monomerer drevet af både overvejelser om energi-frigivelse og entropi-stigning i både standardkoncentrationer og også de koncentrationer, der opstår i cellen.
Standardmængden af energi frigivet fra hydrolyse af ATP kan beregnes ud fra ændringer i energi under ikke-naturlige (standard) betingelser og derefter korrigeres til biologiske koncentrationer. Nettoændringen i varmeenergi (entalpi) ved standardtemperatur og tryk ved nedbrydning af ATP i hydreret ADP og hydreret uorganisk fosfat er -30,5 kJ / mol med en ændring i fri energi på 3,4 kJ / mol. Energien frigivet ved spaltning af enten en fosfat (Pi) eller pyrofosfat (PPi) enhed fra ATP i standardtilstand på 1 M er:
ATP + H
2O → ADP + Pi ΔG ° = −30,5 kJ / mol (−7,3 kcal / mol)
ATP + H
2O → AMP + PPi ΔG ° = −45,6 kJ / mol (−10,9 kcal / mol)
Disse værdier kan være bruges til at beregne ændringen i energi under fysiologiske forhold og det cellulære ATP / ADP-forhold. Imidlertid anvendes en mere repræsentativ værdi (som tager AMP i betragtning) kaldet energiafgiften i stigende grad. Værdierne for Gibbs fri energi til denne reaktion er afhængige af en række faktorer, herunder den samlede ionstyrke og tilstedeværelsen af jordalkalimetalioner, såsom Mg2 +
og Ca2 +
.Under typiske cellulære forhold er ΔG cirka -57 kJ / mol (-14 kcal / mol).
Syntese
ATP kan produceres ved forskellige cellulære processer, typisk i mitokondrier ved oxidativ phosphorylering under den katalytiske indflydelse af ATP-syntase eller i tilfælde af planter i kloroplaster ved fotosyntese.
De vigtigste brændstoffer til ATP-syntese er glucose og fedtsyrer. Oprindeligt nedbrydes glukose i pyruvat i cytosolen. Der genereres to ATP-molekyler for hvert glukosemolekyle. De terminale stadier af ATP-syntese udføres i mitokondrionen og kan generere op til 34 ATP.
ATP i den menneskelige krop
Den samlede mængde ATP i den menneskelige krop er ca. 0,1 mol. Den energi, som en voksen bruger dagligt, kræver hydrolyse af 200 til 300 mol ATP. Dette betyder, at hvert ATP-molekyle skal genbruges 2000 til 3000 gange i løbet af dagen. ATP kan ikke lagres, og dets syntese skal derfor nøje følge dets forbrug.
Andre triphosphater
Levende celler har også andre “højenergi” nukleosidtrifosfater, såsom guanintrifosfat. Mellem dem og ATP kan energi let overføres med reaktioner som dem, der katalyseres af nukleosiddiphosphokinase: Energi frigives, når hydrolyse af phosphat-phosphatbindingerne udføres. Denne energi kan bruges af en række enzymer, motoriske proteiner og transportproteiner til at udføre arbejdet i cellen. Hydrolysen giver også frit uorganisk phosphat og adenosindiphosphat, som kan nedbrydes yderligere til en anden phosphation og adenosinmonophosphat. ATP kan også nedbrydes direkte til adenosinmonophosphat med dannelsen af pyrophosphat. Denne sidste reaktion har fordelen af at være en effektivt irreversibel proces i vandig opløsning.
Reaktion af ADP med GTP
ADP + GTP > ATP + BNP