Fakta om Francium Element
Det kemiske element francium er klassificeret som et alkalimetal. Det blev opdaget i 1939 af Marguerite Perey.

Datazone
| Klassifikation: | Francium er et alkalimetal |
| Farve: | sølvgrå-metallisk (formodes) |
| Atomic vægt: | (223), ingen stabile isotoper |
| Tilstand: | solid |
| Smeltepunkt: | 27 oC, 300 K |
| Kogepunkt: | 677 oC, 950 K |
| Elektroner: | 87 |
| Protoner: | 87 |
| Neutroner i den mest rigelige isotop: | 136 |
| Elektronskaller: | 2, 8,18,32,18,8,1 |
| Elektronkonfiguration: | 7s1 |
| Densitet @ 20oC: | 1.873 g / cm3 |
Vis mere, herunder: Opvarmning, Energi, Oxidation,
Reaktioner, forbindelser, radier, ledningsevne
| Atomvolumen: | 71,07 cm3 / mol |
| Struktur: | menes at være bcc: kropscentreret kubisk |
| Hårdhed: | – |
| Specifik varmekapacitet | – |
| Fusionsvarme | 2 kJ mol-1 |
| Forstøvningsvarme | 73 kJ mol-1 |
| Fordampningsvarme | 64 kJ mol-1 |
| 1. ioniseringsenergi | 384 kJ mol-1 |
| 2. ioniseringsenergi | – |
| 3. ioniseringsenergi | – |
| Elektronaffinitet | – |
| Minimum oxidationsnummer | 0 |
| Min. fælles oxidationsnr. | 0 |
| Maksimalt oxidationsnummer | 1 |
| Maks. almindelig oxidationsnr. | 1 |
| Elektronegativitet (Pauling-skala) | 0,7 |
| Polariserbarhed volumen | 48,7 Å3 |
| Reaktion med luft | – |
| Reaktion med 15 M HNO3 | – |
| Reaktion med 6 M HCI | kraftig, ⇒ H2, FrCl |
| Reaktion med 6 M NaOH | kraftig, ⇒ H2, FrOH |
| Oxid (er) | – |
| Hydrid (er) | – |
| Chlorid (er) | – |
| Atomic radius | – |
| Ionic radius (1+ ion) | 194 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Varmeledningsevne | 3,61 W m-1 K-1 |
| Elektrisk ledningsevne | – |
| Frysepunkt / smeltepunkt: | 27 oC, 300 K |

Denne uranmalmprøve indeholder ca. 100.000 francium-223 atomer (3,3 x 10-20 g). Francium er radioaktivt; mindre end 30 g af det findes på Jorden til enhver tid. Billede ref. (1)
Opdagelse af Francium
Francium blev opdaget af Marguerite Perey i 1939, da hun undersøgte det radioaktive forfald af actinium-227.
Opdagelsen fandt sted på Curie Institute i Paris. Elementet tager sit navn fra det land, hvor det blev opdaget – Frankrig.
Opdagelsen begyndte i 1935, da Perey i en alder af 26 år læste et forskningsoplæg, der hævdede, at amerikanske forskere havde opdaget betapartikler, der udsendes af actinium, som havde en højere mængde energi end normalt.
Perey var nysgerrig efter dette fund, og da hun allerede var ekspert på actiniumrelateret arbejde, besluttede hun at udføre sine egne eksperimenter med actinium. Hun producerede en ultrarent actiniumprøve og studerede dens stråling. Perey opdagede, at ca. 1% af actiniums radioaktivitet var forårsaget af, at det udsendte alfapartikler, ikke beta-partikler.
Perey havde opdaget, at actinium-227 kunne henfalde ved at udsende en heliumkerne (også kaldet en alfapartikel) sin egen kerne. Datterens kerne dannet var et tidligere uopdaget element, som hun valgte at kalde francium for at ære sit hjemland, Frankrig.
227Ac → 223Fr + 4He
Med 87 protoner hørte det nye element til i Gruppe 1 i det periodiske system, der forbinder de andre fem alkalimetaller: lithium, natrium, kalium, rubidium og cæsium.
Opdagelsen af francium afsluttede menneskets opdagelser af naturligt forekommende grundstoffer.
Alle grundstoffer, der er opdaget siden da, er blevet opdaget, når elementet er produceret i laboratoriet.

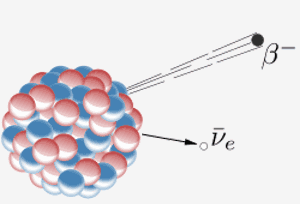
En kerne udsender en beta-partikel ( en elektron) og en antineutrino. Resultatet af dette er, at en neutron i kernen bliver til en proton. Når element 87 i det periodiske system (francium) gør dette, betyder det ekstra proton, at det bliver element 88 (radium).
Udseende og egenskaber
Skadelige virkninger:
Francium er stærkt radioaktivt.
Karakteristika:
Francium er et tungt, ustabilt, radioaktivt metal med en maksimal halveringstid på kun 22 minutter. Det har et lavt smeltepunkt (27 oC, 81 oF), og hvis nok af det kunne akkumuleres, ville det være flydende i et varmt rum.
Francium er det næst sjældneste element i jordskorpen, ved siden af astatine. Mindre end tredive gram francium findes på Jorden på et givet tidspunkt.
Francium er den mindst elektronegative af alle grundstoffer, derfor bør det være det mest kemisk reaktive alkalimetal. Desværre er den ikke tilgængelig i tilstrækkelige mængder til at vise, at den reagerer med vand – den er lavet i små mængder i partikelacceleratorer. I teorien ville dets reaktion med vand være mere voldsom end cæsium og meget mere voldsom end natrium.
Francium er senest blevet undersøgt ved Stony Brook University, New York. Forskere der fangede der op til ti tusind franciumatomer ad gangen ved hjælp af laserstråler i et magnetfelt for at måle deres egenskaber.
Anvendelse af Francium
Kommercielt er der ingen anvendelser af francium på grund af dets sjældenhed og ustabilitet. Det bruges kun til forskningsformål.
Francium Decay
Franciums isotoper med massetal fra 200 til 232, som oftest gennemgår alfa- eller beta-henfald.
Her er blot nogle få eksempler på franciums forfaldsstier:
Francium-223 er elementets længst levede isotop. Det har en halveringstid på 22 minutter. Det kan udsende en alfa-partikel (en heliumkerne) til dannelse af astatin-219 eller en beta-partikel til dannelse af radium-223. (En beta-partikel er en elektron, der udsendes fra en kerne, når en neutron konverterer til en proton.)
Francium-221 har en halveringstid på 5 minutter. Det kan udsende en alfa-partikel for at danne astatin-217 eller en beta-partikel for at blive radium-221.
Francium-216 har en halveringstid på 0,7 mikrosekunder. Det kan udsende en alfa-partikel til dannelse af astatin-212 eller en positron til dannelse af radon-216.
Francium-212 har en halveringstid på 19 minutter. Det kan udsende en alfapartikel til dannelse af astatin-208 eller fange en orbitalelektron til dannelse af radon-212. (2) (Under orbitalelektronfangst fanger kernen en af atommets egne elektroner og udsender en neutrino.)
Overflod og isotoper
Overflod jordskorpe: ~ 0 dele pr. Million , ~ 0 dele pr. Million
Overflod solsystem: ~ 0 dele pr. Milliard efter vægt, ~ 0 dele pr. Billion pr. Mol
Omkostninger, ren: $ pr. 100 g
Omkostninger, bulk: $ pr. 100 g
Kilde: Francium forekommer naturligt som et resultat af alfa-radioaktivt henfald af actinium.
Isotoper: Francium har 33 isotoper, hvis halveringstid kendes med massetallene 200 til 232. Ingen er stabile. 223Fr har den længste halveringstid på 21,8 minutter.

- Foto af Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, udgave 6.
Citer denne side
For online-link skal du kopiere og indsætte et af følgende:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
eller
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
For at citere denne side i et akademisk dokument, brug venligst efter MLA-kompatibel henvisning:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.