Fysisk geologi
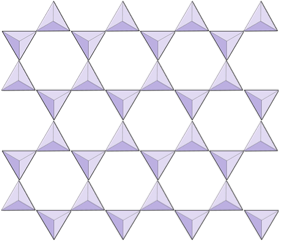
Langt størstedelen af de mineraler, der udgør klipper af jordskorpen, er silikatmineraler. Disse inkluderer mineraler såsom kvarts, feltspat, glimmer, amphibol, pyroxen, olivin og et stort udvalg af lermineraler. Byggestenen til alle disse mineraler er silica tetraeder, en kombination af fire iltatomer og et siliciumatom. Disse er arrangeret således, at planer trukket gennem iltatomerne danner en tetraeder (figur 2.6). Da siliciumionen har en ladning på +4, og hver af de fire iltioner har en ladning på –2, har silica-tetraeder en nettoladning på –4.
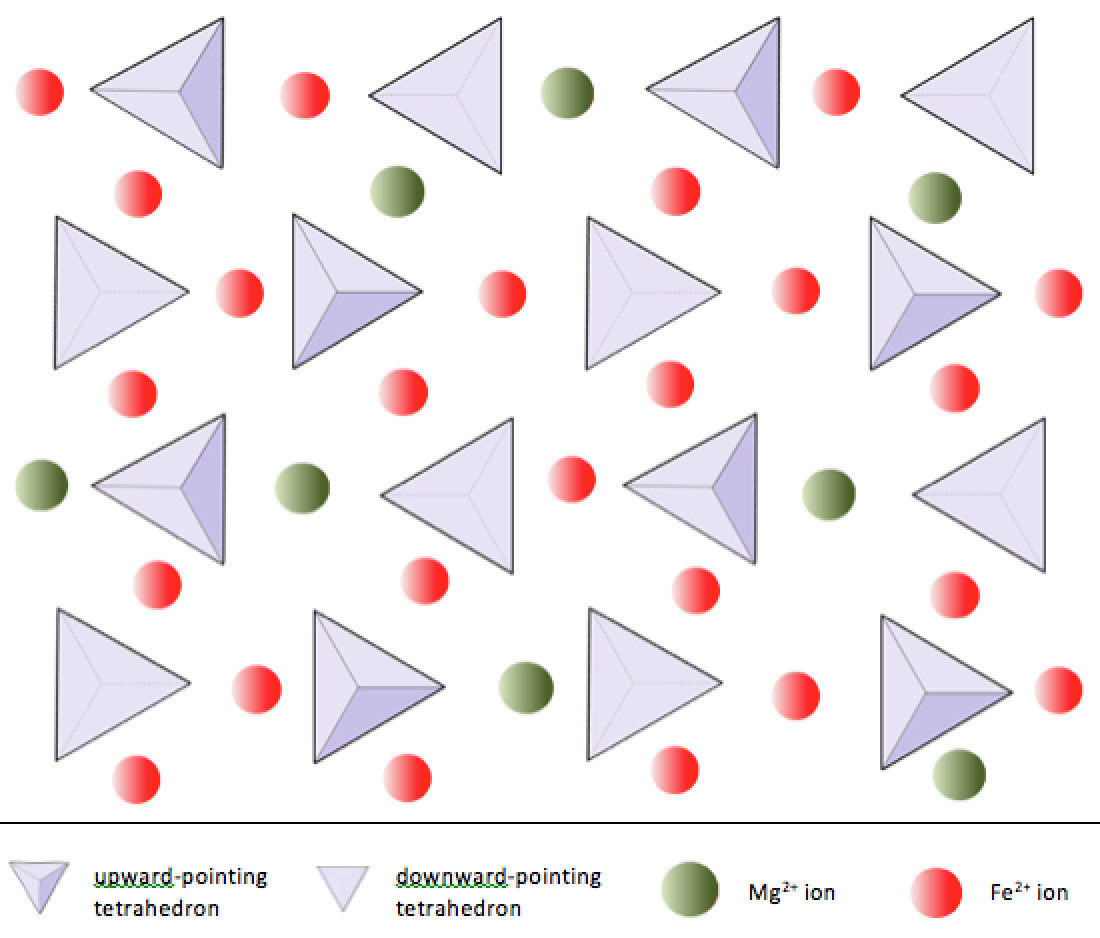
I silikatmineraler er disse tetraeder arrangeret og koblet sammen på en række måder, fra enkelte enheder til komplekse rammer (figur 2.9). Den enkleste silikatstruktur, mineralolivin, består af isolerede tetraeder bundet til jern- og / eller magnesiumioner. I olivin afbalanceres -4-ladningen for hver silicatetraeder med to divalente (dvs. +2) jern- eller magnesiumkationer. Olivin kan være enten Mg2SiO4 eller Fe2SiO4 eller en kombination af de to (Mg, Fe) 2SiO4. De divalente kationer af magnesium og jern er ret tæt i radius (0,73 versus 0,62 ångstrøm). På grund af denne størrelse lighed, og fordi de begge er divalente kationer (begge har en ladning på +2), kan jern og magnesium let erstatte hinanden i olivin og i mange andre mineraler.
| Tetraederkonfiguration | Eksempel på mineraler | |
|---|---|---|
 |
Isoleret (nesosilikater) | Olivin, granat, zirkon, kyanit |
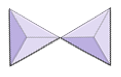 |
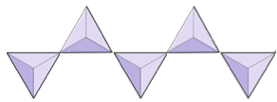
Par (sorosilicater) | Epidote, zoisite |
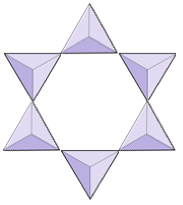 |
Ringe (cyclosilikater) | Tourmaline |
 |
Enkeltkæder (inosilikater) | Pyroxener, wollastonit |
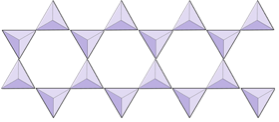 |
Dobbeltkæder (inosilikater) | Amfiboler |
 |
Ark (phyllosilicater) | Micas, lermineraler, serpentin, chlorit |
| 3-dimensionel struktur | Ramme (tektosilikater) | Feltspat, kvarts, zeolit |
Øvelse 2.3 Lav en tetraeder
Skær rundt om formens udvendige (faste linjer og stiplede linjer), og fold derefter langs de faste linjer for at danne en tetraeder.
Hvis du har lim eller tape, skal du fastgøre faner til tetraederne for at holde det sammen. Hvis du ikke har lim eller tape, skal du lave et stykke langs den tynde grå linje og indsætte den spidse flige i spalten.
Hvis du gør dette i et klasseværelse, kan du prøve at slutte din tetraeder med andre i par, ringe, enkelt- og dobbeltkæder, ark og endda tredimensionelle rammer.
I olivin, i modsætning til de fleste andre silicatmineraler, er silica tetrahedra ikke bundet til hver Andet. De er dog bundet til jern og / eller magnesium som vist på figur 2.10.
Som allerede bemærket, +2-ionerne af jern og magnesium er ens i størrelse (dog ikke helt det samme). Dette giver dem mulighed for at erstatte hinanden i nogle silikatmineraler. Faktisk har de almindelige ioner i silikatmineraler en bred vifte af størrelser, som vist i figur 2.11. Alle de viste ioner er kationer bortset fra ilt. Bemærk, at jern kan eksistere som både en +2-ion (hvis den mister to elektroner under ioniseringen) eller en +3-ion (hvis den mister tre). Fe2 + er kendt som jernholdigt jern. Fe3 + er kendt som jern jern. Ioniske radier er kritiske for sammensætningen af silikatmineraler, så vi henviser til dette diagram igen.

Enkeltkædens struktur silikatpyroxen er vist på figur 2.12 og 2.13. I pyroxen er silica tetraeder bundet sammen i en enkelt kæde, hvor en iltion fra hver tetraeder deles med den tilstødende tetraeder, derfor er der færre oxygener i strukturen.Resultatet er, at forholdet mellem ilt og silicium er lavere end i olivin (3: 1 i stedet for 4: 1), og nettoladningen pr. Siliciumatom er mindre (-2 i stedet for -4), da færre kationer er nødvendige for at afbalancere denne afgift. Pyroxensammensætninger er af typen MgSiO3, FeSiO3 og CaSiO3 eller en eller anden kombination af disse. Pyroxen kan også skrives som (Mg, Fe, Ca) SiO3, hvor elementerne i parenteserne kan være til stede i ethvert forhold. Med andre ord har pyroxen en kation for hver silica tetraeder (fx MgSiO3), mens olivin har to (fx Mg2SiO4). Fordi hver siliciumion er +4, og hver oxygenion er –2, giver de tre oxygener (–6) og den ene silicium (+4) en nettoladning på –2 for den enkelte kæde af silica tetraeder. I pyroxen afbalancerer den ene divalente kation (2+) pr. Tetraeder den -2 ladning. I olivin tager det to divalente kationer at afbalancere -4-ladningen af et isoleret tetraeder.
Strukturen af pyroxen er mere “tilladelig” end den for olivin – hvilket betyder, at kationer med et bredere spektrum af ioniske radier kan passe ind i det. Derfor kan pyroxener have jern (radius 0,63 Å) eller magnesium (radius 0,72 Å) eller calcium (radius 1,00 Å) kationer.
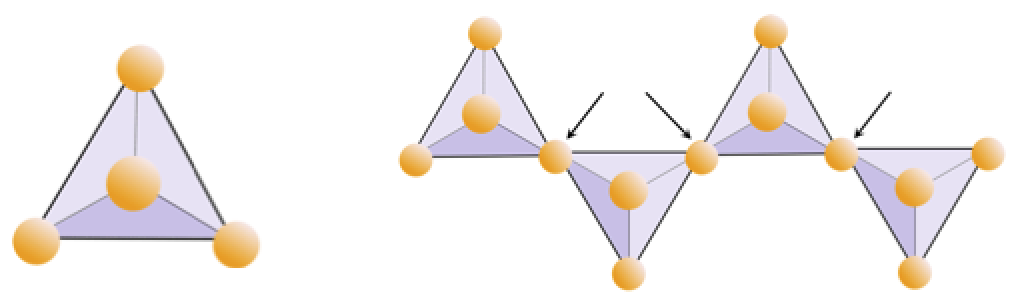
Motion 2.4 Oxygen Deprivation
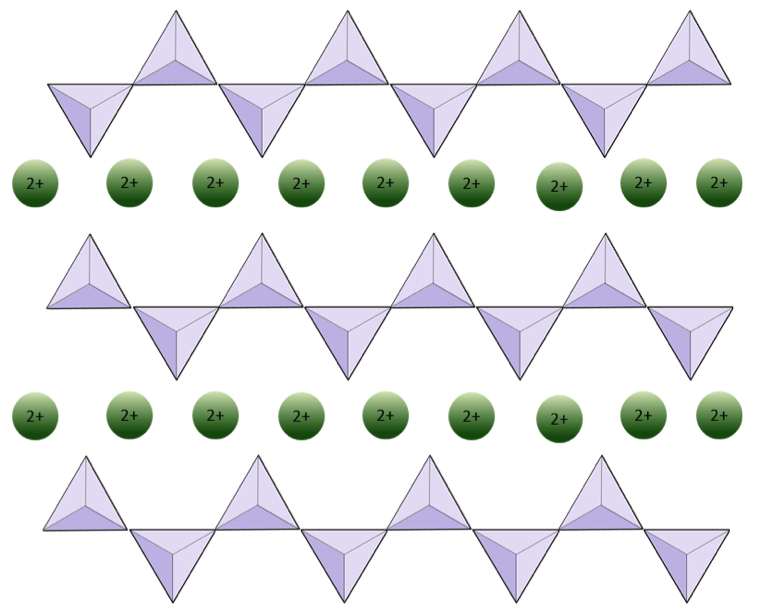
Diagrammet nedenfor repræsenterer en enkelt kæde i et silikatmineral. Tæl antallet af tetraeder mod antallet af iltioner (gule kugler). Hver tetraeder har en siliciumion, så dette skal give forholdet mellem Si og O i enkeltkædede silikater (f.eks. Pyroxen).
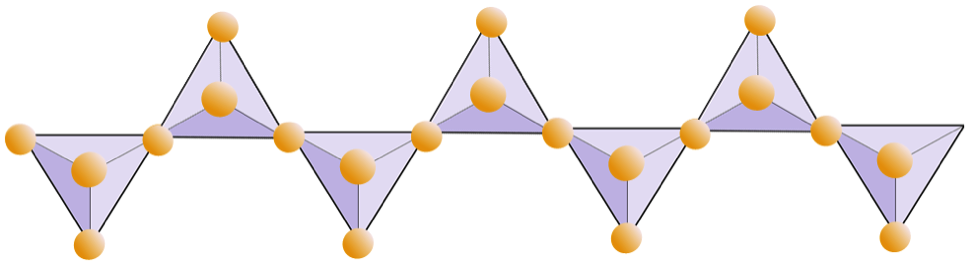
Diagrammet nedenfor repræsenterer en dobbelt kæde i et silikatmineral. Igen tæller antallet af tetraeder mod antallet af iltioner. Dette skal give dig forholdet mellem Si og O i dobbeltkædede silikater (f.eks. Amfibol).
I amfibolstrukturer er silica tetraederne forbundet i en dobbeltkæde, der har et ilt-til-silicium-forhold, der er lavere end pyroxen, og derfor er stadig færre kationer nødvendige for at afbalancere ladningen. Amfibol er endnu mere tilladelig end pyroxen, og dets sammensætninger kan være meget komplekse. Hornblende kan for eksempel omfatte natrium, kalium, calcium, magnesium, jern, aluminium, silicium, ilt, fluor og hydroxylionen (OH–).
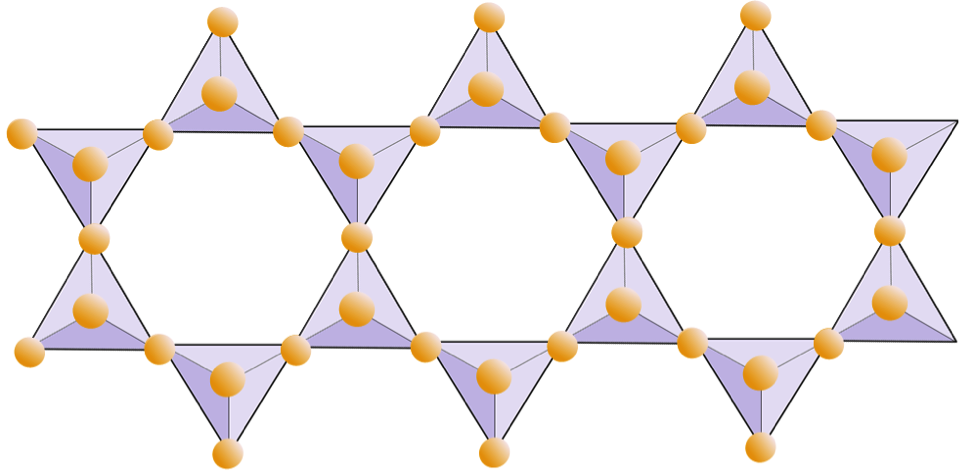
I glimmerstrukturer er silica tetraeder er arrangeret i kontinuerlige ark, hvor hver tetraeder deler tre oxygenanioner med tilstødende tetraeder. Der er endnu mere deling af oxygener mellem tilstødende tetraeder, og derfor er der behov for færre ladningsbalancerende kationer til pladesilikatmineraler. Limningen mellem ark er relativt svag, og dette tegner sig for den veludviklede envejsspaltning (figur 2.14). Biotitglimmer kan have jern og / eller magnesium i sig, og det gør det til et ferromagnesisk silikatmineral (som olivin, pyroxen og amphibol). Chlorit er et andet lignende mineral, der almindeligvis indeholder magnesium. I muskovitglimmer er de eneste kationer til stede aluminium og kalium; derfor er det et ikke-ferromagnesisk silikatmineral.

Bortset fra muskovit, biotit og chlorit er der mange andre arkilicater (eller phyllosilicater), som findes normalt som lerstørrelsesfragmenter (dvs. mindre end 0,004 mm). Disse inkluderer lermineralerne kaolinit, illite og smectite, og selvom de er vanskelige at undersøge på grund af deres meget lille størrelse, er de ekstremt vigtige komponenter i klipper og især jord.
Alt arketsilicat mineraler har også vand i deres struktur.
Silica tetrahedra er bundet i tredimensionelle rammer i både feldspats og kvarts. Disse er ikke-ferromagnesiske mineraler – de indeholder ikke jern eller magnesium.Ud over silica tetraeder inkluderer feldspats kationerne aluminium, kalium, natrium og calcium i forskellige kombinationer. Kvarts indeholder kun silica tetrahedra.
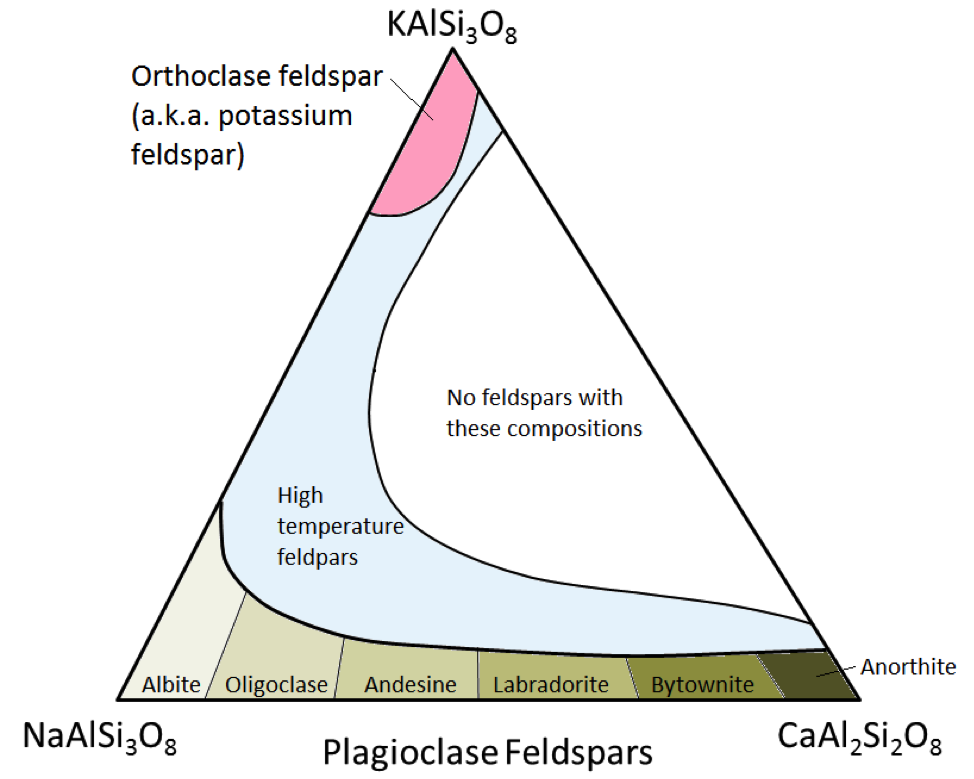
De tre vigtigste feltspatmineraler er kaliumfeltspat (aka K-feldspar eller K-spar) og to typer plagioclase feldspar: albit (kun natrium) og anorthit (kun calcium) . Som det er tilfældet for jern og magnesium i olivin, er der et kontinuerligt udvalg af sammensætninger (serie med faste opløsninger) mellem albit og anorthit i plagioklase. Dette skyldes, at calcium- og natriumionerne er næsten identiske i størrelse (1,00 Å versus 0,99 Å). Alle mellemliggende sammensætninger mellem CaAl2Si3O8 og NaAlSi3O8 kan eksistere (figur 2.15). Dette er lidt overraskende, for selvom de er meget ens i størrelse, har calcium- og natriumioner ikke den samme ladning (Ca2 + versus Na +). Dette problem tages i betragtning ved tilsvarende erstatning af Al3 + for Si4 +. Derfor er albit NaAlSi3O8 (en Al og tre Si), mens anorthit er CaAl2Si2O8 (to Al og to Si), og plagioclase-feltspat med mellemliggende sammensætning har mellemliggende andele af Al og Si. Dette kaldes en “koblet-substitution.”
Den mellemliggende sammensætning plagioclase-feltspat er oligoclase (10% til 30% Ca), andesin (30% til 50% Ca), labradorit (50% til 70 % Ca) og bytownite (70% til 90% Ca). K-feltspat (KAlSi3O8) har en lidt anden struktur end plagioklase på grund af den større størrelse af kaliumionen (1,37 Å) og på grund af denne store størrelse , kalium og natrium erstatter ikke let hinanden undtagen ved høje temperaturer. Disse højtemperaturfeldspar findes sandsynligvis kun i vulkanske klipper, fordi påtrængende vulkanske klipper afkøles langsomt nok til lave temperaturer til, at feldspatene kan ændre sig til et af former med lavere temperatur.
I kvarts (SiO2) er silica tetraederne bundet i en “perfekt” tredimensionel ramme. Hver tetraeder er bundet til fire andre tetraeder (med et ilt delt i hvert hjørne af hver tetraeder), og som et resultat er forholdet mellem silicium og ilt 1: 2. Da den ene siliciumkation har en +4 ladning, og de to iltanioner hver har -2 ladning, er ladningen afbalanceret. Der er ikke behov for aluminium eller nogen af de andre kationer, såsom natrium eller kalium. Hårdheden og manglen på spaltning i kvarts skyldes de stærke kovalente / ioniske bindinger, der er karakteristiske for silica tetraeder.
Øvelse 2.5 Ferromagnesiske silikater?
Silikatmineraler klassificeres som værende enten ferromagnesiske eller ikke-ferromagnesiske, afhængigt af om de har jern (Fe) og / eller magnesium (Mg) i deres formel. Et antal mineraler og deres formler er anført nedenfor. For hver enkelt skal du angive, om det er et ferromagnesisk silikat.
| Mineral | Formel | Ferromagnesisk silikat? |
|---|---|---|
| olivin | (Mg, Fe) 2SiO4 | |
| pyrite | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| pyroxen | MgSiO3 | |
| hæmatit | Fe2O3 | |
| orthoclase | KAlSi3O8 | |
| kvarts | SiO2 |
| Mineral | Formel * | Ferromagnesisk silikat? |
|---|---|---|
| amfibol | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetit | Fe3O4 | |
| biotit | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomit | (Ca, Mg) CO3 | |
| granat | Fe2Al2Si3O12 | |
| serpentine | Mg3Si2O5 (OH) 4 |
* Nogle af formlerne, især de mere komplicerede, er blevet forenklet.
- En angstrøm er den enhed, der almindeligvis bruges til ekspression af atomisk -skala dimensioner. Én angstrøm er 10-10 m eller 0,00000000001 m. Symbolet for en angstrøm er Å. Li