Grænser inden for cellulær- og infektionsmikrobiologi
Introduktion
Staphylococcus aureus er et vigtigt humant patogen isoleret fra hospitaliserede patienter over hele verden, hvilket forårsager både hospitalsinfektioner og samfund erhvervede infektioner ( Lowy, 1998). Dette patogen er det etiologiske middel til flere forskellige systemiske infektioner, der påvirker hud og blødt væv såvel som muskuloskeletale og kredsløbssystemer (Lowy, 1998; Changchien et al., 2016). Det blev rapporteret, at S. aureus kan overleve i humane monocytafledte makrofager (Kubica et al., 2008). Virulensen af S. aureus er tæt forbundet med en række udskilte enzymer og toksiner produceret af bakterierne (Otto, 2014). Hemolysin, leukocidin (Panton – Valentine leukocidin, PVL) og toksisk shock syndrom toksin-1 (TSST-1), der letter for at beskadige den røde blodlegemer, skader fagocytisk funktion af leukocytter og inducerer henholdsvis toksisk shock syndrom, er kritiske for patogene processer af S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube og Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Nylige undersøgelser har vist, at hæmolysin også deltager i dannelsen af S. aureus biofilm (den Reijer et al., 2016). Den stigende forekomst af multilægemodstandsdygtige S. aureus-stammer inden for hospitaler og samfundsmiljøer øger yderligere farerne ved S. aureus og udgør en alvorlig udfordring for klinisk terapi (Voss og Doebbeling, 1995; Evangelista Sde og de Oliveira, 2015).
For nylig er der fundet et antal stammer tilhørende en klasse af S. aureus med en ufuldstændig hæmolytisk fænotype (SIHP) på vores hospital. Hæmolyse forårsaget af disse SIHP-stammer er signifikant forskellig fra den komplette hæmolytiske ring (β-hæmolytisk fænotype) produceret i andre S. aureus-stammer. Imidlertid er disse SIHP-stammer endnu ikke identificeret og karakteriseret omfattende. For at undersøge de mikrobiologiske egenskaber ved disse SIHP-stammer, indsamlede vi 60 SIHP-stammer og studerede dem ved hjælp af flere kriterier, herunder hæmolytisk fænotype, ekspression af hæmolysingenet, lægemiddelresistensfunktioner og virulens. Denne undersøgelse viser, at SIHP’er er methicillinresistente stammer, der stærkt udtrykker β-hæmolysin og har et højt virulenspotentiale.
Materialer og metoder
Bakteriestammer
Sixty SIHP stammer blev isoleret fra patienter indlagt på det andet tilknyttede hospital på Soochow University mellem 2013 og 2015. Der blev taget duplikatprøver fra hver patient til analyse. Disse isolater blev derefter dyrket på Columbia fårblodagarplader (CHROMagar Company, Shanghai, Kina) ved 35 ° C i en atmosfære indeholdende 5% CO2 (volumen / volumen). Stammer identitet som S. aureus blev bekræftet ved anvendelse af Phoenix-100 automatiserede mikrobiologiske system (Becton, Dickinson og Company, USA). Kontrol S. aureus-stammer med komplet hæmolytisk fænotype blev isoleret fra patienter på vores hospital i samme tidsperiode. Her blev S. aureus med den komplette hæmolytiske fænotype kaldet SCHP-stammer. S. aureus ATCC25923 referencestamme (Shanghai Center for Clinical Laboratory, China) har den komplette hæmolytiske fænotype og fungerede også som kontrolstammen. Den medicinske etiske komité for det andet tilknyttede hospital ved Soochow University godkendte denne undersøgelse, og alle isolater blev indsamlet med patientens samtykke i denne undersøgelse.
Sammenlignende analyser af ufuldstændig hæmolytisk fenotype
S. aureus stammer blev dyrket på kommercielle blodagarplader fra forskellige virksomheder (CHROMagar, Autobio Diagnostics Co., Ltd., Kina og BioMérieux, Kina) såvel som selvforberedte fåreblodagarplader under anvendelse af Columbia blodagarpulver (OXIDE, UK). Bakterierne blev dyrket ved 35 ° C i en atmosfære indeholdende 5% CO2 (volumen / volumen) i 24 timer og derefter gennemgået seriel passage. Det hæmolytiske fænomen blev derefter observeret. Klinisk isolerede stammer med komplet hæmolytisk fænotype og ATCC25923-referencestammen blev også observeret som en kontrol til komparative analyser.
Bestemmelse af mRNA-niveauerne af fire hemolysingener af S. aureus ved anvendelse af omvendt transkription realtids kvantitativ PCR (qPCR)
Total RNA-ekstraktion fra SIHP og ATCC25923-referencestammen blev foretaget som tidligere beskrevet (Qin et al., 2014). Oprindeligt blev cellerne lyseret under anvendelse af lysostaphin, lysozym og proteinase K. RNA blev derefter ekstraheret og oprenset ved anvendelse af RNeasy Mini Kit (Qiagen) ifølge producentens anbefalede protokol. RNA-kvalitet og koncentration blev evalueret ved anvendelse af NanoDrop1000. RNA blev derefter omvendt -transskrevet til cDNA ved hjælp af et omvendt transkriptionssæt (Thermo Fisher Scientific Inc., USA) ifølge producentens instruktioner.Kort qPCR blev udført som følger: præ-denaturering ved 94 ° C i 3 minutter, denaturering ved 94 ° C i 30 s, annealing ved 52 ° C i 30 s, forlængelse ved 72 ° C i 40 s, i alt 45 cyklusser . Hver prøve havde tre tekniske og tre biologiske gentagelser. Transkriptionsprofilen for hver af de fire hæmolysingener og 16s rRNA-genet blev bestemt under anvendelse af 2 ΔΔCt-metoden. Transkriptionsniveauet blev bestemt i forhold til ekspressionen af 16s rRNA-genet. Sekvenserne af fire hæmolysingener (hla, hlb, hlgC og hld) blev hentet fra GenBank-databasen. Primer 5.0 software blev brugt til at designe primerne (tabel 1), og disse primere blev syntetiseret af Sangon Biotech Co., Ltd. (Shanghai, Kina).
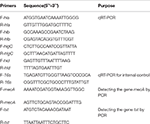
Tabel 1. Primere anvendt i denne undersøgelse.
SPSS 17.0 blev brugt til dataanalyse. Måledata præsenteres som x̄ ± s. T-test for to uafhængige prøver blev anvendt til at sammenligne den relative ekspression af hver af de fire hæmolysingener. Statistisk signifikans blev defineret som p < 0,05.
Påvisning af α-hemolysin (Hla) -ekspression med Western Blot
Koncentrationen af SIHP og referencestammen S. aureus ATCC25923 blev justeret til 5,0 McFarland under anvendelse af en turbiditetsmåler. Totalt protein blev derefter ekstraheret fra hver prøve, justeret til den samme koncentration og gennemgået elektroforese på en SDS-PAGE-gel. Proteinerne blev derefter overført til en nitrocellulosemembran, og membranen blev blokeret med 5% skummetmælk i 1 time. Gedestamylokok α-hæmolysin polyklonale antistoffer (Abcam) blev tilsat i en slutkoncentration på 2 ug / ml. Reaktionsblandingen blev derefter inkuberet ved 4 ° C natten over. Efter vask af membranen blev 1: 1000 fortyndet HRP-mærket kanin-anti-ged-IgG-antistof tilsat og inkuberet ved 37 ° C i 2 timer. Endelig blev kemiluminescerende substrater tilsat til farveudvikling. Ekspressionen af α-hæmolysin blev endelig observeret under billeddanneren.
Antimikrobiel susceptibilitetstest af SIHP
Metoden til fortynding af mikrotitervæske blev anvendt til at udføre screening for antimikrobiel følsomhed. Proceduren blev udført i henhold til den operationelle manual til det automatiserede mikrobiologiske system Phoenix-100. Resultaterne fra denne screening blev fortolket ved hjælp af M100-S24-kriterierne indført af Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Methicillin-resistent S. aureus (MRSA) status blev bestemt ved anvendelse af MIC (minimum hæmmende koncentration) af to antibiotika. For SIHP-stammerne var ≥4 μg / ml MIC for oxallicin, og ≥8 μg / mL var MIC for cefoxitin.
Påvisning af mecA- og tst-gener
Alle 60 SIHP stammer blev testet for lægemiddelresistensgenet mecA og virulensgen tst. Kogende ekstraktion af genomisk DNA blev udført efter cellulær lysis ved anvendelse af lysostaphin. MecA- og tst-generne blev derefter amplificeret fra det genomiske DNA ved anvendelse af DreamGreen Taq-kittet. PCR-betingelser var som følger: præ-denaturering ved 94 ° C i 3 minutter, denaturering ved 94 ° C i 30 s, annealing ved 50 ° C i 30 s, forlængelse ved 72 ° C i 1 min. PCR-produkter blev sekventeret og analyseret af BLAST for at validere for at være de forventede produkter. Sekvenserne af lægemiddelresistensgen mecA og virulensgen tst af S. aureus blev hentet fra GenBank-databasen. Primer 5.0 software blev brugt til at designe primerne (tabel 1), og disse primere blev syntetiseret af Sangon Biotech Co., Ltd. (Shanghai, Kina).
Påvisning af overlevelsen af S. aureus SIHP-stammer i Makrofager
For at sammenligne overlevelsen af S. aureus SIHP-stammer i makrofager med den for tst-negative S. aureus SCHP-stammer blev den humane monocytcellelinie THP-1 opretholdt i RPMI-1640 indeholdende 10% (v / v) FBS ved 37 ° C i en atmosfære indeholdende 5% (volumen / volumen) CO2. Til makrofaginfektion blev THP-1-celler podet med 5 × 105 celler pr. Brønd i vævskulturskåle med 24 brønde og induceret til at differentiere med 10-7 M phorbol 12-myristat 13-acetat (PMA) i 48 timer. Cirka 3 × 108 kolonidannende enheder (CFU) af logaritmisk fase (OD600 0,5-0,6) bakterier blev pelleteret ved centrifugering, vasket to gange med PBS og resuspenderet i 1 ml RPMI-1640. Derefter blev bakterier tilsat til celle-monolaget ved en MOI på 20: 1 og centrifugeret i 5 minutter ved 1000 omdr./min. Inficerede celler blev inkuberet i 20 minutter ved 37 ° C, blev derefter vasket tre gange med forvarmet PBS (pH 7,4) og inkuberet i yderligere 1 time i medium indeholdende 100 μg / ml gentamicin for at dræbe ekstracellulære bakterier. Celler blev vasket og lyseret for at kvantificere den intracellulære bakterie som time zero-prøven (T0). Yderligere celler blev opsamlet efter 12 eller 24 timers inkubation i nærværelse af frisk suppleret vævskulturmedium indeholdende 12 μg / ml gentamicin.Væksten af bakterier i THP-1-celler blev bestemt ved at dividere antallet af intracellulære bakterier ved 12 timer eller 24 timer med antallet på tidspunktet 0 (T12 / T0 eller T24 / T0). Eksperimentet blev gentaget uafhængigt tre gange.
Påvisning af cytokinsekretion af makrofager inficeret af S. aureus SIHP-stammer
Kultursupernatanterne af THP-1-makrofager inficeret i 12 timer af bakterier var indsamlet. Cytokinniveauerne blev målt ved FACSCalibur-flowcytometri (BD) under anvendelse af et CBA Human Thl / Th2 Cytokine Kit II (BD) i henhold til fremstillingsinstruktionerne.
Multilokus-sekvenstypning og -analyse
Resultater
Hæmolytisk fenotype af SIHP-stammer på fåreagarblodplader
Som vist i figur 1A, B blev den komplette hæmolytiske ring (β-hæmolytisk fænotype) observeret i kontrol S aureusstammer efter dyrkning af stammer på blodagarplader i 24 timer. Imidlertid blev forskellige hæmolytiske fænotyper (kaldet ufuldstændig hæmolytisk fænotype her) vist i SIHP-stammer. Desuden kunne den ufuldstændige hæmolytiske fænotype observeres i SIHP-stammer, som voksede i forskellige miljømæssige betingelser inklusive henholdsvis mikroaerofile, aerobe og anaerobe forhold (figur 1C – E). Desuden blev denne ufuldstændige hæmolytiske fænotype efter 10 serielle passager stadig opretholdt (figur 1F).
Relativ mRNA-ekspressionsniveauer af fire hemolysingener
Som vist i figur 2 udviste ekspressionsniveauerne for de fire hemolysingener hla, hlb, hlgC og hld i SCHP-stammer ingen statistisk signifikante forskelle (p > 0,05) sammenlignet med den for kontrolstammer ATCC25923. Imidlertid blev ekspressionsniveauerne af hla, hlgC og hld i SIHP-stammer signifikant undertrykt med henholdsvis 50-, 16,7- og 8,3 gange (p < 0,05) sammenlignet med kontrolstammer ATCC25923 og SCHP-stammer, mens ekspressionen af hlb i SIHP-stammer blev signifikant øget 7,7 gange sammenlignet med kontrollerne (p < 0,05).
Påvisning af α-hemolysin af Western Blot
α-hæmolysinet kodet af gen hla er et poredannende toksin udskilt af S. aureus og dets molekylvægt er 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). Western blot-analyse viste, at ekspressionen af α-hæmolysin i SIHP-stammer var 40 gange lavere end for SCHP- og kontrolstammerne, hvilket er i overensstemmelse med qRT-PCR-dataene (figur 3).

Figur 3. Western blot af a -hemolysin i S. aureus. ATCC29213: kontrol S. aureus med den komplette hæmolytiske fænotype; SCHP: S. aureus med den komplette hæmolytiske fænotype isoleret fra kliniske prøver i samme periode; SIHP: S. aureus med en ufuldstændig hæmolytisk fænotype.
Lægemiddelresistens for SIHP
Testet medikamentfølsomhed ved anvendelse af mikrotiter bouillonfortyndinger viste, at MIC-værdierne for oxacillin og cefoxitin alle var > 2 og > henholdsvis 8 μg / ml i 60 SIHP-pletter . I henhold til CLSI M100-S24-retningslinjerne klassificeres alle 60 SIHP-stammer som MRSA-stammer. PCR påviste også mecA-genet i alle 60 stammer.
Test for tst-genet
tst-genet er en vigtig virulensfaktor i S. aureus. PCR viste, at alle 50 af SIHP-stammerne bar tst-gener.
S. aureus’s overlevelsesevne SIHP-stammer i makrofager er større end den for tst Negative S. aureus
Vi sammenlignede de intracellulære overlevelsesevner for SIHP-stammer og den første SCHP-stamme i makrofager. Ved at tælle antallet af gendannede bakterier fra pladerne fandt vi, at den intracellulære overlevelsesevne for SIHP-stamme var meget højere end den for tst-negativ S. aureus-stamme efter inficerede THP-1 afledte makrofager 12 eller 24 timer (figur 4). Forudgående spekulerede vi i, at SIHP-stammer har en potentiel høj virulens, og det blev foreslået, at SIHP skulle være mere opmærksom på hospitalet.
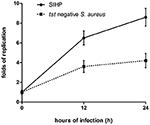
Figur 4. Overlevelse af SIHP-stammer og tst-negativ S. aureus i THP-1-afledte makrofager. Efter at makrofagerne var inficeret med bakterier i 12 og 24 timer, blev makrofagerne lyseret, og de intracellulære overlevende bakterier blev udpladet på LB-agar. Replikationsfoldene af intracellulære overlevende bakterier blev beregnet i henhold til antallet af kolonier på ovenstående LB-agarplade.
Sekretionsforskellene af cytokiner og kemokiner fra makrofager inficeret af S. aureus SIHP-stammer og tst negativ S. aureus
At sammenligne sekretionsforskelle mellem cytokiner og kemokiner i THP-1-afledte makrofager inficeret med SIHP-stamme og tst-negativ S.aureus-stamme, detekterede vi proinflammatoriske cytokiner ved flowcytometri i kultursupernatanten af makrofager inficeret med SIHP-stammer og tst-negativ S. aureus-stamme. Resultaterne viste signifikant højere induktion af IL-2, IL-6 og IL-17A i SIHP-stammer, men ikke af tst-negative S. aureus, hvilket antyder, at SIHP-stammer inducerer cytokin / kemokin-respons i makrofagerne (figur 5). De andre cytokiner IL-4, IL-10, INF-y og TNF udskilt af makrofager var ingen tydelige forskelle mellem SIHP-stammer og tst-negative S. aureus-berørte grupper.
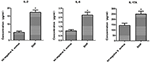
Figur 5. Påvisning af cytokiner og kemokiner udskilt af makrofager inficeret med S. aureus. * P < 0,05.
Multilokus sekvenstypning
Vi bestemte multilocus-genotypen af 60 SIHP-isolater indsamlet fra patienter indlagt på vores hospital mellem 2013 og 2014. Den syv-locus-ordning, der blev anbefalet i S. aureus MLST-databasen, blev anvendt. MLST-analyse viste, at alle SIHP-stammer blev klassificeret i ST5-klon.
Diskussion
Hemolysin er en af de vigtigste virulensfaktorer for S. aureus (Wiseman, 1975). De kombinerede virkninger af hver af de fire slags hæmolysin resulterer i ødelæggelsen af den røde blodlegemer, hvilket fører til dannelsen af den fulde gennemsigtige hæmolytiske ring på blodagarplader. I de senere år blev SIHP fundet i de kliniske prøver fra det andet tilknyttede hospital ved Soochow University. I denne undersøgelse forsøgte vi at identificere disse stammer og undersøge deres egenskaber i mikrobiologi. Oprindeligt brugte vi forskellige kommercielle eller selvforberedte agarplader i fåreblod til at isolere, inkubere og passere stammerne serielt. Vi viste, at der er nogle stammer, der udviser og opretholder en ufuldstændig hæmolytisk fænotype, selv efter langvarig underkultur. Således kan muligheden for, at denne fænotype induceres af ikke-bakterielle faktorer, udelukkes. Vores studier antyder, at SIHP kunne være en delmængde af unikke S. aureus-stammer.
Tidligere undersøgelser antydede, at kaninrøde blodlegemer er meget følsomme over for α-hæmolysin (Hildebrand et al., 1991). Berube et al. rapporterede, at virkningen af α-hæmolysin på lysering af røde blodlegemer er koncentrationsafhængig (Berube og Bubeck Wardenburg, 2013). γ-hæmolysin kan beskadige de røde blodlegemer hos mennesker og dyr (Kaneko og Kamio, 2004). Mens δ-hæmolysin beskadiger røde blodlegemer, kun ved høje koncentrationer, danner det en trans-membranpore, som lyserer cellemembranen (Verdon et al., 2009). I denne undersøgelse viste vi, at ekspressionen af fire hæmolysiner af SIHP-stammer og SCHP-stammer har signifikant forskellige transkriptionsekspressionsprofiler. Ekspressionen af α-, γ-, δ-hæmolysin i SIHP-stammerne, som direkte kunne beskadige de røde celler, er meget lavere end for SCHP-stammerne, mens β-hæmolysin har langt højere ekspressionsniveauer sammenlignet med SCHP-stammerne. Derudover blev proteinekspressionsniveauet for α-hæmolysin yderligere valideret med western blot. Det blev rapporteret, at β-hæmolysin overvejende øger følsomheden af røde blodlegemer over for andre toksiner i stedet for at lysere cellerne direkte, medmindre cellerne dyrkes ved lavere temperaturer (Vandenesch et al., 2012). I denne undersøgelse blev den høje ekspression af β-hæmolysin påvist i SIHP-stammer, men den komplette hæmolytiske ring blev aldrig observeret i SIHP-stammerne, selv når de blev inkuberet ved 4 ° C. Disse resultater antyder, at den observerede ufuldstændige fænotype af SIHP-stammer sandsynligvis er virkningerne af alle fire hæmolysiner, der udtrykkes på en anden måde sammenlignet med SCHP-stammerne. Tidligere undersøgelser har vist, at den kombinerede virkning af selektivt tryk som følge af antibiotika inklusive ciprofloxacin og trimethoprim samt værtsimmunrespons under kronisk patogenese kan føre til den øgede ekspression af α-hæmolysin, hvilket er meget vigtigt for koloniseringen af S aureus i slimhinde især i luftvejsinfektioner (Goerke et al., 2006; Huseby et al., 2010). I denne undersøgelse modtog alle de patienter, der var inficeret med SIHP, langvarig behandling af bredspektrede antibiotika, uanset om dette selektive tryk inducerede overekspression af lægemiddelresistente gener og interfererede med ekspressionen af hæmolysingener forbliver en mulighed, der har behov for yderligere undersøgelse.
For at undersøge de mikrobiologiske egenskaber ved SIHP udførte vi antimikrobiel følsomhedstest og valgte virulensgenet tst, der er forbundet med S. aureus patogenicitet. Vi fandt ud af, at alle 60 SIHP-stammer kunne klassificeres som MRSA-stammer og bar mecA-genet. Resultaterne af antimikrobiel følsomhedstest viste, at selv efter 10 passager af disse 60 SIHP-stammer, har MIC-værdierne for linezolid og teicoplanin af kun tre SIHP-stammer kun ændret sig lidt.Disse ændringer af MIC-værdier påvirkede imidlertid ikke vurderingen af resultaterne af antimikrobiel følsomhed. Virulensgenet tst koder for toksisk shock-syndrom-toksin (TSST-1) (Kreiswirth, 1989). Som et superantigen forbedrer TSST-1 chok- og immunsuppressionsreaktioner induceret af endotoksiner (Kulhankova et al., 2014). PCR-test viste, at alle 60 SIHP-stammer havde tst-genet, hvilket tyder på øget virulens. For nylig viste mange rapporter, at S. aureus kunne overleve i humane monocytafledte makrofager, og disse S. aureus-stammer er mere virulente (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi og Bishayi, 2016). Derfor sammenlignede vi de intracellulære overlevelsesevner for SIHP-stammer og SCHP-stammer, som er den første S. aureus i makrofager, og fandt ud af, at den intracellulære overlevelsesevne for SIHP-stammen var meget højere end den for den tst-negative S. aureus-stamme. Derudover viste patientdataanalyse, at effekten af antiinfektionsbehandling hos de fleste af de patienter, der var inficeret med SIHP-stammer, var værre end for de lignende patienter, der var inficeret med SCHP-stammer (data ikke vist). Vores undersøgelse giver foreløbig eksperimentel dokumentation for spekulationen om, at SIHP-stammer har en potentiel høj virulens.
Under infektionsprocessen med invasiv S. aureus initierer patogenassocierede molekyler det medfødte immunsystem, hvilket fører til aktivering og rekruttering af neutrofiler og makrofager og produktion af proinflammatoriske cytokiner, især TNF-α, IL-1β og IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Det blev rapporteret, at sekretionen af inflammatoriske cytokiner IL-6 steg med stigende koncentrationer af S. aureus (Chen et al., 2016). Derudover er superantigene S. aureus særlig effektive til at stimulere IL-17-produktion (Islander et al., 2010). I denne undersøgelse viste SIHP-stammer signifikant højere induktion af IL-2, IL-6 og IL-17A af makrofager sammenlignet med tst-negative SCHP-stammer, hvilket antyder, at SIHP-stammer kunne inducere mere sekretion af cytokiner mod drabende virkning af makrofager. Derudover viste MLST-analyse, at alle SIHP-stammer blev klassificeret i ST5-klon. Desuden blev disse SIHP-stammer grupperet i spa-typen t2460 (data ikke vist).
SIHP samlet set kan være en ny delmængde af MRSA med potentiel høj virulens, og der bør lægges mere opmærksomhed i kontrol og behandling af disse stammer på hospitaler.
Forfatterens bidrag
Erklæring om interessekonflikt
Forfatterne erklærer, at forskningen blev udført i fravær af nogen kommerciel eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
Anerkendelser
Denne undersøgelse blev støttet af National Natural Science Foundation of China (81572032, 81401636), Natural Science Foundation for Colleges and Universities in Jiangsu Province (16KJB320006) og Science and Technology Program i Suzhou (SYSD2014094, SYS201551, SS201638).
Klinisk og laboratorium Standards Institute (2014). M100-S24 Ydeevnestandarder til test af antimikrobiel følsomhed; Femogtyvende informationssupplement. Wayne, PA: CLSI.
Nandi, A. og Bishayi, B. (2016). Intracellulært overlevede Staphylococcus aureus efter fagocytose er mere virulente til at inducere cytotoksicitet i frisk murin peritoneal makrofager ved anvendelse af TLR-2 som et muligt mål. Mikrob. Patog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef fuldtekst | Google Scholar
Wiseman, G. M. (1975). Hæmolysinerne af Staphylococcus aureus. Bakteriol. Rev. 39, 317-334.
PubMed Abstract | Google Scholar