Grænser inden for fysiologi
Introduktion
Arterielle baroreceptorer fungerer som frontlinjesensorer til at opdage blodtryksændringer i blodstrømmen. Ændringer i blodtryk stimulerer de mekanosensitive nerveender, der er lokaliseret i arterievæggene. Den mekaniske kraft transduceres til elektriske signaler ved nerveterminalerne, hvilket resulterer i trykafhængig handlingspotentiale affyringer i baroreceptorneuroner. Nervesignalerne spredes derefter til det kardiovaskulære kontrolcenter i hjernestammen til barorefleksregulering af blodtrykket (Levy MN, 2007). Derudover har supra-medullære strukturer, herunder midbrain cuneiform nucleus og ventral medial prefrontal cortex, også en hæmmende rolle i baroreflex regulering (Verberne et al., 1997).
Der er to arterielle baroreceptorer, nemlig, aorta baroreceptorer og carotis baroreceptorer, der er placeret i henholdsvis adventitia laget af aortabuen og halspulsårerne. Aortabareceptorerne registrerer blodtryk i aorta. Cellelegemerne (soma) i aorta baroreceptorerne er placeret ved nodose ganglion (NG) (figur 1). Nervesignalerne fra aorta baroreceptor nerve terminaler transmitteres til nodose ganglion gennem en sensorisk nerve ved navn aorta depressor nerve (ADN) (figur 1). Carotisbaroreceptorer registrerer blodtrykket i halspulsåren, som leverer blod til hjernen. Nerveterminalerne i carotisbaroreceptorer er placeret bilateralt ved halspulsårens bifurkationer tæt på den indre halspulsåren. Nervesignalerne fra carotisbaroreceptorerne bevæger sig langs carotid sinus nerves (CSN) til deres soma lokaliseret i petrosal ganglion (PG). Petrosal ganglion stikker ud over jugular foramen (figur 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly and Rigual, 2000; Weijnen et al., 2000) . Fordi aorta-baroreceptorer registrerer blodtryk i aorta, som leverer blod til hele den systemiske cirkulation, forventes disse baroreceptorer at spille en vigtig funktionel rolle i opretholdelsen af det samlede systemiske blodtryk. På den anden side registrerer carotisbaroreceptorer blodtrykket, der leveres til hjernen. Disse baroreceptorer kan være vigtigere for opretholdelsen af et stabilt cerebralt blodtryk og cerebralt blodgennemstrømning.
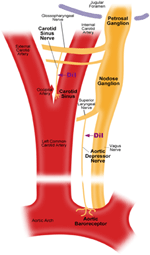
Figur 1. Skematisk diagram over aorta og carotis baroreceptor terminaler og nerver. Diagram, der illustrerer de anatomiske placeringer af aorta og carotis baroreceptorer nerveterminaler, deres nervefibre og somata regioner. Aorta baroreceptor terminaler er placeret i aortabuen. Dens afferente nervefiber er aorta depressor nerve. Somaen er i nodose ganglion (NG). Carotisbaroreceptor er placeret i den indre halspulsårer ved siden af halspulsforgreningen. Dens afferente nerve er carotis sinus nerve. Somaen er placeret i petrosal ganglion (PG).
Der er modstridende rapporter om, hvilke baroreceptorer, aorta baroreceptorer eller halspulsår baroreceptorer, er mere følsomme over for blodtryksændring. Nogle forskere rapporterede, at karotidbaroreceptorerne er mere følsomme over for tryk (Donald og Edis, 1971; Fadel et al., 2003), mens andre mener, at aorta-baroreceptorer er mere følsomme over for tryk (Glick og Covell, 1968; Pickering et al., 2008), og andre har ikke rapporteret om nogen forskel i trykfølsomheden mellem disse to baroreceptorer (Hainswor et al., 1970; James og Daly, 1970). Imidlertid anvendte næsten alle disse tidligere undersøgelser kun baroreflexresponserne (såsom puls og renal sympatisk nerveaktivitet) som slutpunkter for baroreceptorfølsomhedsassay. Der er stadig ingen undersøgelse, der direkte registrerer og sammenligner trykfølsomheden af aorta- og carotisbaroreceptorneuroner i sig selv.
Her har vi brugt en højhastighedstrykklemme til at ændre det hydrostatiske tryk inde i baroreceptorneuroner og målt de tilsvarende elektrofysiologiske reaktioner af disse neuroner ved fastspænding af helcelleplaster. Vi brugte også et uniaxial stretchkammer til at strække baroreceptorneuronerne og målte de tilsvarende ændringer i cytosolisk Ca2 + i disse neuroner. Derudover målte vi til in vivo dyreforsøg de trykinducerede handlingspotentiale affyringer i aorta depressor og carotis sinus nerver, som er sensoriske nerver for henholdsvis aorta og carotis baroreceptorer.
Materialer og metoder
Dyr
Alle dyreforsøg blev udført under myndighed af en licens udstedt af regeringen for Hong Kong SAR og godkendelse fra Animal Experimentation Ethics Committee, det kinesiske universitet i Hong Kong.Sprague-Dawley-hanrotter (S / D) (180-200 g) blev leveret af Laboratory Animal Services Center fra det kinesiske universitet i Hong Kong.
Primær kultur
S / D rotter blev bedøvet med pentobarbitalnatrium (100 mg / kg). Det venstre cervikale område blev eksponeret ved snit i midterlinjen under steriliseret tilstand. Som vist i figur 1 blev aorta depressor nerve eller carotis sinus nerve eksponeret, og 2-3 mm af nerven blev omhyggeligt løsrevet fra omgivende væv ved stump dissektion. Fluorescerende lipofilt sporstof 1,1-dioctadecyl-3,3,3 ‘, 3’-tetramethylindocarbocyanin (DiI) krystaller (Invitrogen) blev påført omkring nerven og dækket med Kwik-Sil (World Precision Instruments, USA). Snittet blev syet bagefter. Rotterne fik lov til at komme sig i 5-7 dage for at tillade DiI-farvestof at diffundere retrograd langs aortadepressornerven eller carotisinusnerven til somataen, der var placeret i henholdsvis nodosganglion eller petrosalganglion.
Nodose eller petrosalganglion neuroner blev isoleret fra DiI-mærkede rotter og skåret i stykker i iskold EBSS. De blev udsat for fordøjelse i 1 time ved 37 ° C med trypsin (1 mg / ml) og collagenase IA (1 mg / ml). Enkeltneuroner blev spredt ved forsigtig triturering med Glass Pasteur-pipette efterfulgt af centrifugering. Neuronerne blev resuspenderet og dyrket i DMEM / F-12 medier suppleret med 5% FBS, 1% antibiotikum-antimykotisk og 7S NGF (100 ng / ml). Cytosine arabinofuranosid (Ara-C; 10 uM) blev inkluderet i dyrkningsmediet for at hæmme væksten af delende celler. Neuroner blev dyrket i mindst 3 dage før eksperimenter. Til optagelse af handlingspotentiale blev neuronerne frisk isoleret og inkuberet i F12 mindst 30 minutter før eksperimenter. Til alle eksperimenter blev cellerne inkuberet på glasplader, der var præcoatet med 0,1 mg / ml poly-L-lysin, bortset fra cellestrækningsforsøg, hvor siliconekamrene blev præcoatet med 2% gelatine.
Patch Clamp
Optagelse af helcellestrømsklemme blev opnået ved hjælp af en EPC7 patch clamp-forstærker (HEKA, Tyskland). Patchpipetter med modstand 3-5 MΩ blev fyldt med pipetteopløsning (i mM): 130 K-gluconat, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 af KOH. Celler blev badet i den kunstige cerebro-spinalvæske (ACSF) (i mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H20, 1,2 KH2PO4, 26 NaHC03, 2,5 CaCl2, 11 glucose, ækvilibreret med carbogen (95% O2 og 5 % CO2). I den aktuelle klemmeoptagelse blev cellerne holdt ved dets hvilende membranpotentiale. Et højhastighedstrykklemmesystem (HSPC-1, ALA Scientific Instruments, USA) blev brugt til at give positivt tryk til cellen gennem mikropipette. Optagelser blev samplet ved 50 kHz og filtreret ved 5 kHz. Data blev analyseret med PulseFit (HEKA). Alle eksperimenter blev udført ved stuetemperatur.
Calcium Imaging
Cytosolisk Ca2 + måling blev udført som beskrevet andetsteds (Wong et al., 2010). Kort fortalt blev celler fyldt med 5 uM Fluo-4 / AM i 40 minutter. Cytosolisk Ca2 + -måling blev udført med HEPES-bufret opløsning (i mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glucose, pH 7,4 ved NaOH. Cytosolisk Ca2 + -ændring som reaktion på uniaxial stretch blev udført med STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Cellerne blev stimuleret med 10, 20 eller 30% af envejsstrækning i 1 sek. Cytosolisk Ca2 + respons blev målt ved stuetemperatur. Fluo-4 fluorescensen blev registreret og analyseret af FV1000 laserscanning konfokalt billeddannelsessystem. Ændring i cytosolisk Ca2 + fluorescensrespons blev udtrykt som et forhold (Fx / F0) af realtidsfluorescens, hvor Fx er fluo-4 / AM-signalet i realtid og F0 er fluo-4 / AM-signalet ved baseline før strækning. / p>
Optagelse af nerveaktivitet
Rotter blev bedøvet med 100 mg / kg pentobarbitalnatrium. Cervikalområdet blev udsat for midterlinie snit. Den højre halspulsårer blev isoleret og kanyleret af et kateter, der var forbundet til tryktransduceren (ML221, ADInstruments, USA) til blodtryksregistrering. Den venstre femorale vene blev kanyleret til phenylephrin og SNP-injektion. Den venstre aorta depressor nerve eller carotis sinus nerve var forbundet til en bipolar sølvelektrode efterfulgt af og en forstærker (Model 1700 Differential AC Amplifier, A-M Systems Inc., USA). Både blodtryk og nerveaktivitet blev kontinuerligt registreret i figur 5.0 (AD-instrumenter). Nerveaktiviteten blev forstærket 10.000 gange og filtreret ved båndpas på 100-5000 Hz. Værdier af gennemsnitligt arterielt tryk, puls og spidsfrekvens som reaktion på phenylephrin blev analyseret ved hjælp af Chart 5.0 software. Ændring i spidsfrekvens (spidsfrekvens efter phenylephrin – spidsfrekvens før phenylephrin) som reaktion på maksimal blodtryksændring (gennemsnitligt arterielt blodtryk efter phenylephrin – gennemsnitligt arterielt blodtryk før phenylephrin) ved phenylephrininjektion blev beregnet (Lau et al., 2016) .
Statistisk analyse
Repræsentative spor blev tegnet som tidsforløbsspor. Data fra alle eksperimenter blev opsummeret i søjlediagram, der blev udtrykt i gennemsnit ± sem af individuelle eksperimenter. Studentens t-test blev brugt til statistisk analyse. Parvis t-test blev brugt, hvor det var relevant.
Resultater
Egenskaber for aortadepressorneuroner og carotisinusneuroner
Dil blev anvendt på enten aorta depressor nerve eller carotis sinus nerve. Derfor omfattede Dil-mærkede neuroner i nodose ganglion baroreceptor neuroner, der innerverede aortabue og kemoreceptor neuroner, der innerverede aortakroppen. På den anden side, Dil-mærkede neuroner i petrosalganglion omfattede baroreceptorneuroner, der innerverer carotisinus og chemoreceptorneuroner, der innerverer carotidlegemet. Vi undersøgte først basale egenskaber af disse Dil-label neuroner. DiI-mærkede neuroner i nodose og petrosal ganglion blev dyrket separat og udsat for en depolariserende elektrisk strøm som vist i figur 2. To typer svar blev registreret, den ene reagerede med et enkelt handlingspotentiale og den anden med kontinuerlige handlingspotentialer efter den depolariserende strøm (figur 2) (Belmonte og Gallego, 1983). Disse neuroner blev efterfølgende udsat for en hydrostatisk trykprotokol for at teste deres følsomhed over for ændringer i hydrostatisk tryk. En positiv hydrostatisk trykrampe blev påført intracellulært gennem en glasmikropipette af højhastighedstrykklemmesystemet (HSPC-1, ALA Scientific Instruments, USA), indtil handlingspotentialer blev fremkaldt. Resultaterne viste, at 45% af aorta-baroreceptorneuroner affyrede kontinuerlige handlingspotentialer som reaktion på den depolariserende elektriske strøm (tabel 1A). Blandt dem reagerede 91% (41% / 45%) også på den hydrostatiske trykændring og viste trykafhængig handlingspotentiale (Tabel 1A). De resterende 55% af aorta-baroreceptorneuroner affyrede kun et enkelt handlingspotentiale som reaktion på den depolariserende strøm (tabel 1A), og blandt dem kunne 40% (22% / 55%) reagere på trykændringen (tabel 1A). For carotisbaroreceptorneuronerne gav 45% af cellerne kontinuerlige handlingspotentialer, når de blev stimuleret af den depolariserende strøm (tabel 1B). Blandt dem var 82% (37% / 45%) også følsomme over for trykændringen (tabel 1B). Derudover kunne 24% (13% / 55%) reagere på trykændringen (tabel 1B) blandt de carotisbaroreceptorneuroner, der kun affyrede et enkelt handlingspotentiale som reaktion på den depolariserende strøm.
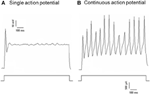
Figur 2. Optagelse af handlingspotentiale fra dyrkede aorta depressor og carotis sinus neuroner. Vist er spor af handlingspotentialer, der blev registreret fra to repræsentative aortadepressorer / carotis sinusneuroner på en depolariserende strøm. (A) En repræsentativ neuron, der kun affyrer et enkelt handlingspotentiale ved den aktuelle stimulering; (B) En repræsentativ neuroner, der kun affyrer kontinuerlige handlingspotentialer ved den aktuelle stimulering. Nederste panel: protokol til nuværende injektion. Skalalinje, vandret, 100 ms, lodret, 10 mV (øvre spor) og 500 pA (nedre spor). n = 27 og n = 38 for henholdsvis aortadepressor og carotis-sinusneuroner.

Tabel 1. Egenskaber for aortadepressor og carotis sinusneuroner.
Uanset om de affyrede et enkelt handlingspotentiale eller kontinuerlige handlingspotentialer, viste sig 63% af Dil-mærkede aorta-baroreceptorneuroner at være følsomme over for trykændringen, mens kun 50% af Dil-mærkede carotisbaroreceptorneuroner var følsomme over for trykændring (tabel 1).
Stretch Sensitivity of Aortic and Carotid Baroreceptor Neurons
Tryktærsklen for handlingspotentialeafladning blev analyseret. Som vist i figur 3 havde aorta-baroreceptorneuroner en lavere tærskel (24 ± 4 mmHg) end carotis-baroreceptorneuroner (39 ± 4 mmHg).

Figur 3. Følsomheder af aorta- og carotisbaroreceptorneuroner over for hydrostatisk tryk. (A, B) Øvre panel, repræsentative tidsforløbsspor, der illustrerer de trykafhængige handlingspotentiale affyringer i aorta (A) og halspuls (B) baroreceptorneuroner. Trykrampen (nederste panel) blev påført indersiden af celler gennem en mikropipette ved anvendelse af et højhastighedstrykklemmesystem (HSPC). Skalalinje vandret, 1 s, lodret, 20 mV og 20 mmHg. (C) Resumé, der viser presstærsklen, der initierer handlingspotentialet affyringer i aorta og carotis baroreceptor neuroner. n = 13 for aorta baroreceptor neuroner og n = 15 for carotis baroreceptor neuroner. *** p < 0,01, af Student’s t-test.
Stretch-induceret Ca2 + respons i Baroreceptor Neuroner
Dyrkede aortadepressor eller carotis sinus neuroner blev udsat for 10, 20 eller 30% af uniaxial stretch ved STREX Cell Stretching System, der forsøger at efterligne blodkarret, der strækker sig under blodtryk. Resultaterne viste, at en uniaxial strækning på 20% inducerede en markant stigning i cytosolisk Ca2 + fluorescens i aorta baroreceptor neuroner, men ikke i carotis baroreceptor neuroner (figur 4A-C). Størrelsen af Ca2 + fluorescens stiger som reaktion på 30% uniaxial stretch var meget højere i aorta baroreceptor neuroner end i carotis baroreceptor neuroner (figur 4A-C).
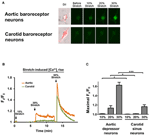
Figur 4. Følsomheder af aortadepressor og carotis sinusneuroner over for enakset strækning. Celler blev fyldt med Ca2 + -følsomt fluorescerende farvestof Fluo-4 / AM. Vist er repræsentative billeder (A) og tidsforløbsspor (B) af relative cytosoliske Ca2 + -stigninger som reaktion på enakset strækning på 10, 20 og 30% af cellelængden i aortadepressor og carotis sinusneuroner. (C) Oversigt over den maksimale cytosoliske Ca2 + stigning som reaktion på forskellig grad af strækning. Ændring i cytosolisk Ca2 + blev udtrykt som Fx / F0, hvor Fx er, at fluo-4 / AM-signal i realtid og F0 er baso-fluo-4 / AM-signalet før strækning. Gennemsnit ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 sammenlignet med den tilsvarende kontrol ved parvis t-test.
Baroreceptor Nerve Activity in vivo
Nerveaktiviteten af de to baroreceptorer blev undersøgt in vivo. Phenylephrin blev injiceret intravenøst. Ændringerne i blodtryk ved anvendelse af phenylephrin er vist i det øvre panel i figur 5A, B. De efterfølgende ændringer i baroreceptor-nerveaktivitet er vist i det nederste panel (figur 5A, B). Den trykinducerede nerveaktivitet var meget højere i aorta depressor nerve end i carotis sinus nerve (figur 5A, B). Ændringen i spidsfrekvens pr. MmHg stigning er opsummeret i figur 5C. Resultatet viste, at aorta-baroreceptorerne er mere følsomme over for hydrostatisk tryk end carotisbaroreceptorerne in vivo.
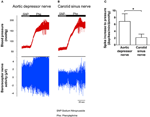
Figur 5. Baroreceptor-nerveaktivitet i rotte in vivo. (A, B) Repræsentative spor, der viser ændringen i aorta depressor nerve (A) og carotis sinus nerve (B) aktivitet ved forhøjet blodtryk. I begge (A, B) var det øvre panel ændringen i blodtryk før og efter Phe-påføring som angivet med de vandrette stænger. Nedre panel var den tilsvarende ændring i nerveaktivitet. (C) Sammenfattende data, der viser ændringen i nerveaktivitet pr. Enhed af blodtryksændring. Gennemsnit ± s.e.m. (n = 8). * p < 0,05 sammenlignet med kontrollen i aorta-baroreceptorer ved parvis t-test.
Ekspression af TRP-kanaler
Flere TRP-kanaler er rapporteret at være mechano-følsomme, herunder TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O “Neil og Heller, 2005; Christensen og Corey, 2007; Pedersen og Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Her undersøgte vi den mulige rolle af disse mekanosensitive TRP-kanaler i forhold til aorta og carotisbaroreceptorsensitivitet. mRNA-ekspressionerne af disse kanaler i nodose og petrosalganglion blev sammenlignet. Det blev fundet, at ekspressionerne af TRPV4 og TRPC6 var højere i nodosganglion sammenlignet med petrosalganglion (figur 6). Det er muligt, at jo højere ekspression af mekanosensitive kanaler i nodose ganglion kan bidrage til den højere følsomhed.
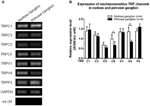
Figur 6. Ekspression af mekanosensitive TRP-kanaler i nodose og petrosal ganglion. (A) Repræsentative gelbilleder, der sammenligner mRNA-ekspressionsniveauet for mekanosensitive TRP-kanaler, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) mellem nodose og petrosalganglionneuroner. Semikvantitativ RT-PCR-analyse blev brugt til at sammenligne mRNA-ekspressionsniveauerne i flere TRP-kanaler i forhold til GAPDH-mRNA-ekspression. Resultaterne af 9 eksperimenter blev opsummeret i (B). Værdier var i gennemsnit ± sem. * p < 0,05, ved parvis t-test.
Diskussion
I denne undersøgelse blev de mekanosensitive egenskaber af aorta og carotisbaroreceptorer sammenlignet. Hele-celle patchklemmeundersøgelser viste, at en højere procentdel af aortadepressorneuroner sammenlignet med carotis-sinusneuroner var strækfølsomme. Endvidere blev det vist sig, at tryktærsklen, der kunne igangsætte handlingspotentielle affyringer, var lavere i aorta-baroreceptorneuroner end i carotis-baroreceptorneuroner. Uniaxial stretch-induceret cytosolisk Ca2 + -stigning blev også sammenlignet mellem aortadepressoren og carotis sinusneuroner.Størrelsen af den cytosoliske Ca2 + -stigning som reaktion på den uniaxiale strækning var meget højere i aorta-baroreceptorneuroner end i carotisbaroreceptorneuroner. Aorta-baroreceptorneuroner udviste også en lavere tærskel for cytosoliske Ca2 + -responser på uniaxial stretch. I en anden serie eksperimenter fandt vi, at trykinduceret stigning i handlingspotentielle affyringer var højere i aorta depressor nerve end i carotis sinus nerve. Samlet set giver vores data stærke beviser for, at aorta-baroreceptorerne er mere følsomme over for blodtryk end carotis-baroreceptorer.
Tidligere er der blevet gjort en stor indsats for at forstå forskellen i følsomhed mellem de to baroreceptorer. Resultaterne er dog kontroversielle. Nogle rapporter konkluderede, at aorta-baroreceptorerne er mere følsomme over for trykændring (Glick og Covell, 1968; Fan et al., 1996; Pickering et al., 2008), mens andre udtalte, at carotis-baroreceptorerne er mere følsomme over for trykændring (Donald og Edis, 1971; Fadel et al., 2003). Imidlertid involverede næsten alle disse tidligere undersøgelser meget komplicerede kirurgiske procedurer og i sidste ende udnyttede baroreflex-responser, såsom hjertefrekvens og renal sympatisk output, som slutpunkter for baroreceptor-følsomhedsassay. Komplicerede kirurgiske procedurer er tilbøjelige til at indføre eksperimentelle fejl, hvilket kan resultere i kontroversielle konklusioner. Desuden er dyreartsafhængig variation i baroreceptorfølsomhed også mulig. Desuden påvirkes baroreflex respons ikke kun af baroreceptor følsomhed, men også af flere andre faktorer, herunder nerveledning, central mediation, blodkar kontraktilitet og hjertefunktion. Derfor er beviser fra tidligere undersøgelser indirekte og næppe ideelle. Indtil i dag mangler der direkte undersøgelser, der sammenligner trykfølsomheden af aorta vs. carotisbaroreceptorneuroner. I denne undersøgelse blev mekanosensitiviteten undersøgt direkte i baroreceptorneuroner. Dataene antyder stærkt, at aorta-baroreceptorerne er mere følsomme over for tryk end carotis-baroreceptorerne. Disse oplysninger kan have vigtig fysiologisk relevans i blodtryksreguleringen.
Det er uklart, hvilke mekanismer der ligger til grund for forskellen i trykfølsomhed mellem aorta og carotis baroreceptorer. Vi sammenlignede ekspressionsniveauet for flere mekanosensitive TRP-kanaler (figur 6) (O “Neil og Heller, 2005; Christensen og Corey, 2007; Pedersen og Nilius, 2007; Patel et al., 2010). Vores resultater viste, at aorta-baroreceptorneuroner har en højere ekspression af flere mekanosensitive TRP-kanaler, herunder TRPV4 og TRPC6. Det er muligt, at højere ekspression af TRPV4 og / eller TRPC6 kan bidrage til den høje trykfølsomhed af aorta-baroreceptorer. Yderligere undersøgelser er nødvendige for at verificere rollen af disse ionkanaler.
Det blev tidligere rapporteret, at nodose ganglion og petrosal ganglion indeholder to forskellige typer neuroner (Belmonte og Gallego, 1983). Den ene giver kontinuerlige handlingspotentialer ved elektrisk stimulering, mens den anden bare giver en enkelt handling potentiale ved stimulering. Forfatterne tildelte førstnævnte som de trykfølsomme neuroner og tildelte sidstnævnte som kemo-følsomme neuroner. Vores resultater indikerer, at det muligvis ikke er appropria te at tildele de trykfølsomme neuroner og trykfølsomme neuroner bare baseret på, om de affyrer et enkelt handlingspotentiale eller kontinuerlige handlingspotentialer som reaktion på den depolariserende strøm. Faktisk er en stor procentdel af celler, der affyrer et enkelt handlingspotentiale som reaktion på elektrisk stimulering, også følsomme over for tryk, og dermed hører de til trykfølende baroreceptorneuroner (figur 2 og tabel 1).
Sammenfattende giver den foreliggende undersøgelse bevis for, at aorta-baroreceptorerne er mere følsomme over for tryk end carotisbaroreceptorerne, og tilføjer ny information til forståelsen af den grundlæggende fysiologi. og XY designe eksperimenterne og udarbejde manuskriptet. EL, CL og YY udfører eksperimenterne. XY, YH, AM og LJ reviderede manuskriptet. Alle forfattere godkendte den endelige version af manuskriptet.
Finansiering
Dette arbejde blev støttet af tilskud fra Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 og RGC-NSFC Joint Grant N_CUHK439 / 13.
Erklæring om interessekonflikt
Forfatterne erklærer, at forskningen blev udført i mangel af nogen kommercielle eller økonomiske forhold, der kunne opfattes som en potentiel interessekonflikt.
James, JEA og Daly, MDB (1970). Sammenligning af refleks vasomotoriske reaktioner på separat og kombineret stimulering af carotis sinus og aortabue-baroreceptorer ved pulserende og ikke-pulserende tryk hos hund. J. Physiol. 209, 257-293. doi: 10.1113 / jphysiol.1970.sp009165
PubMed Abstract | CrossRef fuldtekst | Google Scholar
Levy MN, P. A. (2007). Kardiovaskulær fysiologi. Philadelphia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. og Luciano, D. S. (1998). Human Physiology: the Mechanism of Body Function. Boston, MA: WCB McGraw-Hill.