Grænser inden for immunologi
Introduktion
Præeklampsi er en graviditetsspecifik sygdom, der rammer 3-5% af alle graviditeter (1, 2). Det manifesterer sig med nybegyndt hypertension efter 20 ugers drægtighed og proteinuri. Moderkagen er central i sygdommens patogenese ved at forbinde moderen med fosteret (3). Mødre-føtal grænseflade er den zone, hvor genetisk forskelligt væv af føtal oprindelse mødes med moderens cirkulation, endotel og immunsystem. Ofte kaldet teoriens sygdom, er en almindeligt accepteret indsigt, at præeklampsi påvirker moderens endotel og forårsager forstyrrelser i funktionen af endotel, hvilket fører til hypertension og proteinuri (2). I sin alvorlige form kan præeklampsi føre til fostervæksthæmning, præmaturitet, og for moderen kan det medføre organsvigt i nyrer og lever samt eklampsi. Desuden kan præeklampsi have langsigtede ugunstige kardiovaskulære konsekvenser for moderen og den nyfødte (4). Udviklingen af moderkagen betragtes som utilstrækkelig specifikt i processen med moderens spiralarterietransformation, hvor trophoblastcellerne invaderer modersiden til decidua og omdanner arterierne til ledninger med lav modstand, der også erstatter moderens endotel (5-7). Typisk er denne ombygning af livmoderarterierne fraværende eller ufuldstændig, især i svær form for præeklampsi. Høj modstand i de trange uterine arterier forårsager turbulent blodgennemstrømning til placentas mellemrum, hvilket forårsager oxidativ stress og mekanisk skade på placenta villøse træer. Resulterende skade øger placentaudskillelsen af mikropartikler og inflammatoriske mediatorer, hvilket resulterer i generaliseret endotelaktivering og dysfunktion (8, 9). Disse sekventielle hændelser i maternel-føtal grænseflade fører til maternel hypertension og andre symptomer som beskrevet ovenfor.
HELLP syndrom blev først karakteriseret i 1982 af Weinstein som et separat syndrom, der ofte repræsenterer sammen med præeklampsi, men ses også alene (10, 11). HELLP syndrom er karakteriseret ved hæmolyse, forhøjede leverenzymer og lave blodplader. Det kræver ofte intensivobservation og symptomatisk behandling. Syndromets patogenese er stadig i skyggen. HELLP syndrom deler fælles træk med trombotiske mikroangiopatier (TMA’er) såsom trombotisk trombocytopenisk purpura (TTP) og hæmolytisk uræmisk syndrom (HUS). TMA’er til stede i forskellige grupper af sygdomme med fælles træk ved mikroangiopatisk hæmolyse, trombocytopeni og organskader som følge af mikrotrombi. I TTP er en genetisk defekt i, eller som i langt de fleste tilfælde, erhvervede autoantistoffer mod et desintegrin og metalloproteinase med thrombospondin type 1-motiv 13 (ADAMTS13), enzymet, der spalter aktiveret von Willebrand-faktor (vWF), forårsager dannelse af usædvanligt stort aktiverede vWF-multimerer på endotelceller, der fører til blodpladetromber i små kar og hæmolyse. Typisk HUS er forårsaget af Shiga-toksin-producerende bakteriel infektion (især Escherichia coli), hvorimod atypisk HUS (aHUS) henviser til typen af TMA, hvor genetiske mangler i regulatorerne af den alternative vej til komplement-systemet ligger til grund, som i nærvær af en trigger kan forårsage den kliniske sygdom (12, 13). Den FDA-godkendte behandling af aHUS er infusionen af komplement C5-antagonist eculizumab, som forhindrer dannelsen af membranangrebskomplekset (MAC) (figur 1). Klinisk deler HELLP de samme symptomer som klassiske TMA’er: hæmolyse, trombocytopeni og organsygdomme set i leveren. Afhængig af den anvendte TMA-klassifikation kategoriseres HELLP-syndrom normalt som en del af sekundære eller erhvervede TMA’er (tabel 1).
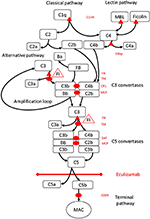
Figur 1. Eculizumab hæmmer terminalvej for komplementaktivering. Komplementaktivering kan initieres via tre aktiveringsveje, der alle fører til dannelse af C5-konvertaser, der har kapacitet til at aktivere terminalvejen, der fører til dannelse af MAC på måloverfladen. Denne skematiske illustration af komplementsystemet viser dets mest relevante aktivatorer (i sort skrifttype) og inhibitorer (i rødt). Aktivatorerne kan være membranbundne (ovale) eller opløselige (trekant). Den alternative vej aktiveres spontant på alle overflader, der ikke tillader inhibering af den opløselige regulatorfaktor H (FH). FH fungerer som kofaktor til inaktivering af C3b til iC3b af faktor I (FI). Trombomodulin (TM) forbedrer FH-cofaktoraktivitet. Spaltet faktor B (FB) danner sammen med aktivatoren C3b den alternative vejkonverterase, som har kapacitet til at spalte C3 i C3b, hvilket skaber en amplifikationssløjfe med alternativ vejaktivering.Klassisk bane for komplementaktivering kan initieres ved for eksempel binding af immunkomplekser til C1q, mens lektinvejen aktiveres ved mannose-bindende lektin (MBL) eller ficoliner, der binder til fx mønstre af kulhydrater på mikrober. Aktivering af lektinvej resulterer i mannose-associeret serinproteaser 1 og 2 (MASP-1 og MASP-2, ikke afbildet), der spalter komplementkomponenter C4 og C2 til dannelse af den klassiske pathway-konvertase C4bC2b. C1-inhibitor (C1inh) og C4bp er de opløselige regulatorer af den klassiske vej, mens membrankofaktorprotein (MCP) og komplementreceptor 1 (CR1) er membranbundne regulatorer af tidlige komplementveje. Dannelsen af C5-konvertaser initierer den terminale vej for komplementaktivering og spaltning af C5 i fravær af overfladebundne regulatorer henfaldsaccelererende faktor (DAF) og MCP. Montering af MAC reguleres af den overfladebundne regulator CD59 (protectin). Spaltning af C3 i de tidlige veje og C5 i terminalvejen frigiver anaphylatoxiner C3a og C5a og resulterer i betændelse. Eculizumab er et humaniseret rekombinant antistof mod komplementproteinet C5, som inhiberer spaltning af C5 af C5-konvertaserne og derved regulerer de protrombotiske og proinflammatoriske virkninger af komplementaktivering. Patienten beskrevet i denne sagsrapport blev testet for genetiske mutationer i gener, der koder for faktor H (CFH), FHR5 og MCP, CFI, CFB, THBD og ADAMTS13 (ADAMTS13), en regulator af vWF-banen for koagulationskaskade (ikke vist). Resultaterne af den genetiske testning var negative.

Tabel 1. HELLP og aHUS diagnostiske kriterier.
I denne casestudie rapporterer vi en patient med en kompliceret graviditetsinduceret TMA og det vellykkede behandlingsforløb.
Præsentation af sagen
Negenogtyve år gammel primigravida blev henvist i svangerskabsalderen 34 + 2 til Helsinki Universitetshospital poliklinik med øvre mavesmerter. Oprindeligt var hendes blodtryk beskedent forhøjet (133/91 mmHg) og urinestik positiv for protein. De oprindeligt rapporterede smerter i øvre mave blev gradvist bedre. I ultralydsscanningen havde fosteret normal biofysisk profil (BPP), vægtestimatet var ved -2 SD vækstkurve. Kardiotokografi (CTG) var normal. Blodhæmoglobin (Hb) var 115 g / L, blodplader 158 E9 / L (normalt interval 150-360 E9 / L), alaninaminotransferase (ALT) var normalt (23 U / L). Urinpinden var positiv for protein (+2) og beregnet proteinuria var 1,6 g / 24 timer. En beslutning blev taget om at indlede kortisonbehandling for at lette lungemodning af barnet. Patienten blev udskrevet med en plan om at vende tilbage den næste dag for kontrolkontrol og anden dosis kortison. Som planlagt kom hun til kontrol i svangerskabsuge 34 + 4. Blodtrykket var 147/87 mmHg, ALT 23, blodplader 177, CTG og fostrets BPP i ultralydsscanningen var normal. Hun blev udskrevet, og en anden kontrol var planlagt. Om eftermiddagen samme dag vendte den øvre mavesmerter tilbage og forværredes støt mod aftenen. Hun vendte tilbage til hospitalet klokken 2.20. Hun oplevede stramme smerter i øvre del af maven, rastløshed, og hun havde kastet op to gange og følte rysten. Blodtrykket blev tydeligt forhøjet ved 170/94 mmHg, urinproteinmålepinden var stærkt positivt, ALT blev forhøjet ved 159, Hb 122 og blodplader 172. Hun blev indlagt på prænatalafdelingen. Klokken 4 oplever hun hovedpine. Antihypertensiv medicin blev startet (Labetalol 100 mg tre gange). Urinproteinudskillelsen toppede om natten 13 g / 24 timer. Derefter begyndte hun opkastning, havde smerter i øvre del af maven, hovedpine, og CTG-overvågningen viste decelerationer. Patienten blev overført klokken 7.11 til fødeafdelingen, og da livmoderhalsen var udvidet med tre centimeter, blev fostermembranerne kunstigt brudt til induktion af fødsel. På samme tid blev laboratorietestene afsluttet med Hb 122, blodplader 172. Lactatdehydrogenase (LD) var imidlertid klart forhøjet ved 1231 U / L på dette tidspunkt. I CTG fortsatte decelerationerne, og da bradykardi fortsatte, blev der udført et akut kejsersnit. Mandlige spædbørn (1960 g, -2 SD) blev født kl. 7,25 med en navlestrengsarterie pH-værdi på 7,05, BE -6,80, Apgar 1/6/8. Blodtab ved operationen var 400 ml.
Kl. 9 efter kejsersnittet var moderens blodplader lave ved 49 med Hb på 102. Om eftermiddagen var ALT steget til 1800, LD 3570 , var serumkreatininniveauet 153 (μmol / L), mens blodplader faldt til 33. Der var forstyrrelse i koagulationen indikeret ved lavt niveau af fibrinogen (1,1 g / L, referenceværdier 2–4 g / L) og højt niveau af D -dimer af fibrin (30,2 mg / L, < 0,5 mg / L). Der var noget blødning fra såret med kejsersnit, hvor yderligere suturer blev placeret.På dette tidspunkt blev der administreret otte enheder blodplader. Kaliumniveauet steg fra 4,7 til 5,6 (mmol / L). Hæmolyse blev tydeligt observeret. Coombs-testen var negativ. Urinudskillelse var kun 10 ml / h. Laboratorietesten viste tydeligt en alvorlig sygdom med tegn på skade på både nyrerne og leveren. Derudover var der forstyrrelser i koagulationssystemet, der præsenterede signifikant koagulation og markeret fibrinolyse samtidigt. Magnesiumsulfatinfusion blev startet på grund af hyperrefleksi, som betragtes som et forudsigeligt tegn på kramper, en alvorlig komplikation af præeklampsi. Intravenøs dexamethason 10 mg blev startet, og patienten blev overført til intensivafdeling (ICU).
Yderligere blev laboratorieundersøgelser udstedt til forskellige diagnostiske formål med andre medicinske nødsituationer (tabel 2). Aktiviteten af ADAMTS13 var normal 62% (40-130%), hvilket ekskluderer TTP. Serumkomplement C3 (0,52 g / L, 0,71-1,41 g / L) og C4 (0,07 g / L, 0,12-0,34 g / L) var lave. Niveauet af det opløselige terminale kompleks af komplementet (C5b-9, 971 ng / ml, < 366 ng / ml) blev forhøjet den første dag efter fødslen. Antiphospholipid-antistoffer blev ikke påvist, infektionsserologien vedrørende hepatitis B og C og HIV var negativ. Fra afføringsprøven testede patogenerne, der forårsagede typisk HUS, negative.

Tabel 2. Tidslinje for sygdomsdiagnostik og -behandling.
Patienten blev behandlet med plasmaudvekslingsbehandling første og anden dag efter fødslen og blev hæmodialyseret tre gange i løbet af hendes behandling (dag 2, 4 og 6 postpartum).
På den tredje postpartumdag var patienten stabil og overført tilbage til kvindes hospitalets genopretningsrum blev observeret og symptomatisk behandling blev fortsat. Hypertension blev behandlet med Amlodipin 10 mg to gange dagligt og Labetalol 200 mg tre gange dagligt. På den fjerde dag efter fødslen faldt blodpladerne fortsat, og patienten blev diagnosticeret med aHUS. Ofte var den differentielle diagnose med HELLP-syndrom og aHUS ligger i spontan helbredelse af HELLP-patienter normalt på den tredje postpartum-dag. Behandling med eculizumab blev startet (900 mg IV). ent modtog en pneumokokvaccination, og profylaktisk antibiotikum (penicillin) blev startet. Patienten fik alt sammen fire ugentlige doser eculizumab (900 mg), og hun begyndte at komme sig hurtigt. Hun krævede ikke yderligere hæmodialyse efter sin tredje hæmodialyse den sjette dag efter fødslen (figur 2). Nyrefunktionen blev gradvist korrigeret, antallet af blodplader forhøjet og hæmolysen løst. Fire uger efter fødslen blev plasmaniveauerne af C3 og C4 normaliseret.
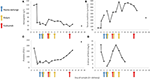
Figur 2. Udvalgte laboratorieværdier observeret i de tidlige stadier af sygdommen og tidspunktet for plasmaudveksling, hæmodialyse og administration af eculizumab. I panel (A) er repræsenteret udviklingen af blodhæmoglobinmålinger, i panel (B) serumkreatininniveauet, i panel (C) antallet af blodplader og i panel (D) D-dimer af fibrinværdier i løbet af de 17 dage opfølgningsperiode.
I genetisk testning blev der ikke identificeret nogen kendte genpolymorfier. Hun blev testet for mutationer i komplementregulatorer faktor H (CFH), faktor H-relateret protein 5 (FHR5) og membran co-faktor protein (MCP), komplement alternativ pathway inaktivator faktor I (CFI), alternativ pathway aktivator faktor B (CFB ), og følgende komponenter i koagulationskaskaden: ADAMTS13, thrombomodulin (THBD) og et intracellulært enzym, diacylglycerolkinase E (DGKE), hvis mutationer er en kendt årsag til aHUS (14). Desuden blev antistoffer mod faktor H heller ikke påvist. Ingen C4-mangel blev påvist.
Som en sammenfatning havde vores patient svær præeklampsi og opfyldte diagnostiske kriterier for HELLP-syndrom. Selvom genetisk testning for aHUS forblev negativ, antydede sygdommens kliniske forløb (især alvorlig akut nyreskade) og respons på behandling (især eculizumab), at vores patient havde graviditetsinduceret aHUS.
Diskussion
Den ovenfor beskrevne primigravida blev diagnosticeret med svær præeklampsi, HELLP-syndrom og graviditetsinduceret aHUS. Ingen kendte genmutationer, der kunne prædisponere for aHUS, blev opdaget. Differentiel diagnose mellem typer TMA, TTP, HUS / aHUS og sekundære TMA’er som HELLP syndrom er vigtig. Især TTP skal identificeres tidligt, da sygdommen behandles med hurtig daglig plasmaudveksling indtil remission (15).
På nuværende tidspunkt er laboratorieanalysemetoder til test af genetiske mutationer, der potentielt forårsager aHUS, i stand til at vise mutationer i kun op til 40-60% af aHUS-tilfælde, hvilket giver mulighed for falske negative tilfælde. Derfor udelukker et negativt testresultat for mutationer ikke en sand aHUS (16).Sjældent er aHUS blevet induceret efter graviditet og fødsel. I disse tilfælde udviklede ~ 50% i de følgende tre år kronisk nyresygdom (CKD), nogle endda end-stage nyresygdomme (ESKD). Når genetiske mutationer blev observeret, kan op til 85% udvikle CKD eller ESKD (17).
Det er almindeligt accepteret, at placentainflammation resulterer i endotel dysfunktion ved graviditet med hypertensive lidelser. Hvis endotelets integritet forstyrres resulterer dette i aktivering af komplement og koagulation (18). Forstyrret maternelt endotel er også blevet antaget at bidrage til den senere livs modersygdom forbundet med svær præeklampsi og andre hypertensive graviditetsforstyrrelser (2, 19). Beskadiget endotel har vist sig at fungere unormalt selv år efter, at de indledende diagnostiske symptomer aftager (20-23).
Hos op til 46% af HELLP-patienter er der beskrevet genmutationer i regulatorerne for den alternative vej. af komplementsystemet (24, 25). I de tidlige stadier af graviditeten, når moderkagen udvikler sig, ses aktivering af komplementsystem i forhøjede niveauer af Bb i serum hos patienter, som senere udviklede præeklampsi (26). Aktivering af komplementsystemet er observeret i svær præeklampsi og HELLP-syndrom, og forhøjede niveauer af terminal kompleks (C5b-9) er blevet påvist i urinen hos patienter med svær præeklampsi. Hos patienter med HELLP-syndrom blev øget aktivering af komplementsystem vist ved funktionel test og endvidere ved mangel på ekspression i CD55 og CD59, hvilket førte til nedsat regulering og forværret aktivering af komplementsystemet (27-29).
Der er mange ligheder, der deles mellem HELLP syndrom og aHUS. Under begge forhold er endotelforstyrrelser tydeligt involveret efterfulgt af komplement- og koagulationsaktivering. Ved svær præeklampsi og HELLP-syndrom ville eculizumab givet ved de tidlige tegn på svær sygdom og TMA være gavnligt for beskyttelsen af nyrerne og moderens endotel (30). Bevaring af endotelintegritet kan potentielt beskytte patienten mod langsigtede sundhedsrisici såsom hjerte-kar-sygdomme. I graviditetsrelaterede TMA’er forsvinder typisk kliniske fund af hæmolyse og trombocytopeni på ~ 3 dage. Hvis sygdomsaktivitet varer længere, skal differentieret diagnostik fortsættes, og først derefter overvejes alternativ behandling (fx eculizumab). Introduktion af eculizumab-behandling tidligere ville være til gavn for kvinder ved at forhindre nyreskader og minimere turbulensen i endotel og systemisk inflammation. Eculizumab, givet tidligt nok og så få som en eller to doser, kunne muligvis være tilstrækkelig til at stoppe turbulensen og være nok til at stoppe kaskaden af begivenheder (31). På den ene side er eculizumab en meget dyr medicin, men på den anden side er omkostningerne ved intensivbehandling, plasmaudveksling, hæmodialyse, mulig nyretransplantation, for ikke at nævne de følelsesmæssige konsekvenser for mødrene og familierne uvurderlige.
Som konklusion var vores patient alvorligt syg og oplevede hæmolyse, forstyrrelse i koagulationen, leverskader og nyresvigt, der havde behov for adgang til ICU og hæmodialyse. Det er muligt, at eculizumab, hvis det blev initieret tidligere, ved de første tegn på HELLP-syndrom, kunne have været gavnligt i løbet af det senere forløb af sygdommen og potentielt mildnet nyreskade og dermed forhindret behov for hæmodialyse og senere CKD. I denne tid med moderne immunologisk medicin kunne vi derfor gøre mere for mødrene og familierne end bare vente og håbe på det bedste?
Etisk erklæring
Etisk gennemgang og godkendelse var ikke krævet til undersøgelsen af menneskelige deltagere i overensstemmelse med den lokale lovgivning og institutionelle krav. Patienterne / deltagerne gav deres skriftlige informerede samtykke til at deltage i denne undersøgelse.
Forfatterbidrag
AL og JH-E udviklede ideen til manuskriptet og skrev manuskriptet. JH-E og MH var involveret i diagnostisk og terapeutisk behandling af patienten. Alle forfattere gennemgik og redigerede manuskriptet og godkendte den endelige version til offentliggørelse.
Interessekonflikt
Forfatterne erklærer, at forskningen blev udført i mangel af nogen kommercielle eller økonomiske forhold, som kunne fortolkes som en potentiel interessekonflikt.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Uønskede graviditetsresultater og fremtidig kardiovaskulær sygdom hos mødre. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed Abstract | CrossRef fuldtekst | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The ” store obstetriske syndromer “er forbundet med lidelser i dyb placentation. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed-abstrakt | CrossRef fuldtekst | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systemisk inflammatorisk priming ved normal graviditet og præeklampsi: rollen som cirkulerende syncytiotrophoblast mikropartikler. J Immunol. (2007) 178: 5949-56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | CrossRef fuldtekst | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Opdatering af syncytiotrophoblast afledte ekstracellulære vesikler i normal graviditet og præeklampsi. J Reprod Immunol. (2017) 119: 98-106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | CrossRef fuldtekst | Google Scholar
10. Weinstein L. Hæmolysesyndrom, forhøjede leverenzymer og lave blodplader tæller: en alvorlig konsekvens af hypertension under graviditet. Am J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | CrossRef fuldtekst | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Differentiering mellem svær HELLP syndrom og trombotisk mikroangiopati, trombotisk trombocytopen purpura og andre efterlignere. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | CrossRef fuldtekst | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Forringelse af endotelfunktion hos kvinder med præeklampsi i anamnesen: en indikator for kardiovaskulær risiko. Am J Physiol Hør Circ Physiol. (2004) 286: 1-3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | CrossRef fuldtekst | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Personale AC. Endotelfunktion og cirkulerende biomarkører forstyrres hos kvinder og børn efter præeklampsi. Forhøjet blodtryk. (2011) 58: 63-9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | CrossRef fuldtekst | Google Scholar
23. Stanhewicz AE. Rest vaskulær dysfunktion hos kvinder med præeklampsi i anamnesen. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | CrossRef fuldtekst | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. Kimlinjemutationer i den alternative vej for komplement disponerer for HELLP syndrom. JCI indsigt. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | CrossRef fuldtekst | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, en ny potentiel behandling for akut nyreskade associeret med præeklampsi / HELLP syndrom. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | CrossRef fuldtekst | Google Scholar