Løsninger
ColligativeProperties
Damptryksdepression
Fysiske egenskaber kan opdeles i to kategorier. Ekstensive egenskaber (såsom masse og volumen) afhænger af prøvenes størrelse. Intensive egenskaber (såsom densitet og koncentration) er stoffets karakteristiske egenskaber; de afhænger ikke af størrelsen af den undersøgte prøve. Thissection introducerer en tredje kategori, der er en delmængde af et systems intensive egenskaber. Denne tredje kategori, kendt som kolligativ ejendomme, kan kun anvendes på løsninger. Bydefinition, en af egenskaberne ved en opløsning, er en kolligativ egenskab, hvis det kun afhænger af forholdet mellem antallet af partikler af opløst stof og opløsningsmiddel i opløsningen, ikke identiteten af det opløste stof.
Meget få af de fysiske egenskaber ved en løsning er kollektive egenskaber. Lad os som et eksempel på dette begrænsede sæt fysiske egenskaber overveje, hvad der sker med dampen af opløsningsmidlet, når vi tilsætter et opløst stof til dannelse af en opløsning. Vi definerer Po som fordampning af den rene væske ![]() opløsningsmidlet
opløsningsmidlet ![]() og P som damptryk af opløsningsmidlet efter tilsætning af et opløst stof.
og P som damptryk af opløsningsmidlet efter tilsætning af et opløst stof.
Po = damptryk af den rene væske eller opløsningsmiddel
P = damptryk af opløsningsmidlet i opløsning
Når en væskes temperatur er under kogning punkt, kan vi antage, at de eneste molekyler, der kan flygte fra væsken til dannelse af en gas, er dem, der ligger nær overfladen af væsken.
Når der tilsættes en opløsningsmiddel til opløsningsmidlet, optager nogle af de opløste molekyler rummet nær væskeoverfladen, vist i nedenstående figur. Når et opløst stof opløses i opløsningsmiddel, falder antallet af opløsningsmiddelmolekyler nær overfladen, og opløsningsmidlets damptryk falder.

Dette har ingen indflydelse på den hastighed, hvormed opløsningsmiddelmolekyler i gasfasen kondenserer til dannelse af en væske. Men det falder, hvorved opløsningsmiddelmolekylerne i væsken kan undslippe i gasfasen. Som et resultat skal dampens tryk på opløsningsmidlet, der undgår fra en opløsning, være mindre end damptrykket i det rene opløsningsmiddel.
| P | < | Po | ||
| damptryk af opløsningsmiddel over en opløsning |
damptryk af det rene opløsningsmiddel |
Mellem 1887 og 1888 viste Francois-Marie Raoult, at dampens tryk i en opløsning er lig med molfraktionen af opløsningsmidlet gange damptrykket i den rene væske.
| P | = | Csolvent Po | ||||
| damptryk af opløsningsmidlet over en opløsning |
damptryk i det rene opløsningsmiddel |
Denne ligning, der er kendt som Raoults lov, er let at forstå. Når opløsningsmidlet er rent, og molafbrydelsen af opløsningsmidlet er lig med 1, er P lig med Po. Da molfraktionen af opløsningsmidlet bliver mindre , dampens tryk på opløsningsmidlet, der undslipper fra opløsningen, bliver også mindre.
Lad os antage, for øjeblikket, at opløsningsmidlet er den eneste komponent i opløsningen, der er flygtig nok til at have et målbart damptryk. Hvis dette er sandt, vil dampens tryk på opløsningen være lig med dampens tryk på opløsningsmidlet, der undgår løsningen. Raoults lov antyder, at forskellen mellem det rene opløsningsmiddels damptryk og opløsningen stiger, når molfraktionen af opløsningsmidlet aftager.
Ændringen i damptrykket, der opstår, når der tilsættes opløst opløsning til et opløsningsmiddel, er derfor en kolligativ egenskab. Hvis det afhænger af molopløsningen af det opløste stof, skal det afhænge af forholdet mellem antallet af partikler af opløst stof til opløsningsmiddel i opløsningen, men ikke identiteten af det opløste stof.
id = “073060fe6c”>
Kogepunkt Højde og frysepunktsdepression
Nedenstående figur viser konsekvenserne af, at opløsningsmidler sænker dampens tryk. linjeforbindelsespunkterne B og C i dette fasediagram indeholder kombinationerne af temperatur og tryk, hvormed det rene opløsningsmiddel og dets damp er i ligevægt. Hvert punkt på denne linie beskriver derfor damptrykket af det puresolvent ved den temperatur. Den stiplede linje i dette figur beskriver den rette es af en opløsning opnået ved opløsning af opløst stof i opløsningsmidlet.Ved en hvilken som helst given temperatur er damptrykket af opløsningsmidlet, der undslipper fra opløsningen, mindre end damptrykket i det rene opløsningsmiddel. Den stiplede linie ligger derfor under den faste linje.
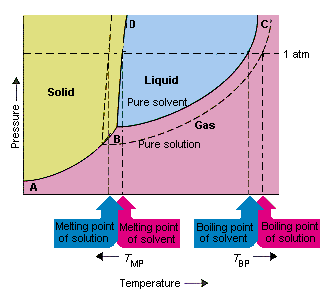
Faldet i dampens tryk af opløsningsmidlet, der opstår, når der tilsættes et opløst stof til opløsningsmidlet, forårsager en forøgelse af kogepunktet og et fald i opløsningens smeltepunkt.
Ifølge denne figur kan opløsningen ikke koge ved samme temperatur som det rene opløsningsmiddel. Hvis damptrykket på opløsningsmidlet, der slipper ud af opløsningen, er mindre end damptrykket af det rene opløsningsmiddel ved en given temperatur, skal opløsningen opvarmes til en højere temperatur, før det koger. Sænkning af dampens tryk på opløsningsmidlet, der opstår, når det bruges til at danne en opløsning, derfor øger væskens kogepunkt.
Da fasediagrammer blev introduceret, blev tredobbeltpunktet defineret som den eneste kombination af temperatur og tryk, hvormed gas, væske og fast stof kan eksistere på samme tid. Figuren ovenfor viser at opløsningens tredobbelte punkt finder sted ved en lavere temperatur end det rene opløsningsmiddels tredobbelte punkt. I sig selv er ændringen i tripelpunktet ikke vigtig. Men det resulterer i en ændring i temperaturen, hvormed opløsningen fryser eller smelter. For at forstå hvorfor skal vi se pleje ud fuldt ud på linjen, der adskiller de faste og flydende områder i fasediagrammet. Denne linje er næsten lodret, fordi et stofs smeltepunkt ikke er særlig følsomt over for tryk.
Tilføjelse af et opløst stof til et opløsningsmiddel ændrer ikke den måde, hvorpå smeltepunktet afhænger af tryk. Linjen, der adskiller de faste og flydende områder af opløsningen, er derfor parallel med den linje, der tjener den samme funktion for det rene opløsningsmiddel Denne linje skal dog passere gennem det tredobbelte punkt for opløsningen. Faldet i det tredobbelte punkt, der opstår, når opløst opløsning opløses i et opløsningsmiddel, nedsætter derfor opløsningens smeltepunkt.
Figuren ovenfor viser, hvordan ændring i damptryk, der forekommer, når et opløst stof opløses i et opløsningsmiddel, fører også til ændringer i smeltepunktet og opløsningsmidlets kogepunkt. Da ændringen i damptryk er en kolligativ egenskab, som kun afhænger af det relative antal opløste og opløsningsmiddelpartikler ændringerne i opløsningsmidlets kogepunkt og smeltepunkt er også kolligative egenskaber.
![]()
Beregninger af ColligativeProperties
Den bedste måde at dæmoner på at vigtigheden af kolligative ejendomme er at undersøge konsekvenserne af Raoults lov. Raoultfundede, at dampens tryk på opløsningsmidlet, der undgår opløsning, er proportionalt med molfraktionen af opløsningsmidlet.
P = CsolventPo
Men damptrykket i et opløsningsmiddel er ikke en kolligativ ejendom. Kun ændringen i damptryk, der opstår, når der tilsættes et opløst stof til opløsningsmidlet, kan medtages blandt de opløsningsegenskaber.
Da tryk er en tilstandsfunktion, kan ændringen i dampens tryk på opløsningsmidlet, der opstår, når et opløst stof tilsættes opløsningsmidlet, defineres som forskellen mellem dampens tryk i det rene opløsningsmiddel og dampens tryk i opløsningsmidlet. undslipper fra løsningen.
P = Po – P
At erstatte Raoults lov i denne ligning giver følgende resultat.
P = Po – Csolvent Po = (1 – Csolvent) Po
Denne ligning kan forenkles ved at huske forholdet mellem molfraktionen af det opløste stof og molfraktionen af opløsningsmidlet.
Csolute + Csolvent = 1
Udskiftning af dette forhold til ligningen, der definerer Pgives en anden form for Raoults lov.
P = CsolutePo
Denne ligning minder os om, at ændringen i dampens tryk på opløsningsmidlet, der opstår, når et opløst stof tilsættes opløsningsmidlet, er proportionalt med molfraktionen af det opløste stof. Efterhånden som mereopløst opløses i opløsningsmidlet, falder opløsningsmidlets damptryk, og ændringen i opløsningsmidlets damptryk stiger.
Fordi ændringer i opløsningsmidlets (TBP) kogepunkt, der opstår, når et opløst stof tilsættes til et opløsningsmiddel, skyldes ændringer i opløsningsmidlets damptryk, er størrelsen af ændringen i kogepunktet også proportional til molopløsningen af det opløste stof.
![]() TBP = kbsolute
TBP = kbsolute
I fortyndede opløsninger er molfraktionen af det opløste stof proportional med molaliteten af opløsningen, som vist i nedenstående figur.

Ligningen, der beskriver størrelsen af kogepunktelevationen, der opstår, når et opløst stof tilsættes til et opløsningsmiddel, skrives derfor ofte som følger.
![]() TBP = kbm
TBP = kbm
Her er ![]() TBPis kogepunktets højde – ændringen i kogepunktet, der opstår, når et opløst stof opløses i opløsningsmidlet
TBPis kogepunktets højde – ændringen i kogepunktet, der opstår, når et opløst stof opløses i opløsningsmidlet ![]() og kb er en proportionalitetskonstant kendt som molalt kogepunkts højde konstant for opløsningsmidlet.
og kb er en proportionalitetskonstant kendt som molalt kogepunkts højde konstant for opløsningsmidlet.
En lignende ligning kan skrives for at beskrive, hvad der sker med et opløsningsmiddels frysepunkt (eller smeltepunkt), når en opløsningsmiddel tilsættes opløsningsmidlet.
![]() TFP = -kfm
TFP = -kfm
I denne ligning er ![]() TFP frysepunktet depression
TFP frysepunktet depression ![]() ændringen i frysepunktet, der opstår, når det opløste stof opløses i opløsningsmidlet – og kfis den molale frysepunkts depressionskonstant for opløsningsmidlet. Et negativt tegn bruges i denne ligning til at indikere, at opløsningsmidlets frysepunkt falder, når der tilsættes et opløst stof.
ændringen i frysepunktet, der opstår, når det opløste stof opløses i opløsningsmidlet – og kfis den molale frysepunkts depressionskonstant for opløsningsmidlet. Et negativt tegn bruges i denne ligning til at indikere, at opløsningsmidlets frysepunkt falder, når der tilsættes et opløst stof.
Værdierne for kf og kbas samt frysepunkterne og kogepunkterne for et antal rene opløsningsmidler er angivet i nedenstående tabeller.
Frysepunktsdepressionskonstanter
Kogepunkts elevationskonstanter
Øvelsesopgave 6:
Beregn molekylvægten af svovl, hvis 35,5 g svovl opløses i 100,0 gram CS2 for at fremstille en opløsning, der har et kogepunkt på 49,48 oC.
Klik her for at kontrollere dit svar på Practice Problem 6
Klik her for at se en løsning på Practice 6
Øvelsesopgave 7:
Bestem molekylvægten af eddikesyre, hvis en opløsning, der indeholder 30,0 gram eddikesyre pr. kilo vand fryser ved -0,93oC. Er disse resultater enige med antagelsen om, at eddikesyre har formlen CH3CO2H?
Klik her for at kontrollere dit svar på Practice Problem 7
Klik her for at se en løsning på Practice Problem 7
Hvad ville der ske i beregningen i Practice Opgave 7 blev gentaget med en stærkere syre, såsom saltsyre?
Øvelse Opgave 8:
Forklar, hvorfor en 0,100 m opløsning af HC1 opløst i benzen har et frysepunktsnedtryk på 0,512oC, mens en 0,100 m opløsning af HCI i vand har et frysepunktsnedtryk på 0,352oC.
Klik her for at kontrollere dit svar på øvelsesopgave 8
I 1884 Jacobus Henricus van “t Hoff introducerede et andet udtryk til frysepunktsdepression og kogepunktshøjdeudtryk for at forklare de kolligative egenskaber af opløsninger af forbindelser, der adskiller sig, når de opløses i vand.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Ved at erstatte den eksperimentelle værdi for frysepunktsdepressionen af en 0,100 m HCI-opløsning i denne ligning giver en værdi for i-sigtet på 1,89. Hvis HCI ikke adskilles i vand, ville jeg være 1. Hvis det adskiller sig helt, ville jeg være 2. Den eksperimentelle værdi af 1,89 foreslår mindst 95% af HCl-molekylerne dissocierer i denne opløsning.
Øvelse Opgave 9:
Forklar, hvorfor 0,60 gram eddikesyre opløses i 200 gram benzen for at danne en opløsning, der sænker benzenets frysepunkt til 5,40oC.
Klik her for at kontrollere dit svar på Øvelsesopgave 9
![]()
Osmotisk tryk
I 1784 opdagede den franske fysiker og præst Jean AntoineNollet, at en griseblære fyldt med en koncentreret opløsning af alkohol i vand ekspanderede, da den blev nedsænket i vand. Blæren fungerede som en semipermeabel membran, som tillod vandmolekyler at komme ind i opløsningen, men holdt alkoholmolekyler i at bevæge sig i den anden retning. Bevægelse af en komponent i en opløsning gennem en membran for at fortynde opløsningen kaldes osmose, og det tryk, der produceres, kaldes det osmotiske tryk ().
Osmotisk tryk kan demonstreres med apparatet vist i nedenstående figur. En semipermeabel membran er bundet over den åbne ende af et tidselrør. Røret fyldes derefter delvist med en opløsning af sukker eller alkohol i vand og nedsænkes i et mindre vand. Vand vil strømme ind i røret, indtil trykket på vandkolonnen på grund af tyngdekraften afbalancerer detosmotiske tryk, der driver vand gennem membranen.

Vand strømmer gennem den semipermeable membran til at fortynde alkoholopløsningen, indtil tyngdekraften trækker ned på søjlen i denne opløsning afbalancerer det osmotiske tryk, der skubber vandet gennem membranen.
Samme år, som Raoult opdagede forholdet mellem dampopløsningen i en opløsning og damptrykket i et puresolvent, Jacobus Henricus van “t Hoff fandt ud af, at det osmotiske tryk i en fortyndet opløsning () overholdt en ligning analog med den ideelle gasligning.
| |
= | nRT | ||
| V |
Denne ligning antyder, at osmotisk tryk er et andet eksempel på en kolligativ egenskab, fordi dette tryk afhænger af forholdet mellem antallet af opløste partikler og volumenet af opløsningen ![]() n / V
n / V ![]() ikke identiteten af de solide partikler. minder os også om størrelsen af osmotisk tryk. Ifølge denne ligning er en 1,00 M s olution har et osmotisk tryk på 22,4 atm ved 0oC.
ikke identiteten af de solide partikler. minder os også om størrelsen af osmotisk tryk. Ifølge denne ligning er en 1,00 M s olution har et osmotisk tryk på 22,4 atm ved 0oC.

Dette betyder, at en 1,00 M løsning skal være i stand til at understøtte en søjle med vand 670 tommer eller næsten 56 fod høj !
Biologer og biokemikere drager ofte fordel af osmotisk tryk, når de isolerer komponenterne i en celle. Når en celle tilsættes til en vandig opløsning, der indeholder en meget høj koncentration af ioner end væsken i cellen, efterlader cellen vand ved at strømme gennem cellemembranen, indtil cellerne krymper så meget, at membranen bryder. Alternativt, når en celle placeres i en opløsning, der har en meget mindre ionstyrke, strømmer vand ind i cellen, og cellen udvides, indtil cellemembranen sprænges.
![]()