Tidsskrifter | Politik | Tilladelse til gastroenterologiforskning
Forudsigelighed af gastrisk tarmmetaplasi af spredt patchy erythema set ved endoskopi
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
en afdeling for gastroenterologi og hepatologi, National Center for Global Health and Medicine (NCGM), Tokyo, Japan
bAfdelingen for klinisk forskning og informatik International Clinical Research Center Research Institute, NCGM, Tokyo, Japan
cDivision of Internal Medicine, Kosin University College of Medicine, Busan, Korea
dDepartment of Gastroenterology and Hepatology, Wakayama Medical University, Wakayama, Japan
eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokyo, Japan
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japan
gTilsvarende forfatter: Naoyoshi Nagata, Department of G astroenterologi og hepatologi, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokyo 162-8655, Japan
Manuskript accepteret til offentliggørelse 26. september 2011
Kort titel: Endoskopisk diagnose af tarmmetaplasi
doi: https://doi.org/10.4021/gr357w
- Abstrakt
- Introduktion
- Metoder
- Resultater
- Diskussion
| Abstrakt | ▴Top |
Baggrund: Tarmmetaplasi (IM) betragtes som en premalignant læsion. Imidlertid er endoskopisk diagnose af IM blevet betragtet som vanskelig. Ved hjælp af endoskopi fandt vi et unikt mønster af erytem, “Mottled Patchy Erythema (MPE)”, som inkluderer svær IM. Helicobacter pylori (Hp) -infektion i sig selv kan forårsage erytem, hvilket afspejler histologiske ændringer i maveslimhinden. Derfor tilmeldte vi Hp-udryddelse patienter for at validere forholdet mellem MPE og patologiske fund.
Metoder: Vi indskrev patienter med kronisk gastritis, der gennemgik en vellykket HP-udryddelse mindst 6 måneder før undersøgelsen. Vi definerede MPE som multiple flade eller deprimerede erytematøse læsioner. Når vi støder på MPE ved endoskopi, udførte vi biopsi på både MPE-stedet og ikke-MPE-stedet. Ikke-MPE-stedet blev defineret som en tilstødende slimhinde placeret inden for 3 cm fra MPE-stedet. Alle biopsiprøver blev evalueret immunhistokemisk for IM-undertype ved anvendelse af MUC2-, MUC5AC-, MUC6-, CD10- og CDX2-pletter. Graden af IM blev defineret i henhold til det opdaterede Sydney-system. Den diagnostiske nøjagtighed af MPE-fundene for patologisk IM blev beregnet. forholdet mellem MPE og IM-undertype blev også vurderet.
Resultater: I alt 102 patienter blev udvalgt til undersøgelsen. Af disse havde 55 (54%) patienter MPE. Der blev taget biopsiprøver fra MPE-stederne og ikke-MPE-steder fra disse 55 patienter. IM-procenter og median-scoringer af IM var begge signifikant højere på MPE-stederne (P < 0,001) end på ikke-MPE-stederne. Følsomheden og specificiteten for MPE ved påvisning af histologisk IM var henholdsvis 72,7% og 84,1%. Ingen signifikante associationer blev observeret i ekspressionen af MUC2, MUC5AC, MUC6, CD10 og CDX2 mellem MPE-steder og ikke-MPE-steder. Der var ingen signifikante forskelle i forholdet (komplet / ufuldstændig) af IM-undertyper mellem de to grupper.
Konklusioner: MPE er et nyttigt endoskopisk fund til påvisning af histologisk IM uden brug af kromoendoskopi og forstørrende endoskopi. Imidlertid er IM-undertypen vanskelig at identificere. I en periode med Hp-udryddelse har MPE potentialet til at blive et forudsigende fund for risikoen for gastrisk kræft.
Nøgleord: Tarmmetaplasi; Præmignant læsion; Endoskopisk fund; Erytem; Endoskopi med hvidt lys; Undertype, udryddelse; Helicobacter pylori
| Introduktion | ▴Top |
Det menes, at udviklingen af gastrisk kræft involverer en flertrinsproces, herunder Helicobacter pylori (Hp) infektion, kronisk gastritis, kirtelatrofi, intestinal metaplasi (IM) og endelig dysplasi. IM og gastrisk atrofi betragtes sammen som risikofaktorer for udvikling af mavekræft af tarmtypen og betragtes som premaligne læsioner.Gastrisk atrofi kan genkendes ved endoskopi og korrelerer med histologisk evaluering. Imidlertid har diagnosen IM ved anvendelse af standard hvidt lys-endoskopi været anset for at være vanskelig på grund af IM, der mangler forskel i farve og dens tilstedeværelse som flere flade læsioner.
For nylig , fandt vi, at et unikt erytematøst fund ved endoskopi kunne observeres, selv efter Hp-udryddelse. Vi beskriver dette fund som “Mottled Patchy Erythema (MPE).” MPE kan genkendes som flere flade eller let deprimerede erytematøse læsioner under standard hvidt lys endoskopi; patologisk inkluderer det svær IM. Hp-infektion i sig selv kan forårsage erytem set ved endoskopi, hvilket afspejler histologiske ændringer såsom infiltration af inflammatoriske celler og ødem. , vi indskrev patienter, der gennemgik Hp-udryddelse for at validere forholdet mellem MPE og patologiske fund.
| Metoder | ▴Top |
Patientvalg
Patienter med kronisk gastritis, der gennemgik en vellykket HP udryddelse mindst 6 måneder før undersøgelsen, blev prospektivt tilmeldt undersøgelsen ved National Center for Global Health and Medicine (NCGM) mellem januar 2008 og december 2008. Eksklusionskriterier i udelukkede brugen af ikke-steroide antiinflammatoriske lægemidler (NSAID’er), antacida og antitrombotiske lægemidler i løbet af de 4 uger før endoskopi. Vi udelukkede også patienter med gastrisk kirurgi, hæmoragisk sygdom, levercirrhose, nyresvigt, hjertesvigt og tidlig eller avanceret gastrisk kræft. Skriftligt informeret samtykke blev opnået fra deltagerne i overensstemmelse med Helsinki-erklæringen og dens efterfølgende revision. Undersøgelsesprotokollen blev godkendt af NCGM’s etiske komité.
Helicobacter pylori-udryddelse
Patienter med kronisk gastritis og mavesårsygdom induceret af Hp-infektion gennemgik udryddelsesbehandling. Patienter blev behandlet med et 7-dages regime bestående af amoxicillin, clarithromycin og en protonpumpehæmmer (PPI) to gange dagligt, hvilket var det standardreguleringsregime, der blev godkendt i Japan. Hvis udryddelse ikke lykkedes, blev der indgivet et andet regime bestående af amoxicillin, metronidazol og PPI. Udryddelse blev bekræftet ved negativ histologisk undersøgelse af gastriske biopsier sammen med en negativ 13C-urinstof-åndedrætstest (13C-UBT) 2 til 3 måneder efter afslutningen af udryddelsesbehandlingen. Når alle testene var negative, blev en patient defineret som negativ for Hp-infektion.
Endoskopisk vurdering
Mindst 6 måneder efter udryddelsen af Hp gennemgik patienter endoskopisk undersøgelse. Vi brugte et endoskop med høj opløsning uden forstørrelse (Olympus videoscope, model GIF-H260) for at observere tilstedeværelsen af MPE i maveslimhinden. Vi definerede MPE som flere flade eller let deprimerede erytematøse læsioner, der kunne skelnes fra overbelastet slimhinde, blødning, angioektasi, plettet erytem og lineært erytem (fig. 1A, B). Vi skelner også mellem MPE og rødlig slimhinde med et regenererende epitel ledsaget af sår eller sårar.
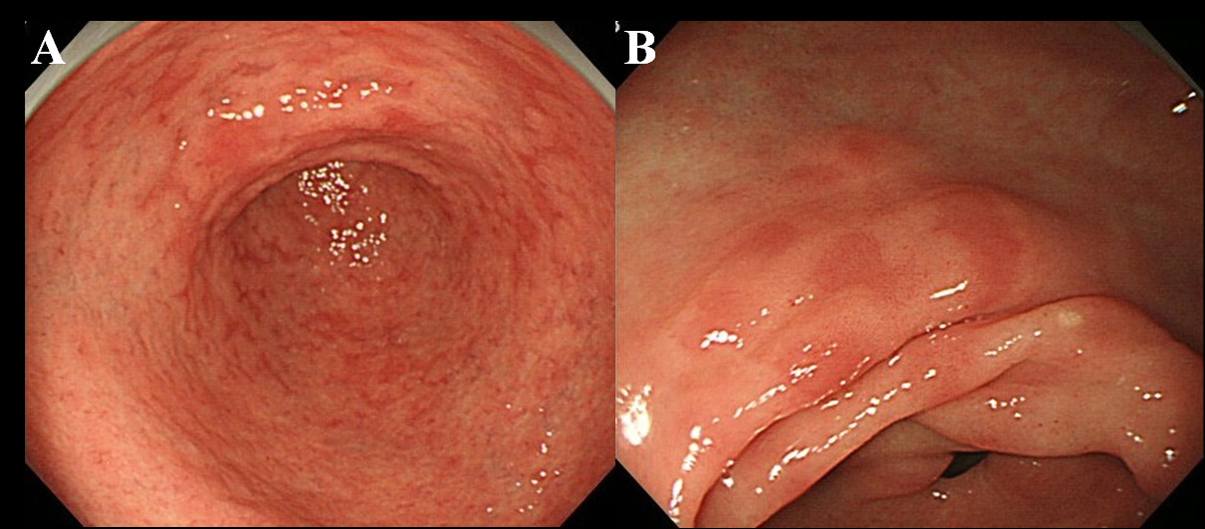 Klik for stort billede |
Figur 1. Endoskopisk fundning af MPE. (A) Multipel og flad erytem i antrummet; (B) Flad og deprimeret erytem i antrumets mindre krumning. |
Når vi stødte på et fund af MPE-fund ved endoskopi, udførte vi biopsi af både MPE-stedet og ikke-MPE-stedet. Ikke-MPE-stedet blev defineret som en tilstødende slimhinde placeret inden for 3 cm fra MPE-stedet (fig. 2).
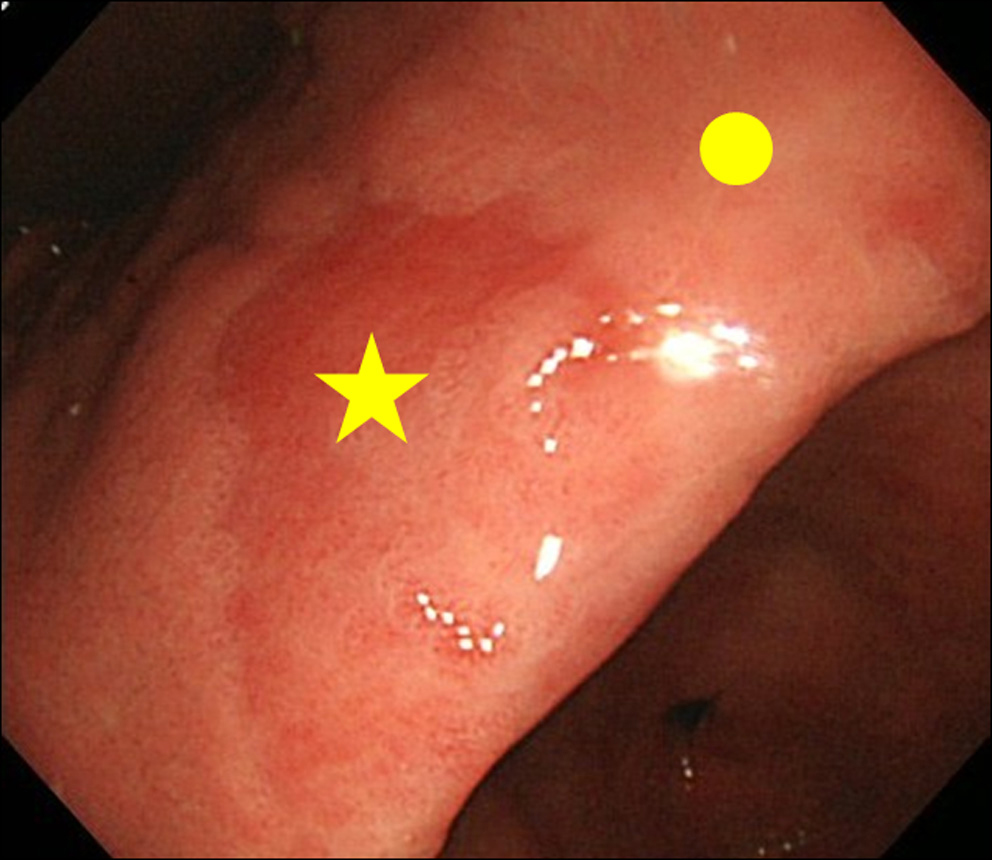 Klik for stort billede |
Figur 2. Biopsisite. (★) Biopsisite for MPE; (•) Biopsisite for ikke-MPE. Ikke-MPE-sted blev defineret som en tilstødende slimhinde placeret inden for 3 cm fra MPE-stedet. |
Omfanget af den atrofiske grænse blev klassificeret i 3 trin: mild, moderat og svær som defineret af Kimura og Takemoto.
Histologisk vurdering
Biopsiprøver blev sendt til vores laboratorium fikseret i 10% bufret formalin. Prøverne blev behandlet, indlejret i paraffin og skåret i 4 um sektioner. Objektglas fra hver prøve blev farvet ved hjælp af hæmatoxylin-eosin (HE) (fig.3A) og immunhistokemisk farvning. De immunhistokemiske pletter inkluderede følgende: (1) MUC2, en markør for tarmslimin, der er nyttig til påvisning af bægerceller (fig. 3B), (2) MUC5AC, en markør for gastrisk mucin, som udtrykkes i slimhindehalsceller og foveolært epitel (fig. 3C), (3) MUC6, en markør for gastrisk mucin, der udtrykkes i slimhindeceller i kroppens halszone og pyloriske kirtler i antrummet (fig. 3D), (4) CD10, en nyttig markør til detektion af børstens kant af tyndtarmen (fig. 3E) og (5) CDX2, en markør for tilstedeværelsen af IM (fig. 3F). Vi brugte CDX2, fordi nylige undersøgelser har vist, at CDX2-ekspression kunne observeres i vid udstrækning i IM-kirtler og forsvandt ikke efter udryddelse af Hp. Tilstedeværelsen af IM blev bekræftet af både HE og immunhistokemisk farvning.
Subtyperne af IM blev klassificeret som komplette eller ufuldstændige typer. Den komplette type blev defineret som nedsat ekspression af gastrisk mucin (MUC5AC eller MUC6) og coekspression af intestinal mucin (MUC2) og CD10 (fig. 3A-F). Den ufuldstændige type blev defineret som ekspressionen af gastrisk mucin (MUC5AC eller MUC6) og MUC2. Da der ikke findes etablerede kriterier for at kategorisere en sag som både de komplette og ufuldstændige typer i et afsnit, tildelte vi IM-undertyperne som den udbredte type.
Graden af IM blev scoret baseret på det opdaterede Sydney-system (0: ingen, 1: mild, 2: moderat, 3: markeret).
Statistisk analyse
Vi delte patienterne i to grupper baseret på, om patienterne var positive eller negative for MPE. Vi brugte Student’s t-test til at sammenligne alder og periode med udryddelse. Chi-kvadrat-testen eller Fishers nøjagtige sandsynlighedstest blev brugt til kønsforhold og graden af endoskopisk atrofi i de to grupper.
Vi sammenlignede også de histologiske fund mellem MPE-stedene og ikke-MPE-stedene. For at sammenligne forskellene mellem de to biopsisites brugte vi Wilcoxon Matched-Pairs Signed-Ranks Test til IM median score og Fishers nøjagtige test for prævalensen af IM-, IM-undertyper og IM-fænotyper. Følsomhed, specificitet, positive og negative forudsigelige værdier og positive og negative sandsynlighedsforhold for MPE set ved endoskopi til påvisning af patologisk IM blev beregnet. P-værdier < 0,05 blev betragtet som signifikante. Alle statistiske analyser blev udført med Stata-software, version 10 (StataCorp LP, College Station, TX, USA).
| Resultater | ▴Top |
Patientkarakteristika
I undersøgelsesperioden var 157 patienter som gennemgik øvre endoskopi og modtog Hp-udryddelse blev gennemgået. Vi udelukkede 52 af de 157 patienter fra analyse efter et af følgende kriterier: brug af antacida (31), antitrombotiske lægemidler (17) eller NSAID’er (3); eller tidligere levercirrhose (5), hjertesvigt (1) eller tidlig gastrisk kræft (2). Mere end et udelukkelseskriterium anvendt på nogle patienter.
I alt 102 patienter blev derfor valgt til analyse efter eksklusion. Af disse var der 55 (54%) patienter med MPE. Der blev ikke observeret nogen signifikante forskelle i gennemsnitsalderen og køn mellem MPE-positive og -negative patienter (tabel 1). Der var ingen signifikante forskelle mellem de to grupper efter Hp-udryddelsesperioden. Imidlertid optrådte gastrisk atrofi med en højere sværhedsgrad (moderat til svær) signifikant oftere i den MPE-positive gruppe sammenlignet med den MPE-negative gruppe (positiv 65,6% versus negativ 45,0%, P = 0,035).
 Klik for at se |
Tabel 1. Demografiske egenskaber for patienter (n = 102) |
Endoskopiske fund og patologiske træk
 Klik for at se |
Tabel 2. Sammenligning af IM-score mellem MPE og ikke-MPE-sted (n = 55) |
Ingen signifikante associationer blev observeret i ekspressionen af MUC2, MUC5AC, MUC6, C D10 og CDX2 mellem MPE-steder og ikke-MPE-steder (tabel 3). Der var ingen signifikant forskel i forholdene (komplet / ufuldstændig) af IM-undertyper mellem de to grupper (MPE: 18/30 versus ikke-MPE: 8/10, P = 0,778).
 Klik for at se |
Tabel 3. Fænotyper og undertyper af tarmmetaplasi |
| Diskussion | ▴Top |
I denne undersøgelse fokuserede vi på et unikt erytematøst udseende set ved endoskopi efter Hp-udryddelse. Vi kaldte dette fund “MPE”, og vi fandt ud af, at tilstedeværelsen af MPE som set ved endoskopi typisk var karakteristisk for patologisk IM.
Diagnosen IM med konventionel endoskopi har blevet betragtet som vanskelig, fordi IM normalt vises i flad slimhinde og udviser få morfologiske ændringer. Kaminishi et al rapporterede “askefarvet nodulær ændring” som en indikator for IM; nøjagtigheden af disse undersøgelsesresultater var høj med en specificitet på 98-99%, men følsomheden var lav (6-12%). Kaminishi et al bemærkede, at konventionel endoskopi er mindre anvendelig til bekræftelse af diagnosen IM. Nye undersøgelser er opstået vedrørende endoskopisk konstatering af IM ved hjælp af forstørrende endoskopi. Det er blevet rapporteret, at de karakteristiske fund af gastriske gruber set med methylenblå kromendoskopi og det “villuslignende udseende” set med konfokal endoskopi har været nyttige til diagnosticering af IM. Uedo et al rapporterede, at udseendet af “en lyseblå kam” ( LBC) er et nøjagtigt tegn på tilstedeværelsen af IM, set med smalbånds billeddannelse (NBI) forstørrende endoskopi. På grund af de høje udstyrsomkostninger og de yderligere færdigheder og den tid, der kræves til nærmere undersøgelse ved hjælp af specialværktøjer som NBI eller forstørrende endoskopi, er screening med dette udstyr imidlertid ikke praktisk i daglig klinisk praksis. Derudover er der en øget risiko for beskadigelse af DNA i mave-tarmslimhinden, når du bruger kromoendoskopi med methylenblåt efterfulgt af hvidt lys, hvilket kræver forsigtighed ved brugen. Derfor er det mere fordelagtigt at diagnosticere IM ved at finde MPE uden brug af kromoendoskopi og forstørrende endoskopi. Vores undersøgelsesresultater antyder, at tilstedeværelsen af IM kan diagnosticeres med standardendoskopi uden biopsi.
Hvorfor kan MPE observeres selv efter udryddelsen af Hp? Dette kan tilskrives histologiske ændringer i gastrisk slimhinde. De bemærkelsesværdige histologiske ændringer efter udryddelse inkluderer forbedringer i infiltration af inflammatoriske celler, epitelial hyperplasi og ødem. De endoskopiske billeder af erytematøs og ødematøs slimhinde, der ser ud til at være forbedret, afspejler disse histologiske ændringer. Derfor spekulerer vi i, at MPE består af et tilbageværende område med vedvarende erytematøs IM og et hurtigt genoprettet ikke-IM-område, der er resultatet af vellykket Hp-udryddelse. Udryddelsen af Hp fik kontrasten mellem MPE-området og ikke-MPE-områder til at blive klarere. Det er imidlertid ukendt, hvorfor kun MPE-stedet observeres som en erytematøs slimhinde. Det kan sandsynligvis udledes, at et meget tæt område af mikrofartøjer omgiver metaplastiske kirtler; dette er ikke belyst i denne undersøgelse. Derudover var IM-score på MPE-stedet signifikant højere end score på non-MPE-stedet. Vi spekulerer i, at udseendet af erytematøs slimhinde er forbundet med tilstedeværelsen af mange metaplastiske kirtler.
Den nuværende undersøgelse viste, at IM-komplette undertype overvejende blev fundet i maveslimhinden . Undertypen af IM er klassificeret i enten den komplette eller ufuldstændige type; disse er de mest anvendte undertyper. Flere undersøgelser har vist, at den komplette type ikke udviser nogen øget risiko for at udvikle carcinom, mens den ufuldstændige type er forbundet med en øget risiko for ondartet transformation. Imidlertid er sammenhængen mellem undertyperne og risikoen for gastrisk kræft ikke bredt accepteret. På nuværende tidspunkt er det vanskeligt at identificere nogen af undertyperne ved hjælp af standardendoskopi.
Det er blevet rapporteret, at Hp-udryddelsesbehandling er effektiv til forebyggelse af både gastrointestinalt mavesår såvel som udvikling af gastrisk kræft. Disse anvendelser af Hp-udryddelsesbehandling vil sandsynligvis dukke op i klinisk praksis i den nærmeste fremtid. Der skal dog udvises forsigtighed mod risikoen for udvikling af gastrisk kræft efter udryddelse af HP. Karakteristika for gastrisk kræft efter udryddelse er rapporteret at omfatte patologisk svær IM ved corpus og alvorlig gastrisk atrofi som detekteret ved endoskopi. Derfor er det nødvendigt nøje at observere tilstedeværelsen af IM selv efter Hp-udryddelse.
Afslutningsvis er tilstedeværelsen af MPE ved endoskopisk undersøgelse karakteristisk for patologisk IM.Det ville være nyttigt i klinisk praksis at være i stand til at diagnosticere patologisk IM uden kromoendoskopi eller forstørrende endoskopi. MPE har potentialet til at blive et forudsigende fund for risikoen for gastrisk kræft i æra med Hp-udryddelse.
Anerkendelser
Vi anerkender Dr. Hidenobu Watanabe og Dr. Hiroyoshi Ota for deres rådgivende tjenester til denne undersøgelse vedrørende de patologiske evalueringer. Vi ønsker at udtrykke vores taknemmelighed til Hisae Kawashiro, klinisk forskningskoordinator, for hjælp til dataindsamling.
Støtte til støtte
Dette arbejde blev støttet af Grant of National Center for Global Health and Medicine (21-108).
Interessekonflikter
Forfatterne erklærer, at de ikke har nogen interessekonflikter.
| ▴Top |
- Correa P. Human gastrisk carcinogenese: en multistap og multifaktoriel proces – First American Cancer Society Award Lecture on Cancer Epidemiologi og forebyggelse. Cancer Res. 1992; 52 (24): 6735-6740.
offentliggjort - Leung WK, Sung JJ. Gennemgangsartikel: tarmmetaplasi og gastrisk carcinogenese. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Helicobacter pylori-infektion og udvikling af gastrisk kræft. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. En endoskopisk anerkendelse af den atrofiske grænse og dens betydning i kronisk gastritis. Endoskopi. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Biopsisites, der er egnede til diagnose af Helicobacter pylori-infektion og vurdering af omfanget af atrofisk gastritis. Am J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Endoskopisk klassificering af kronisk gastritis baseret på en pilotundersøgelse foretaget af Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Gastrisk epitel dysplasi. Hvordan klinisk patologisk baggrund er relateret til ledelse. Kræft. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Endoskopisk diagnose af gastrisk tarmmetaplasi efter Helicobacter pylori-udryddelse. Endoskopi. 2009; 41 (suppl. I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Klassificering og klassificering af gastritis. Det opdaterede Sydney System. International workshop om histopatologi af gastritis, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin-genekspression i normalt, preneoplastisk og neoplastisk humant gastrisk epitel. Cancer Res. 1995; 55 (12): 2681-2690.
offentliggjort - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Slimhinde som nøglemolekyler til klassificering af tarmmetaplasi i maven. Virchows Arch. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. Tarmmetaplasi i human mave viser forskellige mønstre af mucin (MUC1, MUC2, MUC5AC og MUC6) ekspression. Cancer Res. 1999; 59 (5): 1003-1007.
offentliggjort - Groisman GM, Amar M, Livne E. CD10: et værdifuldt værktøj til den lette mikroskopiske diagnose af mikrovilløs inklusionssygdom (familiær mikrovilløs atrofi). Am J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. Ectopeptidases CD10, CD13, CD26 og CD143 er opreguleret i gastrisk kræft. Int J Oncol. 2004; 25 (5): 1223-1232.
offentliggjort - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Ektopisk ekspression af homeodomain-protein CDX2 i tarmmetaplasi og karcinomer i maven. Kræft Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Afvigende ekspression af CDX2 i maveslimhinden med og uden tarmmetaplasi: virkning af udryddelse af Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, et al. Forstørrelseskromoendoskopi til diagnose af gastrisk tarmmetaplasi og dysplasi. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Ekstern validering af en klassifikation for methylenblå forstørrelseskromoendoskopi i præmaligne gastriske læsioner. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoskopiske mønstre af gastrisk slimhinde og dens klinisk patologiske betydning. Verden J Gastroenterol. 2003; 9 (11): 2552-2556.
offentliggjort - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. En ny metode til diagnosticering af gastrisk tarmmetaplasi: smalbåndsbilleddannelse med forstørrende endoskopi. Endoskopi. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Forstørrelse endoskopi: forbedrer det slimhindeoverfladeanalyse til diagnose af gastrointestinale neoplasier ?. Endoskopi. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Kromoendoskopi med methylenblåt og tilhørende DNA-beskadigelse i Barretts spiserør. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Fem års opfølgende undersøgelse af histologiske og endoskopiske ændringer i maveslimhinden efter Helicobacter pylori-udryddelse. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. To til fire år histologisk opfølgning af gastrisk slimhinde efter Helicobacter pylori-udryddelse. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Mucinprofilerne af normal mave slimhinde, tarmmetaplasi og dets varianter og gastrisk carcinom. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al.Tarmmetaplasi typer og risikoen for gastrisk kræft: en kohortestudie i Slovenien. Int J kræft. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Påvisning af en øget forekomst af tidlig gastrisk kræft hos patienter med tarmmetaplasi type III, der følges nøje. Tarm. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Review-artikel: præneoplastiske tilstande i maveslimhinden – en praktisk tilgang for den forvirrede kliniker. Aliment Pharmacol Ther. 2001; 15 (Suppl 1): 43-50.
offentliggjort - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Effekt af udryddelse af Helicobacter pylori på forekomsten af metakront gastrisk carcinom efter endoskopisk resektion af tidlig gastrisk kræft: et åbent, randomiseret kontrolleret forsøg. Lancet. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Gastrisk kræft påvist efter Helicobacter pylori-udryddelse. Fordøjelsesendoskopi. 2007; 19: 167-173.
Dette er en open-access artikel distribueret under betingelserne i Creative Commons Attribution License, som tillader ubegrænset brug, distribution og reproduktion i ethvert medium, forudsat at det originale arbejde er korrekt citeret.
Gastroenterology Research er udgivet af Elmer Press Inc.