Datos del elemento cadmio
El elemento químico cadmio se clasifica como un metal de transición. Fue descubierto en 1817 por Friedrich Stromeyer.

Zona de datos
| Clasificación: | Cadmio es un metal de transición |
| Color: | blanco azulado |
| Peso atómico: | 112.41 |
| Estado: | sólido |
| Punto de fusión: | 321,1 oC, 594,3 K |
| Punto de ebullición: | 765 oC, 1038 K |
| Electrones: | 48 |
| Protones: | 48 |
| Neutrones en el isótopo más abundante: | 66 |
| Capa de electrones: | 2,8,18,18,2 |
| Configuración electrónica: | 4d10 5s2 |
| Densidad @ 20oC: | 8,65 g / cm3 |
Mostrar más, incluyendo: Calores, Energías, Oxidación, Reacciones,
Compuestos, Radios, Conductividades
| Volumen atómico: | 13,1 cm3 / mol |
| Estructura: | hcp: hexagonal compactado |
| Dureza: | 2,0 mohs |
| Capacidad calorífica específica | 0,23 J g-1 K-1 |
| Calor de fusión | 6.192 kJ mol-1 |
| Calor de atomización | 112 kJ mol-1 |
| Calor de vaporización | 99,87 kJ mol-1 |
| Primera energía de ionización | 867,7 kJ mol-1 |
| Segunda energía de ionización | 1631.4 kJ mol-1 |
| Tercera energía de ionización | 3616.2 kJ mol-1 |
| Afinidad electrónica | – |
| Número mínimo de oxidación | 0 |
| Min. número de oxidación común | 0 |
| Número máximo de oxidación | 2 |
| Máx. oxidación común no. | 2 |
| Electronegatividad (escala de Pauling) | 1,69 |
| Polarizabilidad volumen | 7.2 Å3 |
| Reacción con aire | leve, w / ht ⇒ CdO |
| Reacción con HNO3 15 M | leve ⇒ Cd (NO3) 2, NOx |
| Reacción con HCl 6 M | suave, ⇒ H2, CdCl2 |
| Reacción con NaOH 6 M | ninguno |
| Óxido (s) | CdO, CdO2 |
| Hidruro (s) | CdH2 |
| Cloruro (s) | CdCl2 |
| Radio atómico | 151 pm |
| Radio iónico (1+ ion) | – |
| Radio iónico (2+ ion) | 109 pm |
| Radio iónico (3+ iones) | – |
| Radio iónico (1- ion) | – |
| Radio iónico (2 iones) | – |
| Radio iónico (3 iones) | – |
| El conductividad térmica | 96,6 W m-1 K-1 |
| Conductividad eléctrica | 14,7 x 106 S m-1 |
| Punto de congelación / fusión: | 321,1 oC, 594,3 K |

Una pequeña bola de cadmio metálico, con una moneda como referencia de tamaño.

Friedrich Stromeyer, quien descubrió el cadmio en 1817.
Vecindad de la tabla periódica del cadmio
| Grupo 11 |
Grupo 12 | Grupo 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 En |
| 6 | 79 Au |
80 Hg |
81 Tl |
Descubrimiento del cadmio
El químico alemán Friedrich Stromeyer descubrió el cadmio en 1817 como una impureza en el óxido de zinc. (1)
Stromeyer hizo su descubrimiento después de una solicitud del gobierno para inspeccionar las farmacias en la ciudad de Hildesheim, Alemania.
En aquellos días, el óxido de zinc se usaba, como todavía se usa, para tratar afecciones de la piel. Por alguna razón, las farmacias de Hildesheim vendían carbonato de zinc en lugar del óxido de zinc habitual.
Stromeyer sabía que calentar el carbonato de zinc hasta que estuviera al rojo vivo lo convertiría en óxido. Lo hizo con muestras de las farmacias. Descubrió que el carbonato blanco brillante se convirtió en un óxido que debería haber sido blanco, pero en realidad era amarillo / naranja.
Normalmente, este color sugeriría contaminación por hierro o plomo, pero Stromeyer no pudo encontrar ningún rastro. de estos elementos.
Visitó la fábrica de Salzgitter donde las farmacias habían comprado el carbonato de zinc. Preguntó por qué estaban vendiendo carbonato de zinc en lugar del óxido habitual.
El gerente le explicó que su carbonato de zinc era del color esperado, blanco, y que era fácil de vender.
Cuando intentaron convertir el carbonato en óxido mediante calentamiento, siempre se ponía amarillo. Dado que el óxido de zinc debería ser blanco, no pudieron venderlo. Lo habían analizado cuidadosamente en busca de contaminación por hierro, pero no pudieron encontrar ninguna.
Stromeyer decidió entonces que analizaría este óxido de zinc amarillo con cuidado él mismo. Encontró que el color amarillo era causado por «la presencia de un óxido metálico peculiar, cuya existencia hasta ahora no se había sospechado».
Extrajo este nuevo óxido metálico del óxido de zinc y luego lo redujo para aislar el primer cadmio metálico del mundo. Comparó su apariencia con la del platino y midió su densidad en 8,75 g / cm3, muy similar a la actual. valor aceptado.
Hizo un trabajo adicional y descubrió que otros compuestos de zinc también contenían su nuevo metal. Analizó el zinc metal «puro» y descubrió que su nuevo metal estaba presente incluso en este.
Estimó que el nuevo metal estaba presente entre 0.1% y 1% en zinc y sus compuestos, de los cuales pudo aislar 3 gramos de cadmio metálico puro.
Stromeyer sugirió el nombre de cadmio después de «cadmia», el nombre latino de calamina. Calamina es un nombre antiguo para un mineral de zinc.
El químico alemán Karl Hermann descubrió el cadmio de forma independiente en 1818. Hermann había notado un inesperado color amarillo en el sulfuro de zinc Se suponía que el amarillo era de impurezas de arsénico, pero Hermann se dio cuenta de que en realidad se debía a un elemento previamente desconocido. ment. (2)


El telururo de cadmio se usa para fabricar células solares de película delgada, que pueden absorben más del 90% de la luz visible. Imagen: NREL
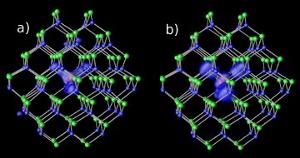
Impurezas de magnesio en nanocristales de cadmio-selenio en dos niveles de brecha diferentes : (a) resonante y (b) híbrido. Imagen: NERSC
Aspecto y características
Efectos nocivos:
Cadmio y sus compuestos son muy tóxicos.
Características:
El cadmio es un metal blando, maleable, dúctil, de color blanco azulado, que se corta fácilmente con un cuchillo. Es un excelente conductor eléctrico y muestra buena resistencia a la corrosión y al ataque de productos químicos.
Es similar en muchos aspectos al zinc en sus propiedades químicas.
El cadmio se empaña en el aire y es soluble en ácidos pero no en álcalis.
El metal se quema en el aire para formar óxido de cadmio marrón (CdO).
Usos del cadmio
El uso principal del cadmio es en baterías (especialmente baterías recargables de níquel-cadmio, NiCad, baterías).
Como resultado de su bajo coeficiente de fricción y su alta resistencia a la fatiga, el cadmio se utiliza en aleaciones para rodamientos. El cadmio se utiliza en aleaciones de bajo punto de fusión y es un componente de muchos tipos de soldaduras. También se utiliza en galvanoplastia.
Los compuestos que contienen cadmio se utilizan en los fósforos de televisión en blanco y negro, y en los fósforos azules y verdes para los tubos de imágenes de televisión en color. El sulfuro de cadmio se usa como pigmento amarillo y el seleniuro de cadmio se usa como pigmento rojo, a menudo llamado rojo de cadmio.
El cadmio y el telurio se pueden combinar en módulos fotovoltaicos de película delgada de CdTe cuyas características físicas son ideales para producción de células solares. Son de costo relativamente bajo y tienen una banda prohibida casi perfecta para la recolección de energía solar.
Abundancia e isótopos
Abundancia de la corteza terrestre: 150 partes por mil millones en peso, 30 partes por mil millones en moles
Sistema solar de abundancia: 6 partes por billón por peso, 70 partes por billón por moles
Costo, puro: $ 46 por 100 g
Costo, volumen: $ 0,77 por 100 g
Fuente: El cadmio se presenta con mayor frecuencia en pequeñas cantidades asociado con minerales de zinc, como la esfalerita (ZnS). La greenockita (CdS) es el único mineral de cadmio de importancia. Casi todo el cadmio se obtiene como subproducto de las operaciones de refinación de mineral de zinc, cobre y plomo.

- Friedrich Stromeyer, Annals of Philosophy, editado por Thomas Thomson, Volumen XIII, 1819, Robert Baldwin, p108
- JW Mellor, Un tratado comprensivo en química inorgánica y teórica, Volumen IV, 1929, Longmans, Green and Co. Ltd., p404
Cite esta página
Para enlaces en línea , copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
o
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
Para cite esta página en un documento académico, utilice la siguiente cita compatible con MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.