Datos del elemento de francio
El elemento químico francio se clasifica como un metal alcalino. Fue descubierto en 1939 por Marguerite Perey.

Zona de datos
| Clasificación: | Francio es un metal alcalino |
| Color: | gris plateado-metalizado (presunto) |
| Atómico peso: | (223), sin isótopos estables |
| Estado: | sólido |
| Punto de fusión: | 27 oC, 300 K |
| Punto de ebullición: | 677 oC, 950 K |
| Electrones: | 87 |
| Protones: | 87 |
| Neutrones en el isótopo más abundante: | 136 |
| Capa de electrones: | 2, 8,18,32,18,8,1 |
| Configuración electrónica: | 7s1 |
| Densidad a 20oC: | 1.873 g / cm3 |
Mostrar más, incluyendo: Calores, Energías, Oxidación,
Reacciones, compuestos, radios, conductividades
| Volumen atómico: | 71.07 cm3 / mol |
| Estructura: | se cree que es bcc: cúbica centrada en el cuerpo |
| Dureza: | – |
| Capacidad calorífica específica | – |
| Calor de fusión | 2 kJ mol-1 |
| Calor de atomización | 73 kJ mol-1 |
| Calor de vaporización | 64 kJ mol-1 |
| Primera energía de ionización | 384 kJ mol-1 |
| Segunda energía de ionización | – |
| Tercera energía de ionización | – |
| Afinidad electrónica | – |
| Número mínimo de oxidación | 0 |
| Min. número de oxidación común | 0 |
| Número máximo de oxidación | 1 |
| Máx. oxidación común no. | 1 |
| Electronegatividad (escala de Pauling) | 0,7 |
| Polarizabilidad volumen | 48,7 Å3 |
| Reacción con aire | – |
| Reacción con 15 M HNO3 | – |
| Reacción con 6 M HCl | vigorosa, ⇒ H2, FrCl |
| Reacción con NaOH 6 M | vigorosa, ⇒ H2, FrOH |
| Óxido (s) | – |
| Hidruro (s) | – |
| Cloruro (s) | – |
| Radio atómico | – |
| Radio iónico (1+ ion) | 194 pm |
| Radio iónico (2+ iones) | – |
| Radio iónico (3+ iones) | – |
| Radio iónico (1- ion) | – |
| Radio iónico (2 iones) | – |
| Radio iónico (3 iones) | – |
| Conductividad térmica | 3,61 W m-1 K-1 |
| Conductividad eléctrica | – |
| Punto de congelación / fusión: | 27 oC, 300 K |

Esta muestra de mineral de uranio contiene aproximadamente 100 000 átomos de francio-223 (3,3 x 10-20 g). El francio es radiactivo; existen menos de 30 g en la Tierra en un momento dado. Imagen Ref. (1)
Descubrimiento de Francium
El francio fue descubierto por Marguerite Perey en 1939 cuando estaba investigando la desintegración radiactiva del actinio-227.
El descubrimiento tuvo lugar en el Instituto Curie de París. El elemento toma su nombre del país de su descubrimiento: Francia.
El descubrimiento comenzó en 1935, cuando Perey, de 26 años, leyó un artículo de investigación que afirmaba que los científicos estadounidenses habían descubierto partículas beta emitidas por el actinio, que tenía una mayor cantidad de energía de lo normal.
Perey sentía curiosidad por este hallazgo y, como ya era una experta en trabajos relacionados con el actinio, decidió llevar a cabo sus propios experimentos con el actinio. Produjo una muestra de actinio ultrapuro y estudió su radiación. Perey descubrió que aproximadamente el 1% de la radiactividad de los actinios era causada por la emisión de partículas alfa, no partículas beta.
Perey había descubierto que el actinio-227 podía descomponerse emitiendo un núcleo de helio (también llamado partícula alfa) de su propio núcleo. El núcleo hijo formado era un elemento no descubierto anteriormente al que eligió llamar francio en honor a su país de origen, Francia.
227Ac → 223Fr + 4He
Con 87 protones, el nuevo elemento pertenecía a Grupo 1 de la tabla periódica, uniendo los otros cinco metales alcalinos: litio, sodio, potasio, rubidio y cesio.
El descubrimiento del francio completó los descubrimientos de la humanidad de elementos naturales.
Todos los elementos descubiertos desde entonces se han descubierto cuando el elemento se ha producido en el laboratorio.

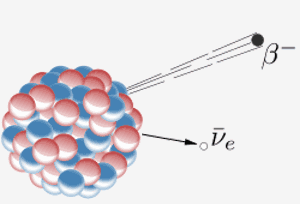
Un núcleo emite una partícula beta ( un electrón) y un antineutrino. El resultado de esto es que un neutrón en el núcleo se convierte en un protón. Cuando el elemento 87 de la tabla periódica (francio) hace esto, el protón extra significa que se convierte en el elemento 88 (radio).
Apariencia y características
Efectos nocivos:
El francio es altamente radiactivo.
Características:
El francio es un metal radiactivo, inestable y pesado con una vida media máxima de solo 22 minutos. Tiene un punto de fusión bajo (27 oC, 81 oF) y, si se pudiera acumular una cantidad suficiente, sería líquido en una habitación cálida.
El francio es el segundo elemento más raro en la corteza terrestre, junto a astato. Existen menos de treinta gramos de francio en la Tierra en un momento dado.
El francio es el menos electronegativo de todos los elementos, por lo tanto, debería ser el metal alcalino más reactivo químicamente. Desafortunadamente, no está disponible en cantidades suficientes para mostrar que reacciona con el agua; se produce en pequeñas cantidades en aceleradores de partículas. En teoría, su reacción con el agua sería más violenta que la del cesio y mucho más violenta que la del sodio.
El francio se ha estudiado más recientemente en la Universidad de Stony Brook, Nueva York. Los científicos atraparon hasta diez mil átomos de francio a la vez utilizando rayos láser en un campo magnético para medir sus propiedades.
Usos del francio
Comercialmente, no hay usos para el francio debido a su rareza e inestabilidad. Se utiliza únicamente con fines de investigación.
Desintegración del francio
Los isótopos del francio, con números de masa que van de 200 a 232, suelen sufrir desintegración alfa o beta.
Estos son solo algunos ejemplos de las rutas de descomposición del francio:
El francio-223 es el isótopo de vida más larga del elemento. Tiene una vida media de 22 minutos. Puede emitir una partícula alfa (un núcleo de helio) para formar astato-219 o una partícula beta para formar radio-223. (Una partícula beta es un electrón que se emite desde un núcleo cuando un neutrón se convierte en un protón).
El francio-221 tiene una vida media de 5 minutos. Puede emitir una partícula alfa para formar astato-217 o una partícula beta para convertirse en radio-221.
El francio-216 tiene una vida media de 0,7 microsegundos. Puede emitir una partícula alfa para formar astato-212 o un positrón para formar radón-216.
El francio-212 tiene una vida media de 19 minutos. Puede emitir una partícula alfa para formar astato-208 o capturar un electrón orbital para formar radón-212. (2) (Durante la captura de electrones orbitales, el núcleo captura uno de los electrones del propio átomo y emite un neutrino.)
Abundancia e isótopos
Abundancia de la corteza terrestre: ~ 0 partes por millón , ~ 0 partes por millón
Sistema solar de abundancia: ~ 0 partes por billón por peso, ~ 0 partes por billón por moles
Costo, puro: $ por 100 g
Costo, a granel: $ por 100 g
Fuente: El francio se produce de forma natural como resultado de la desintegración radioactiva alfa del actinio.
Isótopos: El francio tiene 33 isótopos cuyas vidas medias se conocen, con números de masa de 200 a 232. Ninguno es estable. 223Fr tiene la vida media más larga con 21,8 minutos.

- Foto de Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, Edición 6.
Cite esta página
Para enlaces en línea, copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
o
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Para citar esta página en un documento académico, utilice el siguiente cita que cumple con MLA:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.