Datos del elemento polonio
El elemento químico polonio se clasifica como calcógeno y metaloide. Fue descubierto en 1898 por Marie y Pierre Curie.

Zona de datos
| Clasificación: | El polonio es un calcógeno y un metaloide |
| Color: | gris plateado |
| Peso atómico : | (209), sin isótopos estables |
| Estado: | sólido |
| Punto de fusión: | 254 oC, 527 K |
| Punto de ebullición: | 960 oC, 1233 K |
| Electrones: | 84 |
| Protones: | 84 |
| Neutrones en el isótopo más abundante: | 125 |
| Capa de electrones: | 2,8 , 18,32,18,6 |
| Configuración electrónica: | 4f14 5d10 6s2 6p4 |
| Densidad a 20oC: | 9,4 g / cm3 |
Mostrar más, incluyendo: Calores, Energías, Buey idación,
reacciones, compuestos, radios, conductividades
| Volumen atómico: | 22,23 cm3 / mol |
| Estructura: | cúbica simple |
| Dureza: | – |
| Capacidad calorífica específica | 0,12 J g-1 K-1 0,12 |
| Calor de fusión | 13 kJ mol-1 |
| Calor de atomización | 142 kJ mol-1 |
| Calor de vaporización | 120 kJ mol-1 |
| Primera energía de ionización | 812 kJ mol-1 |
| 2ª energía de ionización | – |
| 3ª energía de ionización | – |
| Afinidad electrónica | 180 kJ mol-1 |
| Número mínimo de oxidación | -2 |
| Min. número de oxidación común | -2 |
| Número máximo de oxidación | 6 |
| Máx. oxidación común no. | 4 |
| Electronegatividad (escala de Pauling) | 2.0 |
| Polarizabilidad volumen | 6,8 Å3 |
| Reacción con aire | leve, ⇒ PoO2 |
| Reacción con HNO3 15 M | – |
| Reacción con HCl 6 M | leve, ⇒ PoCl2 |
| Reacción con NaOH 6 M | ninguno |
| Óxido (s) | PoO2, PoO2 |
| Hidruro (s) | PoH2 |
| Cloruro (s) | PoCl2 |
| Radio atómico | 190 pm |
| Radio iónico (1+ ion) | – |
| Radio iónico (2+ iones) | – |
| Iónico radio (3+ iones) | – |
| Radio iónico (1- ion) | – |
| Radio iónico (2 iones) | – |
| Radio iónico (3 iones) | – |
| Conductividad térmica | 0,2 W m-1 K-1 |
| Conductividad eléctrica | 0,7 x 106 S m-1 |
| Punto de congelación / fusión: | 254 oC, 527 K |

Marie Curie en 1883, 16 años. El polonio fue el primer elemento que descubrió, 15 años después.
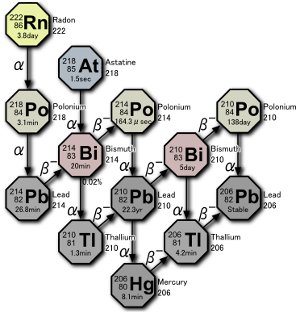
Parte del Serie de desintegración de uranio. En la naturaleza se producen tres isótopos de polonio, ya sea por la desintegración del propio gas radón o por la desintegración de átomos resultante de la desintegración del radón. Imagen de Tosaka.
Descubrimiento del polonio
El polonio fue el primer elemento descubierto por Marie y Pierre Curie.
Descubrieron el polonio y luego el radio en 1898 en París, mientras investigaban la radiactividad en la pecblenda (óxido de uranio).
Escribieron: «Creemos que la sustancia que hemos extraído de la pechblenda contiene un metal nunca antes conocido, similar al bismuto en sus propiedades analíticas. Si se confirma la existencia de este nuevo metal, sugerimos que debería ser llamado polonio después del nombre del país de origen de uno de nosotros «.
De acuerdo con los deseos de los Curie, el polonio lleva el nombre de Polonia, donde nació y creció Marie Curie.
Los peligros de trabajar con elementos radiactivos no se conocían cuando los Curie hicieron sus descubrimientos. Sus cuadernos de laboratorio de esta época son tan radiactivos que ahora están guardados en una caja forrada de plomo. (1)
Apariencia y características
Efectos nocivos:
El polonio es nocivo tanto por su toxicidad química como por su radiactividad. El polonio 210 es un emisor alfa, por lo que es muy peligroso si se ingiere o inhala.La exposición al polonio aumenta el riesgo de contraer varios tipos de cáncer.
Características:
El polonio es un metaloide poco común, radioactivo, gris plateado y poco común de fusión.
El polonio reacciona fácilmente con los ácidos diluidos, pero solo ligeramente con los álcalis.
Todos sus isótopos son radiactivos.
El 210Po emite un resplandor azul, ya que el aire que lo rodea se excita por la descomposición. productos. 1 gramo de Po emite tantas partículas alfa como 5 kilogramos de radio.
La energía liberada por la desintegración alfa del polonio es considerable y calienta el espacio que lo rodea. La energía liberada es tan grande (140 W / g) que una cápsula que contiene alrededor de medio gramo alcanza una temperatura superior a 500 ° C.
Usos del polonio
Los rayos alfa emitidos por El polonio se puede utilizar para eliminar la electricidad estática producida durante procesos como el papel de liar, el alambre y las láminas de metal. Sin embargo, las fuentes de rayos beta se utilizan con mayor frecuencia ya que son menos peligrosas.
210Po se puede utilizar como fuente de calor atómico, pero debido a la corta vida media del isótopo (138,4 días), no proporciona energía para usos a largo plazo.
El polonio también se utiliza en pinceles antiestáticos para eliminar el polvo de la película fotográfica. Está sellado en escobillas para controlar las emisiones radiactivas.
Abundancia e isótopos
Abundancia de la corteza terrestre: del orden de 1 parte por cuatrillón.
Abundancia del sistema solar: insignificante
Costo , puro: por 100 g
Costo, a granel: por 100 g
Fuente: El polonio es un elemento muy raro debido a la corta vida media de todos sus isótopos. Se encuentra en los minerales de uranio en cantidades diminutas. Puede obtenerse bombardeando bismuto natural, 209Bi, con neutrones para dar 210Bi, que luego se desintegra a 210Po a través de la desintegración β. Cada año se sintetizan aproximadamente 100 g de polonio.
Isótopos: El polonio tiene 29 isótopos cuyas vidas medias son conocidas, con números de masa de 190 a 218. Ninguno es estable. El isótopo más estable es el 209Po, con una vida media de 102 años.

Citar esta página
Para vincular en línea, copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
o
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Para citar esta página en un documento académico, utilice la siguiente cita compatible con MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.