Fronteras en fisiología
Introducción
Los barorreceptores arteriales sirven como sensores de primera línea para detectar cambios de presión arterial en el torrente sanguíneo. Los cambios en la presión arterial estimulan las terminaciones nerviosas mecanosensibles que se localizan en las paredes arteriales. La fuerza mecánica se transduce en señales eléctricas en las terminales nerviosas, lo que resulta en disparos de potenciales de acción dependientes de la presión en las neuronas barorreceptoras. Las señales nerviosas luego se propagan al centro de control cardiovascular en el tronco del encéfalo para la regulación barorrefleja de la presión arterial (Levy MN, 2007). Además, las estructuras supramedulares, incluido el núcleo cuneiforme del mesencéfalo y la corteza prefrontal medial ventral, también tienen un papel inhibidor en la regulación barorrefleja (Verberne et al., 1997).
Hay dos barorreceptores arteriales, a saber, los barorreceptores aórticos y los barorreceptores carotídeos, ubicados en la capa adventicia del arco aórtico y arterias carótidas, respectivamente. Los barorreceptores aórticos detectan la presión arterial en la aorta. Los cuerpos celulares (soma) de los barorreceptores aórticos se encuentran en el ganglio nodoso (NG) (Figura 1). Las señales nerviosas de las terminales nerviosas del barorreceptor aórtico se transmiten al ganglio nudoso a través de un nervio sensorial denominado nervio depresor aórtico (ADN) (Figura 1). Los barorreceptores carótidos detectan la presión arterial en la arteria carótida, que suministra sangre al cerebro. Las terminales nerviosas de los barorreceptores carótidos se localizan bilateralmente en las bifurcaciones de la arteria carótida, cerca de la arteria carótida interna. Las señales nerviosas de los barorreceptores carotídeos viajan a lo largo de los nervios del seno carotídeo (CSN) hasta su soma localizado en el ganglio petroso (PG). El ganglio petroso sobresale más allá del agujero yugular (Figura 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly y Rigual, 2000; Weijnen et al., 2000) . Debido a que los barorreceptores aórticos detectan la presión arterial en la aorta, que suministra sangre a toda la circulación sistémica, se espera que estos barorreceptores desempeñen un papel funcional importante en el mantenimiento de la presión arterial sistémica general. Por otro lado, los barorreceptores carotídeos detectan la presión de la sangre que llega al cerebro. Estos barorreceptores pueden ser más importantes para el mantenimiento de una presión arterial cerebral estable y un flujo sanguíneo cerebral.
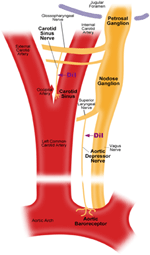
Figura 1. Diagrama esquemático de los nervios y terminales de los barorreceptores aórticos y carotídeos. Diagrama que ilustra las posiciones anatómicas de los terminales nerviosos de los barorreceptores aórticos y carotídeos, sus fibras nerviosas y las regiones somas. Los terminales de los barorreceptores aórticos se encuentran en el arco aórtico. Su fibra nerviosa aferente es el nervio depresor aórtico. El soma está en el ganglio nudoso (NG). El barorreceptor carotídeo se coloca en la arteria carótida interna junto a la bifurcación carotídea. Su nervio aferente es el nervio del seno carotídeo. El soma se encuentra en el ganglio petroso (PG).
Existen informes contradictorios sobre qué barorreceptores, barorreceptores aórticos o carótidas barorreceptores, son más sensibles a los cambios de presión arterial. Algunos investigadores informaron que los barorreceptores carotídeos son más sensibles a la presión (Donald y Edis, 1971; Fadel et al., 2003), mientras que otros creen que los barorreceptores aórticos son más sensibles a la presión (Glick y Covell, 1968; Pickering et al., 2008), y otros no han informado diferencias en la sensibilidad a la presión entre estos dos barorreceptores (Hainswor et al., 1970; James y Daly, 1970). Sin embargo, casi todos estos estudios anteriores utilizaron solo las respuestas barorreflejas (como la frecuencia cardíaca y la actividad del nervio simpático renal) como puntos finales para el ensayo de sensibilidad a los barorreceptores. Todavía no hay ningún estudio que registre y compare directamente la sensibilidad a la presión de las neuronas barorreceptoras aórticas y carotídeas per se.
Aquí, hemos utilizado una pinza de presión de alta velocidad para alterar la presión hidrostática dentro de las neuronas barorreceptoras y medido las correspondientes respuestas electrofisiológicas de estas neuronas mediante el pinzamiento del parche de células completas. También usamos una cámara de estiramiento uniaxial para estirar las neuronas barorreceptoras y medimos los cambios correspondientes en el Ca2 + citosólico en estas neuronas. Además, para los estudios en animales in vivo, medimos las descargas del potencial de acción inducidas por la presión en el depresor aórtico y los nervios del seno carotídeo, que son los nervios sensoriales de los barorreceptores aórticos y carotídeos respectivamente.
Materiales y métodos
Animales
Todos los experimentos con animales se llevaron a cabo bajo la autoridad de una licencia emitida por el Gobierno de la RAE de Hong Kong y la aprobación del Comité de Ética de Experimentación Animal de la Universidad China de Hong Kong.El Centro de Servicios de Animales de Laboratorio de la Universidad China de Hong Kong proporcionó ratas macho Sprague-Dawley (S / D) (180-200 g).
Cultivo primario
S / D se anestesiaron ratas con pentobarbital sódico (100 mg / kg). El área cervical izquierda se expuso mediante una incisión en la línea media en condiciones de esterilización. Como se muestra en la Figura 1, se expuso el nervio depresor aórtico o el nervio del seno carotídeo y se separaron cuidadosamente 2-3 mm del nervio de los tejidos circundantes mediante disección roma. Se aplicaron cristales fluorescentes del trazador lipofílico 1,1-dioctadecil-3,3,3 ′, 3′-tetrametilindocarbocianina (DiI) (Invitrogen) alrededor del nervio y se cubrieron con Kwik-Sil (World Precision Instruments, EE. UU.). Posteriormente se suturó la incisión. Se permitió que las ratas se recuperaran durante 5-7 días para permitir que el colorante DiI se difundiera de manera retrógrada a lo largo del nervio depresor aórtico o del nervio del seno carotídeo hasta los somas ubicados en el ganglio nodoso o el ganglio petroso, respectivamente.
Nodose o ganglio petroso se aislaron neuronas de ratas marcadas con DiI y se cortaron en trozos en EBSS helado. Se sometieron a digestión durante 1 ha 37 ° C con tripsina (1 mg / ml) y colagenasa IA (1 mg / ml). Las neuronas individuales se dispersaron mediante una trituración suave con una pipeta Glass Pasteur, seguida de centrifugación. Las neuronas se resuspendieron y se cultivaron en medio DMEM / F-12 complementado con FBS al 5%, antibiótico-antimicótico al 1% y NGF 7S (100 ng / ml). Se incluyó arabinofuranósido de citosina (Ara-C; 10 µM) en el medio de cultivo para inhibir el crecimiento de células en división. Las neuronas se cultivaron durante al menos 3 días antes de los experimentos. Para el registro del potencial de acción, las neuronas se aislaron recientemente y se incubaron en F12 al menos 30 minutos antes de los experimentos. Para todos los experimentos, las células se incubaron en portaobjetos de vidrio recubiertos previamente con 0,1 mg / ml de poli-L-lisina, excepto en los experimentos de estiramiento celular en los que las cámaras de silicona se recubrieron previamente con gelatina al 2%.
Patch Clamp
El registro de pinza de corriente de celda completa se logró mediante un amplificador de pinza de parche EPC7 (HEKA, Alemania). Se llenaron pipetas de parche con resistencia de 3 a 5 MΩ con solución de pipeta (en mM): gluconato de 130 K, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 por KOH. Las células se bañaron en el líquido cefalorraquídeo artificial (ACSF) (en mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glucosa, equilibrado con carbogen (95% O2 y 5 % CO2). En el registro de pinza de corriente, las células se mantuvieron en su potencial de membrana en reposo. Se utilizó un sistema de pinza de presión de alta velocidad (HSPC-1, ALA Scientific Instruments, EE. UU.) Para proporcionar presión positiva a la celda a través de una micropipeta. Las grabaciones se muestrearon a 50 kHz y se filtraron a 5 kHz. Los datos se analizaron con PulseFit (HEKA). Todos los experimentos se realizaron a temperatura ambiente.
Imágenes de calcio
La medición del Ca2 + citosólico se realizó como se describe en otra parte (Wong et al., 2010). Brevemente, las células se cargaron con 5 µM de Fluo-4 / AM durante 40 min. La medición del Ca2 + citosólico se realizó con solución tamponada con HEPES (en mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2, 10 HEPES, 10 glucosa, pH 7,4 mediante NaOH. El cambio de Ca2 + citosólico en respuesta al estiramiento uniaxial se realizó con STREX Cell Stretching System (ST-150, B-Bridge International, Inc.). Las células se estimularon mediante un estiramiento unidireccional del 10, 20 o 30% durante 1 s. La respuesta del Ca2 + citosólico se midió a temperatura ambiente. La fluorescencia de Fluo-4 se registró y analizó mediante el sistema de imagen confocal de barrido láser FV1000. El cambio en la respuesta de fluorescencia de Ca2 + citosólico se expresó como una relación (Fx / F0) de fluorescencia en tiempo real, donde Fx es la señal fluo-4 / AM en tiempo real y F0 es la señal fluo-4 / AM de línea de base antes del estiramiento.
Registro de actividad nerviosa
Se anestesiaron ratas con 100 mg / kg de pentobarbital sódico. El área cervical se expuso mediante una incisión en la línea media. La arteria carótida derecha se aisló y canuló con un catéter que se conectó al transductor de presión (ML221, ADInstruments, EE. UU.) Para el registro de la presión arterial. La vena femoral izquierda se canuló para inyección de fenilefrina y SNP. El nervio depresor aórtico izquierdo o el nervio del seno carotídeo se conectó a un electrodo de plata bipolar, seguido de un amplificador (amplificador diferencial de CA modelo 1700, A-M Systems Inc., EE. UU.). Tanto la presión arterial como la actividad nerviosa se registraron continuamente mediante el Cuadro 5.0 (AD Instruments). La actividad nerviosa se amplificó 10.000 veces y se filtró con un paso de banda de 100 a 5000 Hz. Los valores de la presión arterial media, la frecuencia cardíaca y la frecuencia de picos en respuesta a la fenilefrina se analizaron mediante el software Chart 5.0. Se calculó el cambio en la frecuencia de picos (frecuencia de picos después de fenilefrina; frecuencia de picos antes de fenilefrina) en respuesta al cambio máximo de presión arterial (presión arterial media después de fenilefrina; presión arterial media antes de fenilefrina) tras la inyección de fenilefrina (Lau et al., 2016) .
Análisis estadístico
Las trazas representativas se trazaron como trazas de curso temporal. Los datos de todos los experimentos se resumieron en un gráfico de barras que se expresó en media ± sem de los experimentos individuales. Se usó la prueba t de Student para el análisis estadístico. Se usó la prueba t por pares cuando fue apropiado.
Resultados
Propiedades de las neuronas del depresor aórtico y las neuronas del seno carotídeo
Dil se aplicó al nervio depresor aórtico o al nervio del seno carotídeo. Por lo tanto, las neuronas marcadas con Dil en el ganglio nodoso incluían las neuronas barorreceptoras que inervan el arco aórtico y las neuronas quimiorreceptoras que inervan el cuerpo aórtico. Por otro lado, las neuronas marcadas con Dil en El ganglio petroso incluía las neuronas barorreceptoras que inervan el seno carotídeo y las neuronas quimiorreceptoras que inervan el cuerpo carotídeo. Primero investigamos las propiedades básicas de estas neuronas etiquetadas con Dil. Las neuronas marcadas con DiI en el ganglio nodoso y petroso se cultivaron por separado y se sometieron a una corriente eléctrica despolarizante como se muestra en la Figura 2. Se registraron dos tipos de respuestas, una respondió con un único potencial de acción y la otra con potenciales de acción continuos después de la corriente despolarizante (Figura 2) (Belmonte y Gallego, 1983). Estas neuronas se sometieron posteriormente a un protocolo de presión hidrostática para probar su sensibilidad a los cambios en la presión hidrostática. Se aplicó una rampa de presión hidrostática positiva intracelularmente a través de una micropipeta de vidrio mediante el sistema de pinza de presión de alta velocidad (HSPC-1, ALA Scientific Instruments, EE. UU.) Hasta que se obtuvieron los potenciales de acción. Los resultados mostraron que el 45% de las neuronas barorreceptoras aórticas disparaban potenciales de acción continuos en respuesta a la corriente eléctrica despolarizante (Tabla 1A). Entre ellos, el 91% (41% / 45%) también respondió al cambio de presión hidrostática y mostró disparos potenciales de acción dependientes de la presión (Tabla 1A). El 55% restante de las neuronas barorreceptoras aórticas solo dispararon un único potencial de acción en respuesta a la corriente despolarizante (Tabla 1A), y entre ellas, el 40% (22% / 55%) pudo responder al cambio de presión (Tabla 1A). Para las neuronas barorreceptoras de la carótida, el 45% de las células dieron potenciales de acción continuos cuando fueron estimuladas por la corriente despolarizante (Tabla 1B). Entre ellos, el 82% (37% / 45%) también fueron sensibles al cambio de presión (Tabla 1B). Además, entre las neuronas barorreceptoras carotídeas que solo dispararon un único potencial de acción en respuesta a la corriente despolarizante, el 24% (13% / 55%) podría responder al cambio de presión (Tabla 1B).
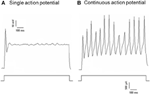
Figura 2. Registro del potencial de acción de las neuronas cultivadas del depresor aórtico y del seno carotídeo. Se muestran los rastros de los potenciales de acción que se registraron de dos neuronas representativas del depresor aórtico / seno carotídeo en una corriente despolarizante. (A) Neuronas representativas que disparan un único potencial de acción tras la estimulación actual; (B) Neuronas representativas que disparan solo potenciales de acción continuos sobre la estimulación actual. Panel inferior: protocolo de inyección de corriente. Barra de escala, horizontal, 100 ms, vertical, 10 mV (trazos superiores) y 500 pA (trazos inferiores). n = 27 y n = 38 para las neuronas del depresor aórtico y del seno carotídeo respectivamente.

Tabla 1. Propiedades del depresor aórtico y las neuronas del seno carotídeo.
Independientemente de si dispararon potenciales de acción únicos o potenciales de acción continuos, se encontró que el 63% de las neuronas barorreceptoras aórticas marcadas con Dil eran sensibles al cambio de presión, mientras que solo el 50% de las neuronas barorreceptoras carotídeas marcadas con Dil eran sensibles a la cambio de presión (Tabla 1).
Sensibilidad al estiramiento de las neuronas barorreceptoras aórticas y carótidas
Se analizó el umbral de presión para la descarga del potencial de acción. Como se muestra en la Figura 3, las neuronas barorreceptoras aórticas tenían un umbral de presión más bajo (24 ± 4 mmHg) que el de las neuronas barorreceptoras carotídeas (39 ± 4 mmHg).

Figura 3. Sensibilidad de las neuronas barorreceptoras aórticas y carotídeas a la presión hidrostática. (A, B) Panel superior, trazos representativos del curso del tiempo que ilustran los disparos del potencial de acción dependiente de la presión en las neuronas barorreceptoras aórticas (A) y carótidas (B). La rampa de presión (panel inferior) se aplicó al interior de las celdas a través de una micropipeta usando un sistema de abrazadera de presión de alta velocidad (HSPC). Barra de escala horizontal, 1 s, vertical, 20 mV y 20 mmHg. (C) Resumen que muestra el umbral de presión que inicia los disparos del potencial de acción en las neuronas barorreceptoras aórticas y carotídeas. n = 13 para las neuronas barorreceptoras aórticas y n = 15 para las neuronas barorreceptoras carotídeas. *** p < 0,01, según la prueba t de Student.
Respuesta de Ca2 + inducida por estiramiento en las neuronas barorreceptoras
Se sometieron a cultivos de depresores aórticos o del seno carotídeo 10, 20 o 30% de estiramiento uniaxial mediante el sistema de estiramiento celular STREX, que intenta imitar el estiramiento de los vasos sanguíneos bajo presión arterial. Los resultados mostraron que un tramo uniaxial del 20% indujo un marcado aumento en la fluorescencia del Ca2 + citosólico en las neuronas barorreceptoras aórticas pero no en las neuronas barorreceptoras carotídeas (Figuras 4A-C). Además, la magnitud de la fluorescencia de Ca2 + aumenta en respuesta a un estiramiento uniaxial del 30% fue mucho mayor en las neuronas barorreceptoras aórticas que en las neuronas barorreceptoras carótidas (Figuras 4A-C).
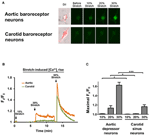
Figura 4. Sensibilidad de las neuronas del depresor aórtico y del seno carotídeo al estiramiento uniaxial. Las células se cargaron con colorante fluorescente sensible al Ca2 + Fluo-4 / AM. Se muestran imágenes representativas (A) y trazos de curso temporal (B) de Ca2 + citosólico relativo aumenta en respuesta al estiramiento uniaxial de 10, 20 y 30% de la longitud celular en las neuronas del depresor aórtico y del seno carotídeo. (C) Resumen del aumento máximo de Ca2 + citosólico en respuesta a diferentes grados de estiramiento. El cambio en el Ca2 + citosólico se expresó como Fx / F0, donde Fx es la señal fluo-4 / AM en tiempo real y F0 es la señal fluo-4 / AM de la línea de base antes del estiramiento. Media ± s.e.m. (n = 5). * p < 0.05, *** p < 0.01 en comparación con el control correspondiente, mediante prueba t por pares.
Actividad nerviosa de los barorreceptores in vivo
La actividad nerviosa de los dos barorreceptores se investigó in vivo. Se inyectó fenilefrina por vía intravenosa. Los cambios en la presión sanguínea tras la aplicación de fenilefrina se muestran en el panel superior de las Figuras 5A, B. Los cambios posteriores en la actividad del nervio barorreceptor se muestran en el panel inferior (Figuras 5A, B). La actividad nerviosa inducida por la presión fue mucho mayor en el nervio depresor aórtico que en el nervio del seno carotídeo (Figuras 5A, B). El cambio en la frecuencia de picos por aumento de mmHg se resume en la Figura 5C. El resultado indicó que los barorreceptores aórticos son más sensibles a la presión hidrostática que los barorreceptores carotídeos in vivo.
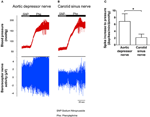
Figura 5. Actividad del nervio barorreceptor en rata in vivo. (A, B) Trazos representativos que muestran el cambio en la actividad del nervio depresor aórtico (A) y del nervio del seno carotídeo (B) tras la elevación de la presión arterial. En ambos (A, B), el panel superior fue el cambio en la presión arterial antes y después de la aplicación de Phe como lo indican las barras horizontales. El panel inferior fue el cambio correspondiente en la actividad nerviosa. (C) Datos resumidos que muestran el cambio en la actividad nerviosa por unidad de cambio de presión arterial. Media ± s.e.m. (n = 8). * p < 0.05 en comparación con el control en los barorreceptores aórticos, mediante la prueba t por pares.
Expresión de canales TRP
Se ha informado que varios canales TRP son mecano-sensibles, incluidos TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O «Neil y Heller, 2005; Christensen y Corey, 2007; Pedersen y Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Aquí, investigamos el posible papel de estos canales TRP mecanosensibles en relación con la aorta. y sensibilidad del barorreceptor carotídeo. Se compararon las expresiones de ARNm de estos canales en ganglio nudoso y petroso. Se encontró que las expresiones de TRPV4 y TRPC6 eran mayores en el ganglio nudoso en comparación con el ganglio petroso (Figura 6). La expresión de canales mecanosensibles en el ganglio nudoso puede contribuir a una mayor sensibilidad.
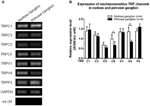
Figura 6. Expresión de canales TRP mecanosensibles en nudosis y ganglio petroso. (A) Imágenes de gel representativas que comparan el nivel de expresión de ARNm de los canales TRP mecanosensibles (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) entre las neuronas del ganglio nodoso y petroso. Se utilizó un análisis de RT-PCR semicuantitativo para comparar los niveles de expresión de ARNm de varios canales de TRP en relación con la expresión de ARNm de GAPDH. Los resultados de 9 experimentos se resumieron en (B). Los valores estaban en media ± sem. * p < 0.05, por prueba t por pares.
Discusión
En el presente estudio, se compararon las propiedades mecanosensibles de los barorreceptores aórticos y carotídeos. Los estudios de pinzamiento de parche de células enteras mostraron que, en comparación con las neuronas del seno carotídeo, un mayor porcentaje de neuronas depresoras aórticas eran sensibles al estiramiento. Además, se encontró que el umbral de presión que podría iniciar los disparos del potencial de acción era más bajo en las neuronas barorreceptoras aórticas que en las neuronas barorreceptoras carotídeas. El aumento de Ca2 + citosólico inducido por estiramiento uniaxial también se comparó entre el depresor aórtico y las neuronas del seno carotídeo.La magnitud del aumento de Ca2 + citosólico en respuesta al estiramiento uniaxial fue mucho mayor en las neuronas barorreceptoras aórticas que en las neuronas barorreceptoras carotídeas. Las neuronas barorreceptoras aórticas también mostraron un umbral más bajo de respuestas de Ca2 + citosólico al estiramiento uniaxial. En otra serie de experimentos, encontramos que el aumento inducido por la presión en los disparos del potencial de acción era mayor en el nervio depresor aórtico que en el nervio del seno carotídeo. Tomados en conjunto, nuestros datos proporcionan pruebas sólidas de que los barorreceptores aórticos son más sensibles a la presión arterial que los barorreceptores carotídeos.
Anteriormente, se había hecho un gran esfuerzo para comprender la diferencia de sensibilidades entre los dos barorreceptores. Sin embargo, los resultados son controvertidos. Algunos informes concluyeron que los barorreceptores aórticos son más sensibles al cambio de presión (Glick y Covell, 1968; Fan et al., 1996; Pickering et al., 2008), mientras que otros afirmaron que los barorreceptores carotideos son más sensibles al cambio de presión (Donald y Edis, 1971; Fadel et al., 2003). Sin embargo, casi todos estos estudios previos involucraron procedimientos quirúrgicos muy complicados y finalmente utilizaron respuestas barorreflejas, como la frecuencia cardíaca y el gasto simpático renal, como puntos finales para el ensayo de sensibilidad a los barorreceptores. Los procedimientos quirúrgicos complicados tienden a introducir errores experimentales, que pueden dar lugar a conclusiones controvertidas. Además, también es posible una variación dependiente de la especie animal en la sensibilidad de los barorreceptores. Además, la respuesta barorrefleja no solo está influenciada por la sensibilidad de los barorreceptores, sino también por muchos otros factores, como la conducción nerviosa, la mediación central, la contractilidad de los vasos sanguíneos y la función cardíaca. Por tanto, la evidencia de estudios previos es indirecta y difícilmente ideal. Hasta el momento, faltan estudios directos que comparen la sensibilidad a la presión de las neuronas barorreceptoras aórticas frente a las carótidas. En este estudio, se estudió la mecanosensibilidad directamente en neuronas barorreceptoras. Los datos sugieren fuertemente que los barorreceptores aórticos son más sensibles a la presión que los barorreceptores carotídeos. Esta información puede tener una relevancia fisiológica importante en la regulación de la presión arterial.
No está claro qué mecanismos subyacen a la diferencia en la sensibilidad a la presión entre los barorreceptores aórticos y carotídeos. Comparamos el nivel de expresión de varios canales TRP mecanosensibles (Figura 6) (O «Neil y Heller, 2005; Christensen y Corey, 2007; Pedersen y Nilius, 2007; Patel et al., 2010). Nuestros resultados mostraron que las neuronas barorreceptoras aórticas tienen una mayor expresión de varios canales TRP mecanosensibles, incluidos TRPV4 y TRPC6. Es posible que una mayor expresión de TRPV4 y / o TRPC6 pueda contribuir a la alta sensibilidad a la presión de los barorreceptores aórticos. Se necesitan más estudios para verificar el papel de estos canales iónicos.
Anteriormente se informó que el ganglio nudoso y el ganglio petroso contienen dos tipos diferentes de neuronas (Belmonte y Gallego, 1983). Uno de ellos da potenciales de acción continuos tras la estimulación eléctrica, mientras que el otro solo da una acción única. potencial tras la estimulación. Los autores asignaron a las primeras como neuronas sensibles a la presión y a las segundas como neuronas quimiosensibles. Nuestros resultados indican que puede no ser apropiado Te para asignar las neuronas sensibles a la presión y las neuronas insensibles a la presión solo en función de si disparan un potencial de acción único o potenciales de acción continuos en respuesta a la corriente despolarizante. De hecho, un gran porcentaje de células que disparan un único potencial de acción en respuesta a la estimulación eléctrica también son sensibles a la presión y, por tanto, pertenecen a las neuronas barorreceptoras sensibles a la presión (Figura 2 y Tabla 1).
En resumen, el presente estudio proporciona evidencia de que los barorreceptores aórticos son más sensibles a la presión que los barorreceptores carotídeos y agrega nueva información a la comprensión de la fisiología básica.
Contribuciones de los autores
EL y XY diseñan los experimentos y redactan el manuscrito. EL, CL e YY realizan los experimentos. XY, YH, AM y LJ revisaron el manuscrito. Todos los autores aprobaron la versión final del manuscrito.
Financiamiento
Este trabajo fue apoyado por subvenciones del Comité de Subvenciones de Investigación de Hong Kong CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, subvención 31470912 de la Fundación Nacional de Ciencias de China y subvención conjunta RGC-NSFC N_CUHK439 / 13.
Declaración de conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
James, JEA y Daly, MDB (1970). Comparación de las respuestas vasomotoras reflejas a la estimulación separada y combinada de los barorreceptores del seno carotídeo y del arco aórtico mediante presiones pulsátiles y no pulsátiles en perros. J. Physiol. 209, 257-293. doi: 10.1113 / jphysiol.1970.sp009165
Resumen de PubMed | CrossRef Texto completo | Google Académico
Levy MN, P. A. (2007). Fisiología cardiovascular. Filadelfia, PA: Mosby Elsevier.
Vander, A. J., Sherman, J. H. y Luciano, D. S. (1998). Fisiología humana: el mecanismo de la función corporal. Boston, MA: WCB McGraw-Hill.