Fronteras en microbiología celular y de infecciones
Introducción
Staphylococcus aureus es un importante patógeno humano aislado de pacientes hospitalizados en todo el mundo, que causa infecciones tanto hospitalarias como comunitarias ( Lowy, 1998). Este patógeno es el agente etiológico de varias infecciones sistémicas diferentes, que afectan la piel y los tejidos blandos, así como los sistemas musculoesquelético y circulatorio (Lowy, 1998; Changchien et al., 2016). Se informó que S. aureus puede sobrevivir en macrófagos humanos derivados de monocitos (Kubica et al., 2008). La virulencia de S. aureus está estrechamente relacionada con una variedad de enzimas secretadas y toxinas producidas por la bacteria (Otto, 2014). La hemolisina, la leucocidina (Panton-Valentine leucocidina, PVL) y la toxina 1 del síndrome de choque tóxico (TSST-1), que facilitan el daño de la membrana de los glóbulos rojos, lesionan la función fagocítica de los leucocitos e inducen el síndrome de choque tóxico, respectivamente, son fundamentales para la procesos patógenos de S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube y Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Estudios recientes han demostrado que la hemolisina también participa en la formación del biofilm de S. aureus (den Reijer et al., 2016). La creciente prevalencia de cepas de S. aureus resistentes a múltiples fármacos en entornos hospitalarios y comunitarios aumenta aún más los peligros de S. aureus y plantea un serio desafío para la terapia clínica (Voss y Doebbeling, 1995; Evangelista Sde y de Oliveira, 2015).
Recientemente, se han encontrado en nuestro hospital una serie de cepas pertenecientes a una clase de S. aureus con un fenotipo hemolítico incompleto (SIHP). La hemólisis causada por estas cepas SIHP es significativamente diferente del anillo hemolítico completo (fenotipo β-hemolítico) producido en otras cepas de S. aureus. Sin embargo, estas cepas SIHP aún no se han identificado y caracterizado de manera integral. Para explorar las características microbiológicas de estas cepas de SIHP, recolectamos 60 cepas de SIHP y las estudiamos usando múltiples criterios, incluido el fenotipo hemolítico, la expresión del gen de hemolisina, las características de resistencia a los medicamentos y la virulencia. Este estudio demuestra que los SIHP son cepas resistentes a la meticilina que expresan altamente β-hemolisina y poseen un alto potencial de virulencia.
Materiales y métodos
Cepas bacterianas
Sesenta SIHP Se aislaron cepas de pacientes ingresados en el segundo hospital afiliado de la Universidad de Soochow entre 2013 y 2015. Se tomaron muestras duplicadas de cada paciente para su análisis. A continuación, estos aislados se cultivaron en placas de agar sangre de oveja Columbia (CHROMagar Company, Shanghai, China) a 35 ° C en una atmósfera que contenía CO2 al 5% (v / v). La identidad de las cepas como S. aureus se confirmó usando el sistema de microbiología automatizado Phoenix-100 (Becton, Dickinson and Company, EE.UU.). Las cepas de S. aureus control, con fenotipo hemolítico completo, fueron aisladas de pacientes de nuestro hospital durante el mismo período de tiempo. Aquí, S. aureus con el fenotipo hemolítico completo se denominó cepas SCHP. La cepa de referencia S. aureus ATCC25923 (Centro de Laboratorio Clínico de Shanghai, China) tiene el fenotipo hemolítico completo y también actuó como cepa de control. El Comité de Ética Médica del Segundo Hospital Afiliado de la Universidad de Soochow aprobó este estudio y todos los aislamientos se recolectaron con el consentimiento del paciente en este estudio.
Análisis comparativos del fenotipo hemolítico incompleto
El S. aureus Las cepas se cultivaron en placas de agar sangre comerciales de diferentes compañías (CHROMagar, Autobio Diagnostics Co., Ltd., China y BioMérieux, China) así como en placas de agar sangre de oveja preparadas por ellos mismos utilizando agar sangre Columbia en polvo (OXIDE, Reino Unido). Las bacterias se cultivaron a 35 ° C en una atmósfera que contenía 5% de CO2 (v / v) durante 24 horas y luego se sometieron a pases seriados. Luego se observó el fenómeno hemolítico. También se observaron cepas clínicamente aisladas con fenotipo hemolítico completo y la cepa de referencia ATCC25923 como control para análisis comparativos.
Determinación de los niveles de ARNm de cuatro genes de hemolisina de S. aureus mediante transcripción inversa cuantitativa en tiempo real PCR (qPCR)
La extracción de ARN total del SIHP y la cepa de referencia ATCC25923 se llevó a cabo como se describió anteriormente (Qin et al., 2014). Inicialmente, las células se lisaron usando lisostafina, lisozima y proteinasa K. Luego, el ARN se extrajo y se purificó usando RNeasy Mini Kit (Qiagen) de acuerdo con el protocolo recomendado por el fabricante. La calidad y la concentración del ARN se evaluaron usando el NanoDrop1000. Luego, el ARN se invirtió -transcrito a ADNc usando un kit de transcripción inversa (Thermo Fisher Scientific Inc., EE.UU.) de acuerdo con las instrucciones del fabricante.Brevemente, la qPCR se llevó a cabo de la siguiente manera: desnaturalización previa a 94 ° C durante 3 min, desnaturalización a 94 ° C durante 30 s, recocido a 52 ° C durante 30 s, alargamiento a 72 ° C durante 40 s, un total de 45 ciclos . Cada muestra tenía tres repeticiones técnicas y tres biológicas. El perfil transcripcional de cada uno de los cuatro genes de hemolisina y el gen rRNA 16s se determinó utilizando el método 2-ΔΔCt. El nivel de transcripción se determinó en relación con la expresión del gen ARNr 16s. Las secuencias de cuatro genes de hemolisina (hla, hlb, hlgC y hld) se recuperaron de la base de datos GenBank. Se utilizó el software Primer 5.0 para diseñar los cebadores (Tabla 1) y estos cebadores fueron sintetizados por Sangon Biotech Co., Ltd. (Shanghai, China).
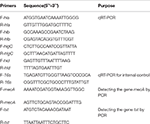
Tabla 1. Primarios utilizados en este estudio.
Se utilizó SPSS 17.0 para el análisis de datos. Los datos de medición se presentan como x̄ ± s. Se utilizó la prueba T para dos muestras independientes para comparar la expresión relativa de cada uno de los cuatro genes de hemolisina. La significancia estadística se definió como p < 0.05.
Detección de la expresión de α-hemolisina (Hla) por Western Blot
La concentración de la El SIHP y la cepa de referencia S. aureus ATCC25923 se ajustaron a 5,0 McFarland usando un turbidez. Luego se extrajo la proteína total de cada muestra, se ajustó a la misma concentración y se sometió a electroforesis en un gel SDS-PAGE. A continuación, las proteínas se transfirieron a una membrana de nitrocelulosa y la membrana se bloqueó con leche desnatada al 5% durante 1 h. Se añadieron anticuerpos policlonales de cabra anti-estafilocócica α-hemolisina (Abcam) a una concentración final de 2 μg / mL. Después, la mezcla de reacción se incubó a 4ºC durante la noche. Después de lavar la membrana, se añadieron anticuerpos IgG anti-cabra de conejo marcados con HRP diluidos 1: 1000 y se incubaron a 37ºC durante 2 h. Finalmente, se agregaron sustratos quimioluminiscentes para el desarrollo del color. Finalmente, se observó la expresión de α-hemolisina bajo el generador de imágenes.
Prueba de susceptibilidad antimicrobiana de SIHP
Se utilizó el método de dilución en caldo de microtitulación para realizar el cribado de susceptibilidad antimicrobiana. El procedimiento se realizó de acuerdo con el manual de funcionamiento del sistema de microbiología automatizado Phoenix-100. Los resultados de esta evaluación se interpretaron utilizando los criterios M100-S24 introducidos por el Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). El estado de S. aureus resistente a la meticilina (MRSA) se determinó utilizando la CIM (concentración mínima inhibitoria) de dos antibióticos. Para las cepas SIHP ≥4 μg / mL fue la CIM para oxalicina y ≥8 μg / mL fue la CIM para cefoxitina.
Detección de genes mecA y tst
Todos los 60 SIHP Se analizaron cepas para el gen de resistencia a fármacos mecA y el gen de virulencia tst. La extracción por ebullición del ADN genómico se llevó a cabo después de la lisis celular usando lisostafina. A continuación, se amplificaron los genes mecA y tst a partir del ADN genómico utilizando el kit DreamGreen Taq. Las condiciones de la PCR fueron las siguientes: desnaturalización previa a 94 ° C durante 3 min, desnaturalización a 94 ° C durante 30 s, hibridación a 50 ° C durante 30 s, extensión a 72 ° C durante 1 min. Los productos de la PCR fueron secuenciados y analizados por BLAST para validar que son los productos esperados. Las secuencias del gen mecA de resistencia a los fármacos y el gen de virulencia tst de S. aureus se recuperaron de la base de datos GenBank. Se utilizó el software Primer 5.0 para diseñar los cebadores (Tabla 1) y estos cebadores fueron sintetizados por Sangon Biotech Co., Ltd. (Shanghai, China).
Detección de la supervivencia de cepas de S. aureus SIHP en Macrófagos
Para comparar la supervivencia de cepas de S. aureus SIHP en macrófagos con la de cepas tst negativas de S. aureus SCHP, la línea celular de monocitos humanos THP-1 se mantuvo en RPMI-1640 que contenía 10% (v / v) FBS a 37 ° C en una atmósfera que contiene 5% (v / v) de CO2. Para la infección por macrófagos, se sembraron células THP-1 a razón de 5 x 105 células por pocillo en placas de cultivo de tejidos de 24 pocillos y se indujeron a diferenciarse con 12-miristato 13-acetato de forbol 10-7 M (PMA) durante 48 h. Aproximadamente 3×108 unidades formadoras de colonias (UFC) de bacterias en fase logarítmica (DO600 0,5-0,6) se sedimentaron mediante centrifugación, se lavaron dos veces con PBS y se resuspendieron en 1 ml de RPMI-1640. Luego se agregaron bacterias a la monocapa celular a una MOI de 20: 1 y se centrifugaron durante 5 min a 1000 rpm. Las células infectadas se incubaron durante 20 min a 37 ° C, luego se lavaron tres veces con PBS precalentado (pH 7,4) y se incubaron durante 1 h más en medio que contenía 100 μg / ml de gentamicina para matar las bacterias extracelulares. Las células se lavaron y lisaron para cuantificar la bacteria intracelular como muestra de tiempo cero (T0). Se recogieron células adicionales después de 12 o 24 h de incubación en presencia de medio de cultivo de tejidos suplementado fresco que contenía 12 µg / ml de gentamicina.El crecimiento de bacterias en células THP-1 se determinó dividiendo el número de bacterias intracelulares a las 12 ho 24 h por el número en el tiempo 0 (T12 / T0 o T24 / T0). El experimento se repitió de forma independiente tres veces.
Detección de la secreción de citocinas de macrófagos infectados por cepas de S. aureus SIHP
Los sobrenadantes de cultivo de macrófagos THP-1 infectados durante 12 h por bacterias se recogido. Los niveles de citocinas se midieron mediante citometría de flujo (BD) FACSCalibur utilizando un kit de citocinas CBA Human Thl / Th2 Cytokine II (BD) de acuerdo con las instrucciones del fabricante.
Tipificación y análisis de secuencias multilocus
Resultados
Fenotipo hemolítico de cepas SIHP en placas de sangre de agar de oveja
Como se muestra en las Figuras 1A, B, el anillo hemolítico completo (fenotipo β-hemolítico) se observó en el control S .aureus después de cultivar cepas en placas de agar sangre durante 24 h. Sin embargo, diferentes fenotipos hemolíticos (llamados aquí fenotipo hemolítico incompleto) se mostraron en las cepas SIHP. Además, el fenotipo hemolítico incompleto se pudo observar en las cepas SIHP que crecieron en diferentes ambientes condiciones que incluyen condiciones microaerófilas, aeróbicas y anaeróbicas respectivamente (Figuras 1C-E). Además, después de 10 pases en serie, este fenotipo hemolítico incompleto todavía se mantuvo (Figura 1F).
Relativo Niveles de expresión de ARNm de cuatro genes de hemolisina
Como se muestra en la Figura 2, los niveles de expresión de los cuatro genes de hemolisina hla, hlb, hlgC y hld en las cepas SCHP no mostraron diferencias estadísticamente significativas (p > 0,05) comparado con el de las cepas de control ATCC25923. Sin embargo, los niveles de expresión de hla, hlgC y hld en las cepas SIHP se suprimieron significativamente en 50, 16,7 y 8,3 veces respectivamente (p < 0,05) en comparación con el de las cepas de control ATCC25923 y las cepas SCHP, mientras que la expresión de hlb en las cepas de SIHP se incrementó significativamente 7.7 veces en comparación con los controles (p < 0.05).
Detección de α-hemolisina por Western Blot
La α-hemolisina codificada por El gen hla es una toxina formadora de poros secretada por S. aureus y su peso molecular es de 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). El análisis de transferencia Western mostró que la expresión de α-hemolisina en las cepas SIHP era 40 veces menor que la de las cepas SCHP y de control, lo que es consistente con los datos de qRT-PCR (Figura 3).

Figura 3. Western blot de α-hemolisina en S. aureus. ATCC29213: control de S. aureus con el fenotipo hemolítico completo; SCHP: S. aureus con el fenotipo hemolítico completo aislado de muestras clínicas en el mismo período; SIHP: S. aureus con un fenotipo hemolítico incompleto.
Resistencia a los medicamentos del SIHP
Se probó la susceptibilidad a los medicamentos el uso de diluciones de caldo de microtitulación demostró que los valores de MIC para oxacilina y cefoxitina eran todos > 2 y > 8 μg / ml respectivamente en 60 tinciones SIHP . De acuerdo con las pautas CLSI M100-S24, las 60 cepas SIHP se clasifican como cepas MRSA. La PCR también detectó el gen mecA en las 60 cepas.
Pruebas del gen tst
El gen tst es un factor de virulencia importante en S. aureus. La PCR mostró que las 50 cepas SIHP portaban genes tst.
La capacidad de supervivencia de las cepas SIHP de S. aureus en macrófagos es mayor que la de S. aureus tst negativo
Comparamos las capacidades de supervivencia intracelular de las cepas SIHP y la cepa SCHP tst negativa en macrófagos. Al contar el número de bacterias recuperadas de las placas, encontramos que la capacidad de supervivencia intracelular de la cepa SIHP era mucho mayor que la de la cepa S. aureus tst negativa después de macrófagos derivados de THP-1 infectados 12 o 24 h (Figura 4). De manera preliminar, especulamos que las cepas SIHP poseen una potencial alta virulencia, y se sugirió que se debería prestar más atención al SIHP en el hospital.
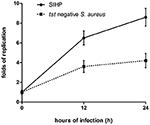
Figura 4. Supervivencia de cepas SIHP y S. aureus tst negativo en macrófagos derivados de THP-1. Después de que los macrófagos fueron infectados por bacterias durante 12 y 24 h, los macrófagos se lisaron y las bacterias intracelulares supervivientes se sembraron en placas de agar LB. Los pliegues de replicación de las bacterias supervivientes intracelulares se calcularon de acuerdo con el número de colonias en la placa de agar LB anterior.
Las diferencias de secreción de citocinas y quimiocinas de macrófagos infectados por cepas de S. aureus SIHP y S. aureus tst negativo
Comparar las diferencias de secreción de citocinas y quimiocinas en macrófagos derivados de THP-1 infectados por cepa SIHP y S. aureus tst negativo.aureus, detectamos citocinas proinflamatorias mediante citometría de flujo en el sobrenadante del cultivo de macrófagos infectados por cepas SIHP y cepa de S. aureus tst negativa. Los resultados mostraron una inducción significativamente mayor de IL-2, IL-6 e IL-17A en cepas SIHP, pero no por S. aureus tst negativo, lo que sugiere que las cepas SIHP inducen respuestas de citocinas / quimiocinas en los macrófagos (Figura 5). Las otras citocinas IL-4, IL-10, INF-γ y TNF secretadas por macrófagos no presentaron diferencias obvias entre las cepas SIHP y los grupos afectados por S. aureus tst negativo.
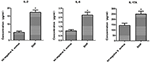
Figura 5. Detección de citocinas y quimiocinas secretadas por macrófagos infectados con S. aureus. * P < 0.05.
Escritura de secuencia de múltiples enfoques
Determinamos el genotipo multilocus de 60 aislamientos de SIHP recolectados de pacientes ingresados en nuestro hospital entre 2013 y 2014. Se aplicó el esquema de siete locus recomendado en la base de datos de S. aureus MLST. El análisis MLST mostró que todas las cepas SIHP se clasificaron en el clon ST5.
Discusión
La hemolisina es uno de los factores de virulencia más importantes para S. aureus (Wiseman, 1975). Los efectos combinados de cada uno de los cuatro tipos de hemolisina dan como resultado la destrucción de la membrana de los glóbulos rojos, lo que conduce a la formación del anillo hemolítico completamente transparente en las placas de agar sangre. En los últimos años, se encontraron SIHP en las muestras clínicas del segundo hospital afiliado de la Universidad de Soochow. En este estudio, buscamos identificar estas cepas y estudiar sus características en microbiología. Inicialmente, utilizamos diferentes placas de agar sangre de oveja comerciales o de preparación propia para aislar, incubar y pasar en serie las cepas. Demostramos que hay algunas cepas que exhiben y mantienen un fenotipo hemolítico incompleto incluso después de un subcultivo prolongado. Por tanto, se puede excluir la posibilidad de que este fenotipo sea inducido por factores no bacterianos. Nuestros estudios sugieren que SIHP podría ser un subconjunto de cepas únicas de S. aureus.
Estudios previos sugirieron que los glóbulos rojos de conejo son muy sensibles a la α-hemolisina (Hildebrand et al., 1991). Berube y col. informaron que el efecto de la α-hemolisina sobre la lisis de los glóbulos rojos depende de la concentración (Berube y Bubeck Wardenburg, 2013). La γ-hemolisina puede dañar los glóbulos rojos de humanos y animales (Kaneko y Kamio, 2004). Mientras que la δ-hemolisina daña los glóbulos rojos, solo en altas concentraciones, forma un poro transmembrana que lisa la membrana celular (Verdon et al., 2009). En este estudio, mostramos que la expresión de cuatro hemolisinas de cepas SIHP y cepas SCHP tiene perfiles de expresión transcripcional significativamente diferentes. La expresión de α-, γ-, δ-hemolisina en las cepas SIHP, que podrían dañar los glóbulos rojos directamente, es mucho menor que la de las cepas SCHP, mientras que la β-hemolisina tiene niveles de expresión mucho más altos en comparación con las cepas SCHP. Además, el nivel de expresión de la proteína de la α-hemolisina se validó adicionalmente mediante Western Blot. Se informó que la β-hemolisina aumenta predominantemente la sensibilidad de los glóbulos rojos a otras toxinas en lugar de lisar las células directamente, a menos que las células se cultiven a temperaturas más bajas (Vandenesch et al., 2012). En este estudio, se detectó la alta expresión de β-hemolisina en las cepas SIHP, pero el anillo hemolítico completo nunca se observó en las cepas SIHP incluso cuando se incubaron a 4 ° C. Estos resultados sugieren que el fenotipo incompleto observado de las cepas SIHP es muy probablemente los efectos de las cuatro hemolisinas que se expresan de una manera diferente en comparación con las cepas SCHP. Estudios previos han demostrado que durante la patogenia crónica, el efecto combinado de las presiones selectivas resultantes de los antibióticos, incluidos ciprofloxacino y trimetoprim, así como la respuesta inmune del huésped, pueden conducir a una mayor expresión de α-hemolisina, que es muy importante para la colonización de S .aureus en la mucosa, especialmente en infecciones del tracto respiratorio (Goerke et al., 2006; Huseby et al., 2010). En este estudio, todos los pacientes infectados con SIHP recibieron tratamiento a largo plazo con antibióticos de amplio espectro, si esta presión selectiva indujo la sobreexpresión de genes resistentes a los fármacos e interfirió con la expresión de los genes de hemolisina sigue siendo una posibilidad que necesita más
Para explorar las características microbiológicas del SIHP, realizamos pruebas de susceptibilidad antimicrobiana y elegimos el gen de virulencia tst que está asociado con la patogenicidad de S. aureus. Descubrimos que las 60 cepas de SIHP podían clasificarse como cepas de MRSA y portaban el gen mecA. Los resultados de las pruebas de sensibilidad a los antimicrobianos mostraron que incluso después de 10 pases, de estas 60 cepas SIHP, los valores de MIC de linezolid y teicoplanina de solo tres cepas SIHP han cambiado poco.Sin embargo, estos cambios en los valores de CMI no influyeron en la evaluación de los resultados de la susceptibilidad a los antimicrobianos. El gen de virulencia tst codifica la toxina del síndrome de choque tóxico (TSST-1) (Kreiswirth, 1989). Como superantígeno, TSST-1 mejora las respuestas de choque e inmunosupresión inducidas por endotoxinas (Kulhankova et al., 2014). Las pruebas de PCR encontraron que las 60 cepas de SIHP poseían el gen tst, lo que sugiere una mayor virulencia. Recientemente, muchos informes mostraron que S. aureus podría sobrevivir en los macrófagos humanos derivados de monocitos y estas cepas de S. aureus son más virulentas (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi y Bishayi, 2016). Por lo tanto, comparamos las capacidades de supervivencia intracelular de las cepas SIHP y las cepas SCHP que es tst negativo de S. aureus en macrófagos, y encontramos que la capacidad de supervivencia intracelular de la cepa SIHP era mucho mayor que la de la cepa tst negativa de S. aureus. Además, el análisis de los datos de los pacientes mostró que el efecto de la terapia antiinfecciosa en la mayoría de los pacientes infectados con cepas SIHP fue peor que el de pacientes similares infectados con cepas SCHP (datos no mostrados). Nuestro estudio proporciona evidencia experimental preliminar para la especulación de que las cepas SIHP poseen un potencial alto de virulencia.
Durante el proceso de infección de S. aureus invasivo, las moléculas asociadas a patógenos inician el sistema inmunológico innato que conduce a la activación y el reclutamiento. de neutrófilos y macrófagos y la producción de citocinas proinflamatorias, sobre todo TNF-α, IL-1β e IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016 ). Se informó que la secreción de citocinas inflamatorias IL-6 aumentaba con concentraciones crecientes de S. aureus (Chen et al., 2016). Además, el S. aureus superantigénico es particularmente eficaz para estimular la producción de IL-17 (Islander et al., 2010). En este estudio, las cepas SIHP mostraron una inducción significativamente mayor de IL-2, IL-6 e IL-17A de macrófagos en comparación con las cepas SCHP tst negativas, lo que sugiere que las cepas SIHP podrían inducir más secreción de citocinas contra el efecto destructor de los macrófagos. Además, el análisis MLST mostró que todas las cepas SIHP se clasificaron en el clon ST5. Además, estas cepas SIHP se agruparon en el tipo spa de t2460 (datos no mostrados).
En conjunto, SIHP puede ser un nuevo subconjunto de MRSA con potencial alta virulencia, y se debe prestar más atención en control y tratamiento de estas cepas en hospitales.
Contribuciones de los autores
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier o relaciones financieras que podrían interpretarse como un posible conflicto de intereses.
Agradecimientos
Este estudio fue apoyado por la Fundación Nacional de Ciencias Naturales de China (81572032, 81401636), la Fundación de Ciencias Naturales Foundation for Colleges and Universities in Jiangsu Province (16KJB320006), y el Programa de Ciencia y Tecnología de Suzhou (SYSD2014094, SYS201551, SS201638).
Clínica y de laboratorio Instituto de Normas (2014). Estándares de desempeño M100-S24 para pruebas de susceptibilidad antimicrobiana; Vigésimo cuarto suplemento informativo. Wayne, PA: CLSI.
Nandi, A. y Bishayi, B. (2016). Los Staphylococcus aureus que sobreviven intracelularmente después de la fagocitosis son más virulentos para inducir citotoxicidad en macrófagos peritoneales murinos frescos que utilizan TLR-2 como posible objetivo. Microb. Pathog. 97, 131-147. doi: 10.1016 / j.micpath.2016.06.007
Resumen de PubMed | CrossRef Texto completo | Google Académico
Wiseman, G. M. (1975). Las hemolisinas de Staphylococcus aureus. Bacteriol. Rev. 39, 317–344.
Resumen de PubMed | Google Académico