Frontiers in Immunology (Español)
Introducción
La preeclampsia es una enfermedad específica del embarazo que afecta del 3 al 5% de todos los embarazos (1, 2). Se manifiesta con hipertensión de nueva aparición después de las 20 semanas de gestación y proteinuria. La placenta es fundamental en la patogenia de la enfermedad al conectar a la madre con el feto (3). La interfaz materno-fetal es la zona donde el tejido genéticamente diferente de origen fetal se encuentra con la circulación materna, el endotelio y el sistema inmunológico. A menudo llamada la enfermedad de las teorías, una idea generalmente aceptada es que la preeclampsia afecta el endotelio materno y causa una alteración en la función del endotelio, lo que conduce a hipertensión y proteinuria (2). En su forma grave, la preeclampsia puede provocar retraso en el crecimiento fetal, prematurez y, para la madre, puede causar insuficiencia orgánica en los riñones y el hígado, así como eclampsia. Además, la preeclampsia puede tener consecuencias cardiovasculares adversas a largo plazo para la madre y el recién nacido (4). El desarrollo de la placenta se considera inadecuado específicamente en el proceso de transformación de la arteria espiral materna, donde las células trofoblásticas invaden el lado materno en decidua y transforman las arterias en conductos de baja resistencia, reemplazando también el endotelio materno (5-7). Por lo general, esta remodelación de las arterias uterinas está ausente o es incompleta, especialmente en la forma grave de preeclampsia. La alta resistencia en las arterias uterinas constreñidas provoca un flujo sanguíneo turbulento en el espacio intervelloso de la placenta que causa estrés oxidativo y daño mecánico a los árboles vellosos placentarios. El daño resultante aumenta la eliminación placentaria de micropartículas y mediadores inflamatorios, lo que resulta en una activación y disfunción endotelial generalizada (8, 9). Estos eventos secuenciales en la interfaz materno-fetal conducen a hipertensión materna y otros síntomas como se describió anteriormente.
El síndrome de HELLP fue caracterizado por primera vez en 1982 por Weinstein como un síndrome separado, que a menudo representa junto con la preeclampsia pero también se observa solo (10, 11). El síndrome HELLP se caracteriza por hemólisis, aumento de las enzimas hepáticas y plaquetas bajas. A menudo requiere observación a nivel de cuidados intensivos y terapia sintomática. La patogenia del síndrome aún está en la sombra. El síndrome de HELLP comparte características comunes con las microangiopatías trombóticas (MAT) como la púrpura trombocitopénica trombótica (PTT) y el síndrome urémico hemolítico (SUH). Las MAT se presentan en diversos grupos de enfermedades con características comunes de hemólisis microangiopática, trombocitopenia y daño orgánico como resultado de microtrombos. En la PTT, un defecto genético de, o como en la gran mayoría de los casos, autoanticuerpos adquiridos contra una desintegrina y metaloproteinasa con motivo 13 de trombospondina tipo 1 (ADAMTS13), la enzima que escinde el factor von Willebrand activado (vWF), causa la formación de inusualmente grandes multímeros vWF activados en células endoteliales que conducen a trombos plaquetarios en vasos pequeños y hemólisis. El SUH típico es causado por una infección bacteriana productora de toxina Shiga (especialmente Escherichia coli), mientras que el SUH atípico (aHUS) se refiere al tipo de MAT, en el que subyacen deficiencias genéticas en los reguladores de la vía alternativa del sistema del complemento, que, en presencia de de un desencadenante puede causar la enfermedad clínica (12, 13). El tratamiento aprobado por la FDA para el SHUa es la infusión de eculizumab, antagonista del complemento C5, que previene la formación del complejo de ataque a la membrana (MAC) (Figura 1). Clínicamente, HELLP comparte los mismos síntomas que las MAT clásicas: hemólisis, trombocitopenia y trastornos orgánicos observados en el hígado. Dependiendo de la clasificación de MAT utilizada, el síndrome HELLP generalmente se clasifica como parte de MAT secundarias o adquiridas (Tabla 1).
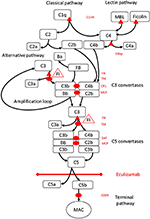
Figura 1. Eculizumab inhibe la vía terminal de activación del complemento. La activación del complemento puede iniciarse a través de tres vías de activación, que conducen todas a la formación de convertasas C5 que tienen la capacidad de activar la vía terminal que conduce a la formación del MAC en la superficie objetivo. Esta ilustración esquemática del sistema del complemento muestra sus activadores (en letra negra) e inhibidores (en rojo) más relevantes. Los activadores pueden estar unidos a la membrana (ovalados) o solubles (triángulo). La vía alternativa se activa espontáneamente en todas las superficies que no permiten la inhibición por el factor regulador soluble H (FH). FH actúa como cofactor para la inactivación de C3b a iC3b por el factor I (FI). Thrombomodulin (TM) mejora la actividad del cofactor FH. El factor B escindido (FB) junto con el activador C3b forma la vía alternativa convertasa, que tiene la capacidad de escindir C3 en C3b creando un bucle de amplificación de la activación de la vía alternativa.La ruta clásica de activación del complemento puede iniciarse, por ejemplo, mediante la unión de inmunocomplejos a C1q, mientras que la ruta de la lectina se activa mediante la unión de manosas a lectina (MBL) o ficolinas que se unen, por ejemplo, a patrones de carbohidratos en microbios. La activación de la ruta de la lectina da como resultado serina proteasas 1 y 2 asociadas a manosa (MASP-1 y MASP-2, no representadas) que escinden los componentes del complemento C4 y C2 para formar la ruta clásica convertasa C4bC2b. El inhibidor de C1 (C1inh) y C4bp son los reguladores solubles de la vía clásica, mientras que la proteína cofactor de membrana (MCP) y el receptor del complemento 1 (CR1) son reguladores unidos a la membrana de las vías tempranas del complemento. La formación de convertasas C5 inicia la vía terminal de activación del complemento y escisión de C5 en ausencia de reguladores de superficie ligados al factor de aceleración de la descomposición (DAF) y MCP. El ensamblaje de MAC está regulado por el regulador unido a la superficie CD59 (protectina). La escisión de C3 en las vías iniciales y C5 en la vía terminal libera anafilatoxinas C3a y C5a y produce inflamación. Eculizumab es un anticuerpo recombinante humanizado contra la proteína del complemento C5, que inhibe la escisión de C5 por las convertasas de C5, regulando así los efectos protrombóticos y proinflamatorios de la activación del complemento. El paciente descrito en este informe de caso fue examinado para detectar mutaciones genéticas en genes que codifican el factor H (CFH), FHR5 y MCP, CFI, CFB, THBD y ADAMTS13 (ADAMTS13), un regulador de la vía de vWF de la cascada de coagulación (no mostrado). Los resultados de las pruebas genéticas fueron negativos.

Tabla 1. Criterios de diagnóstico de HELLP y aHUS.
En este estudio de caso, informamos paciente con MAT complicada inducida por el embarazo y tratamiento exitoso.
Presentación del caso
Primigrávida de veintinueve años fue remitida a la edad gestacional 34 + 2 al hospital de la Universidad de Helsinki Clínica ambulatoria con dolor de estómago superior. Inicialmente, su presión arterial estaba moderadamente elevada (133/91 mmHg) y la tira reactiva urinaria era positiva para proteínas. El dolor de estómago superior informado inicialmente fue mejorando gradualmente. En la ecografía el feto tenía un perfil biofísico normal (BPP), la estimación del peso se encontraba en la curva de crecimiento de -2 DE. La cardiotocografía (CTG) fue normal. La hemoglobina (Hb) en sangre fue de 115 g / L, las plaquetas 158 E9 / L (rango normal 150-360 E9 / L), la alanina aminotransferasa (ALT) fue normal (23 U / L). La tira reactiva de orina fue positiva para proteínas (+2) y la proteinuria calculada fue de 1,6 g / 24 h. Se tomó la decisión de iniciar un tratamiento con cortisona para facilitar la maduración pulmonar del bebé. El paciente fue dado de alta con plan de regresar al día siguiente para revisión de control y segunda dosis de cortisona. Según lo programado, acudió al control en la semana 34 + 4 de gestación. La presión arterial fue de 147/87 mmHg, ALT 23, plaquetas 177, CTG y el BPP del feto en la ecografía fue normal. Fue dada de alta y se programó otro chequeo. En la tarde del mismo día, el dolor en la parte superior del estómago regresó y empeoró constantemente hacia la noche. Regresó al hospital a las 2.20 a.m. Sentía dolor en la parte superior del estómago, inquietud, había vomitado dos veces y sentía temblores. La presión arterial estaba claramente elevada a 170/94 mmHg, la tira reactiva de proteína en orina era muy positiva, la ALT estaba elevada a 159, la Hb 122 y las plaquetas a 172. Ingresó en la sala de prenatal. A las 4 a.m. ella estaba experimentando dolor de cabeza. Se inició medicación antihipertensiva (Labetalol 100 mg tres veces). La excreción de proteínas en orina alcanzó su punto máximo durante la noche siendo de 13 g / 24 h. Posteriormente, comenzó a vomitar, tenía dolor en la parte superior del estómago, dolor de cabeza y la monitorización CTG mostró desaceleraciones. La paciente fue trasladada a las 7.11 a.m. a la sala de partos y como el cuello uterino estaba dilatado tres centímetros, se rompieron artificialmente las membranas fetales para la inducción del parto. Al mismo tiempo, se completaron las pruebas de laboratorio con Hb 122, plaquetas 172. La lactato deshidrogenasa (LD), sin embargo, estaba claramente elevada a 1231 U / L en este momento. En el CTG continuaron las desaceleraciones y, a medida que continuaba la bradicardia, se realizó una cesárea de urgencia. El bebé varón (1960 g, -2 SD) nació a las 7.25 a.m. con un valor de pH de la arteria umbilical de 7.05, BE -6.80, Apgar 1/6/8. La pérdida de sangre en la operación fue de 400 ml.
A las 9 am después de la cesárea, las plaquetas de la madre estaban bajas a 49, con Hb de 102. Por la tarde, la ALT había aumentado a 1800, LD 3570 , el nivel de creatinina sérica fue 153 (μmol / L), mientras que las plaquetas disminuyeron a 33. Hubo una alteración en la coagulación indicada por un nivel bajo de fibrinógeno (1.1 g / L, valores de referencia 2-4 g / L) y un nivel alto de D -dímero de fibrina (30,2 mg / L, < 0,5 mg / L). Hubo algo de sangrado de la herida de la cesárea, en la que se colocaron suturas adicionales.En este momento, se administraron ocho unidades de plaquetas. El nivel de potasio aumentó de 4,7 a 5,6 (mmol / L). Se observó claramente hemólisis. La prueba de Coombs fue negativa. La excreción de orina fue de solo 10 ml / h. La prueba de laboratorio mostró claramente una enfermedad grave con signos de daño tanto en los riñones como en el hígado. Además, hubo alteración en el sistema de coagulación presentando coagulación significativa y fibrinólisis marcada simultáneamente. La infusión de sulfato de magnesio se inició debido a la hiperreflexia, que se considera un signo predictivo de convulsiones, una complicación grave de la preeclampsia. Se inició dexametasona intravenosa 10 mg y el paciente fue trasladado a la unidad de cuidados intensivos (UCI).
Además, se emitieron pruebas de laboratorio con fines de diagnóstico diferencial de otras emergencias médicas (Tabla 2). La actividad de ADAMTS13 fue normal en 62% (40-130%), lo que excluye TTP. Los niveles de complemento sérico C3 (0.52 g / L, 0.71–1.41 g / L) y C4 (0.07 g / L, 0.12–0.34 g / L) fueron bajos. El nivel de complejo terminal soluble del complemento (C5b-9, 971 ng / ml, < 366 ng / ml) se elevó el primer día posparto. No se detectaron anticuerpos antifosfolípidos, la serología de la infección de Hepatitis B y C y VIH fue negativa. De la muestra de heces, los patógenos que causan el SUH típico dieron negativo.

Tabla 2. Cronología del diagnóstico y tratamiento de la enfermedad.
La paciente fue tratada con tratamiento de recambio plasmático el primer y segundo día posparto y fue hemodializada en total tres veces durante el transcurso de su tratamiento (días 2, 4 y 6 posparto).
En el tercer día posparto, la paciente estaba estable y fue trasladada de regreso a la sala de recuperación del Hospital de Mujeres donde se observó y se continuó la terapia sintomática. La hipertensión se trató con amlodipino 10 mg dos veces al día y Labetalol 200 mg tres veces al día. Al cuarto día posparto, las plaquetas continuaron disminuyendo y la paciente fue diagnosticada con SHUa. A menudo el diagnóstico diferencial con síndrome HELLP El SHUa radica en la recuperación espontánea de las pacientes HELLP generalmente al tercer día posparto. Se inició tratamiento con eculizumab (900 mg IV). Pati El paciente recibió una vacuna antineumocócica y se inició antibiótico profiláctico (penicilina). La paciente recibió en total cuatro dosis semanales de eculizumab (900 mg) y comenzó a recuperarse rápidamente. No requirió más hemodiálisis después de su tercera hemodiálisis en el sexto día posparto (Figura 2). La función renal se corrigió gradualmente, se elevó el recuento de plaquetas y se resolvió la hemólisis. Cuatro semanas después del parto, se normalizaron los niveles plasmáticos de C3 y C4.
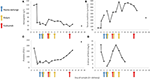
Figura 2. Valores de laboratorio seleccionados observados durante las primeras etapas de la enfermedad y el momento del recambio plasmático, hemodiálisis y administración de eculizumab. En el panel (A) se representa el desarrollo de las mediciones de hemoglobina en sangre, en el panel (B) el nivel de creatinina sérica, en el panel (C) el número de plaquetas y en el panel (D) dímero D de los valores de fibrina a lo largo de los 17 días. período de seguimiento.
En las pruebas genéticas, no se identificaron polimorfismos genéticos conocidos. Se le hizo la prueba de mutaciones en los reguladores del complemento Factor H (CFH), proteína relacionada con el factor H 5 (FHR5) y proteína del cofactor de membrana (MCP), factor I del inactivador de la vía alternativa del complemento (CFI), factor activador de la vía alternativa B (CFB). ) y los siguientes componentes de la cascada de la coagulación: ADAMTS13, trombomodulina (THBD) y una enzima intracelular, diacilglicerol quinasa E (DGKE), cuyas mutaciones son causas conocidas de SHUa (14). Además, tampoco se detectaron anticuerpos contra el factor H. No se detectó deficiencia de C4.
Como resumen, nuestra paciente tenía preeclampsia severa y cumplía los criterios de diagnóstico para el síndrome HELLP. Aunque las pruebas genéticas para SHUa siguieron siendo negativas, el curso clínico de la enfermedad (especialmente, lesión renal aguda grave) y la respuesta al tratamiento (especialmente, eculizumab) sugirieron que nuestra paciente tenía SHUa inducida por el embarazo.
Discusión
La primigrávida descrita anteriormente fue diagnosticada con preeclampsia grave, síndrome HELLP y SHUa inducido por el embarazo. No se descubrieron mutaciones genéticas conocidas que pudieran predisponer al SHUa. Es importante el diagnóstico diferencial entre los tipos de MAT, PTT, SUH / SUHa y MAT secundarias como el síndrome HELLP. Especialmente la PTT debe identificarse desde el principio, ya que la enfermedad se trata con plasmaféresis diario rápido hasta la remisión (15).
En la actualidad, los métodos de análisis de laboratorio para probar mutaciones genéticas que pueden causar SHUa pueden mostrar mutaciones en sólo hasta el 40-60% de los casos de SHUa, dejando la posibilidad de casos falsos negativos. Por lo tanto, un resultado negativo de la prueba para mutaciones no descarta un SHUa verdadero (16).Rara vez se ha inducido SHUa después del embarazo y el parto. En estos casos, durante los siguientes tres años, ~ 50% desarrolló enfermedad renal crónica (ERC), algunos incluso enfermedad renal en etapa terminal (ERC). Cuando se observaron mutaciones genéticas, hasta un 85% pueden desarrollar ERC o ERT (17).
En general, se acepta que en los trastornos hipertensivos del embarazo, la inflamación placentaria da como resultado una disfunción endotelial. Si se altera la integridad del endotelio, se produce la activación del complemento y la coagulación (18). También se ha planteado la hipótesis de que la alteración del endotelio materno contribuye a la morbilidad materna posterior asociada con la preeclampsia grave y otros trastornos hipertensivos del embarazo (2, 19). Se ha demostrado que el endotelio dañado funciona de manera anormal incluso años después de que desaparezcan los síntomas de diagnóstico inicial (20-23).
En hasta el 46% de los pacientes HELLP, se han descrito mutaciones genéticas en los reguladores de la vía alternativa del sistema del complemento (24, 25). En las primeras etapas del embarazo, cuando la placenta se está desarrollando, se observa activación del sistema del complemento en niveles elevados de Bb en el suero en pacientes que posteriormente desarrollaron preeclampsia (26). Se ha observado activación del sistema del complemento en la preeclampsia grave y el síndrome HELLP, y se han detectado niveles elevados de complejo terminal (C5b-9) en la orina de pacientes con preeclampsia grave. En pacientes con síndrome HELLP, se demostró una mayor activación del sistema del complemento mediante pruebas funcionales y, además, por deficiencias de expresión en CD55 y CD59, lo que llevó a una disminución de la regulación y a una activación exacerbada del sistema del complemento (27-29).
Hay muchas similitudes entre el síndrome HELLP y el SHUa. En ambas condiciones, la alteración del endotelio está claramente involucrada seguida por la activación del complemento y la coagulación. En la preeclampsia grave y el síndrome HELLP, el eculizumab administrado en los primeros signos de enfermedad grave y MAT sería beneficioso para la protección de los riñones y el endotelio materno (30). Preservar la integridad endotelial puede proteger potencialmente al paciente de riesgos para la salud a largo plazo, como enfermedades cardiovasculares. Por lo general, en las MAT relacionadas con el embarazo, los hallazgos clínicos de hemólisis y trombocitopenia se resuelven en aproximadamente tres días. Si la actividad de la enfermedad dura más, se continuará con el diagnóstico diferencial y solo entonces se considerará un tratamiento alternativo (p. Ej., Eculizumab). La introducción temprana del tratamiento con eculizumab beneficiaría a las mujeres al prevenir el daño renal y minimizar la turbulencia en el endotelio y la inflamación sistémica. Eculizumab, administrado lo suficientemente temprano y tan solo una o dos dosis, posiblemente podría ser suficiente para detener la turbulencia y ser suficiente para detener la cascada de eventos (31). Por un lado, el eculizumab es un medicamento muy caro, pero por otro, el coste del tratamiento de cuidados intensivos, recambio plasmático, hemodiálisis, posible trasplante de riñón, sin mencionar las consecuencias emocionales para las madres y las familias siguen siendo inestimables.
Como conclusión, nuestro paciente se encontraba gravemente enfermo, presentando hemólisis, alteración de la coagulación, daño hepático e insuficiencia renal que requirió ingreso en UCI y hemodiálisis. Es posible que el eculizumab, si se inició antes, ante los primeros signos del síndrome HELLP, podría haber sido beneficioso durante el curso posterior de la enfermedad, mitigando potencialmente la lesión renal y evitando así la necesidad de hemodiálisis y ERC posterior. Por lo tanto, en esta era de la medicina inmunológica moderna, ¿podríamos hacer más por las madres y las familias que simplemente esperar y esperar lo mejor?
Declaración de ética
La revisión y aprobación éticas no fueron necesarios para el estudio de participantes humanos de acuerdo con la legislación local y los requisitos institucionales. Los pacientes / participantes proporcionaron su consentimiento informado por escrito para participar en este estudio.
Contribuciones de los autores
AL y JH-E desarrollaron la idea del manuscrito y redactaron el manuscrito. JH-E y MH participaron en la atención diagnóstica y terapéutica del paciente. Todos los autores revisaron y editaron el manuscrito y aprobaron su versión final para su publicación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que podría interpretarse como un posible conflicto de intereses.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Resultados adversos del embarazo y futura enfermedad cardiovascular materna. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
Resumen de PubMed | CrossRef Texto completo | Google Académico
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The » grandes síndromes obstétricos ”están asociados con trastornos de la placentación profunda. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
Resumen de PubMed | CrossRef Texto completo | Google Académico
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Cebado inflamatorio sistémico en el embarazo normal y preeclampsia: el papel de las micropartículas de sincitiotrofoblasto circulantes. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
Resumen de PubMed | CrossRef Texto completo | Google Académico
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Actualización de vesículas extracelulares derivadas de sincitiotrofoblasto en embarazo normal y preeclampsia. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
Resumen de PubMed | CrossRef Texto completo | Google Académico
10. Síndrome de Weinstein L. de hemólisis, enzimas hepáticas elevadas y plaquetas bajas recuento: una consecuencia grave de la hipertensión durante el embarazo. Soy J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
Resumen de PubMed | CrossRef Texto completo | Google Académico
15. Pourrat O, Coudroy R, Pierre F. Diferenciación entre el síndrome HELLP grave y microangiopatía trombótica, púrpura trombocitopénica trombótica y otros imitadores. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
Resumen de PubMed | CrossRef Texto completo | Google Académico
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Deterioro de la función endotelial en mujeres con antecedentes de preeclampsia: un indicador de riesgo cardiovascular. Am J Physiol Hear Circ Physiol. (2004) 286: 1-3. doi: 10.1152 / ajpheart.00298.2003
Resumen de PubMed | CrossRef Texto completo | Google Académico
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Personal AC. La función endotelial y los biomarcadores circulantes se alteran en mujeres y niños después de la preeclampsia. Hipertensión. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
Resumen de PubMed | CrossRef Texto completo | Google Académico
23. Stanhewicz AE. Disfunción vascular residual en mujeres con antecedentes de preeclampsia. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
Resumen de PubMed | CrossRef Texto completo | Google Académico
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et al. Las mutaciones de la línea germinal en la vía alternativa del complemento predisponen al síndrome HELLP. Conocimiento de la JCI. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
Resumen de PubMed | CrossRef Texto completo | Google Académico
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, un nuevo tratamiento potencial para la lesión renal aguda asociada con la preeclampsia / síndrome HELLP. Representante de caso BMJ (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
Resumen de PubMed | CrossRef Texto completo | Google Académico