Geología física
La gran mayoría de los minerales que forman las rocas de la corteza terrestre son minerales de silicato. Estos incluyen minerales como cuarzo, feldespato, mica, anfíbol, piroxeno, olivino y una gran variedad de minerales arcillosos. El bloque de construcción de todos estos minerales es el tetraedro de sílice, una combinación de cuatro átomos de oxígeno y un átomo de silicio. Estos están dispuestos de manera que los planos dibujados a través de los átomos de oxígeno formen un tetraedro (Figura 2.6). Dado que el ión de silicio tiene una carga de +4 y cada uno de los cuatro iones de oxígeno tiene una carga de -2, el tetraedro de sílice tiene una carga neta de -4.
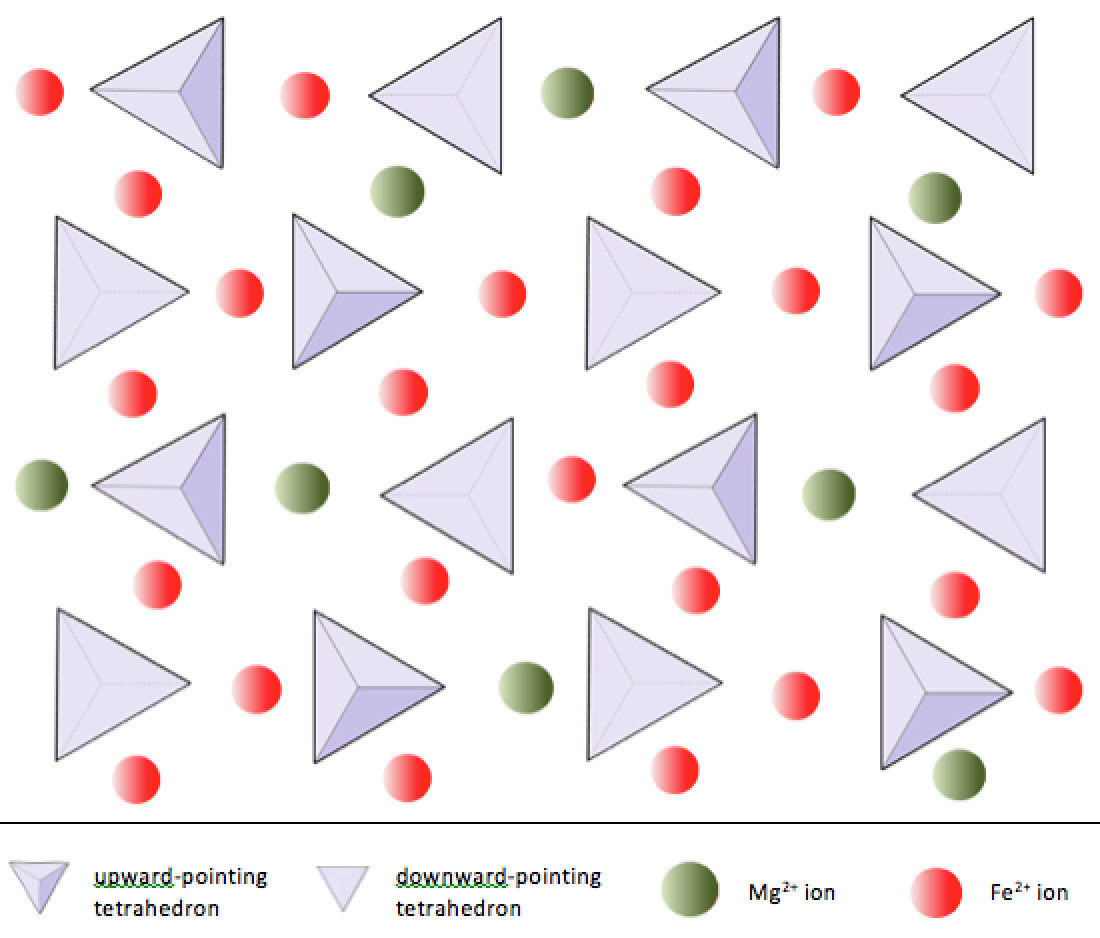
En los minerales de silicato, estos tetraedros están ordenados y vinculados entre sí de diversas formas, desde unidades individuales hasta marcos complejos (Figura 2.9). La estructura de silicato más simple, la del mineral olivino, está compuesta de tetraedros aislados unidos a iones de hierro y / o magnesio. En el olivino, la carga -4 de cada tetraedro de sílice está equilibrada por dos cationes divalentes (es decir, +2) de hierro o magnesio. El olivino puede ser Mg2SiO4 o Fe2SiO4, o alguna combinación de los dos (Mg, Fe) 2SiO4. Los cationes divalentes de magnesio y hierro tienen un radio bastante cercano (0,73 frente a 0,62 angstroms). Debido a esta similitud de tamaño, y debido a que ambos son cationes divalentes (ambos tienen una carga de +2), el hierro y el magnesio pueden reemplazarse fácilmente en olivino y en muchos otros minerales.
| Configuración del tetraedro | Minerales de ejemplo | |
|---|---|---|
 |
Aislado (nesosilicatos) | Olivino, granate, circón, cianita |
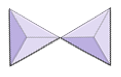 |
Pares (sorosilicatos) | Epidota, zoisita |
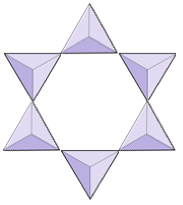 |
Anillos (ciclosilicatos) | Turmalina |
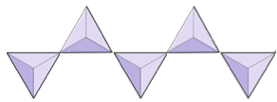 |
Cadenas simples (inosilicatos) | Piroxenos, wollastonita |
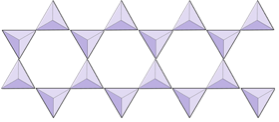 |
Cadenas dobles (inosilicatos) | Anfíboles |
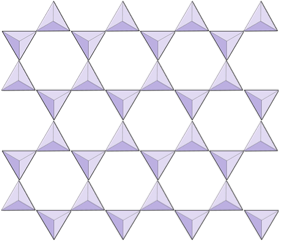 |
Láminas (filosilicatos) | Micas, minerales arcillosos, serpentina, clorita |
| tridimensional estructura | Estructura (tectosilicatos) | Feldespatos, cuarzo, zeolita |
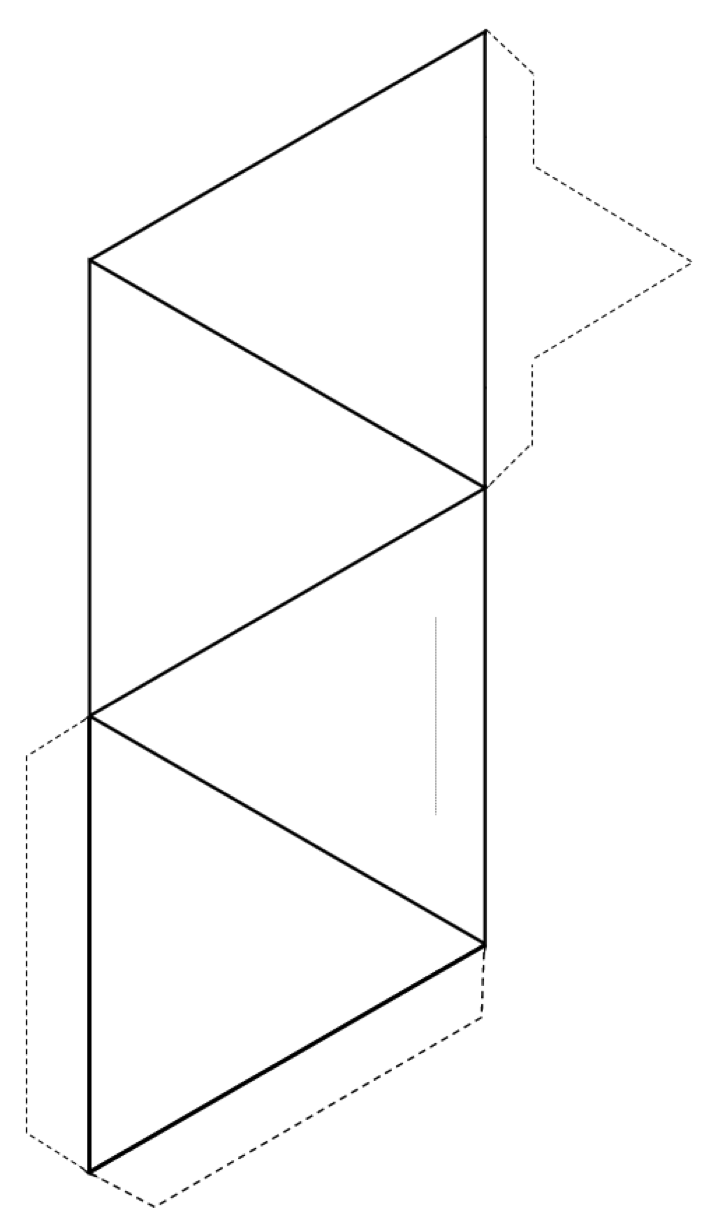
Ejercicio 2.3 Hacer un tetraedro
Corta alrededor de la parte exterior de la forma (líneas continuas y líneas de puntos), y luego dobla a lo largo de las líneas continuas para formar un tetraedro.
Si tienes pegamento o cinta adhesiva, asegura el pestañas al tetraedro para mantenerlo unido. Si no tiene pegamento o cinta adhesiva, haga una rebanada a lo largo de la delgada línea gris e inserte la pestaña puntiaguda en la ranura.
Si está haciendo esto en un salón de clases, intente unir su tetraedro con otros en pares, anillos, cadenas simples y dobles, láminas e incluso estructuras tridimensionales.
En el olivino, a diferencia de la mayoría de los otros minerales de silicato, los tetraedros de sílice no están unidos a cada uno otro. Sin embargo, están unidos al hierro y / o magnesio como se muestra en la Figura 2.10.
Como ya se señaló, los iones +2 de hierro y magnesio son similares en tamaño (aunque no exactamente iguales). Esto les permite sustituirse entre sí en algunos minerales de silicato. De hecho, los iones comunes en los minerales de silicato tienen una amplia gama de tamaños, como se muestra en la Figura 2.11. Todos los iones que se muestran son cationes, excepto el oxígeno. Tenga en cuenta que el hierro puede existir como ion +2 (si pierde dos electrones durante la ionización) o como ion +3 (si pierde tres). El Fe2 + se conoce como hierro ferroso. Fe3 + se conoce como hierro férrico. Los radios iónicos son fundamentales para la composición de los minerales de silicato, por lo que volveremos a consultar este diagrama.

La estructura de la cadena simple El piroxeno de silicato se muestra en las Figuras 2.12 y 2.13. En el piroxeno, los tetraedros de sílice están unidos en una sola cadena, donde un ión de oxígeno de cada tetraedro se comparte con el tetraedro adyacente, por lo que hay menos oxígenos en la estructura.El resultado es que la proporción de oxígeno a silicio es menor que en el olivino (3: 1 en lugar de 4: 1), y la carga neta por átomo de silicio es menor (–2 en lugar de –4), ya que se necesitan menos cationes para equilibrar ese cargo. Las composiciones de piroxeno son del tipo MgSiO3, FeSiO3 y CaSiO3, o alguna combinación de estos. El piroxeno también se puede escribir como (Mg, Fe, Ca) SiO3, donde los elementos entre paréntesis pueden estar presentes en cualquier proporción. En otras palabras, el piroxeno tiene un catión por cada tetraedro de sílice (p. Ej., MgSiO3) mientras que el olivino tiene dos (p. Ej., Mg2SiO4). Como cada ión de silicio es +4 y cada ión de oxígeno es –2, los tres oxígenos (–6) y el silicio (+4) dan una carga neta de –2 para la cadena simple de tetraedros de sílice. En el piroxeno, el catión divalente (2+) por tetraedro equilibra esa carga -2. En el olivino, se necesitan dos cationes divalentes para equilibrar la carga -4 de un tetraedro aislado.
La estructura del piroxeno es más «permisiva» que la del olivino, lo que significa que los cationes con un rango más amplio de radios iónicos puede caber en él. Por eso los piroxenos pueden tener cationes de hierro (radio 0,63 Å) o magnesio (radio 0,72 Å) o calcio (radio 1,00 Å).
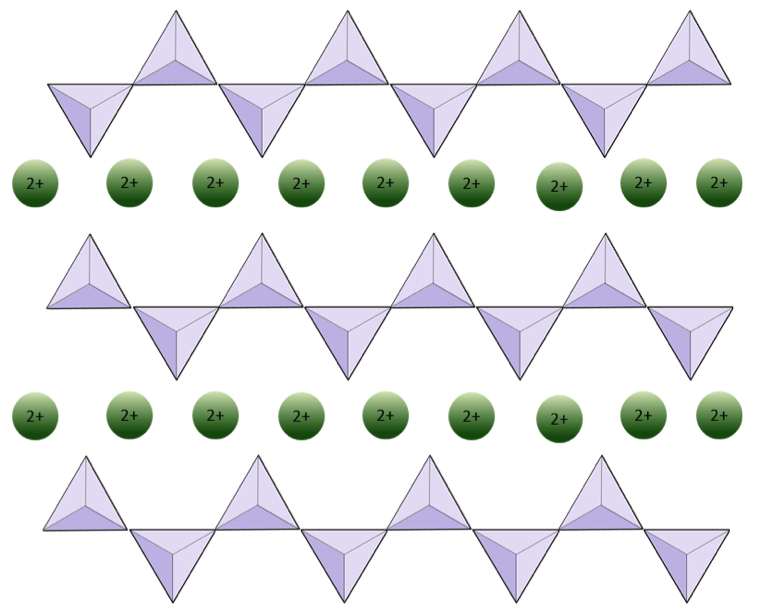
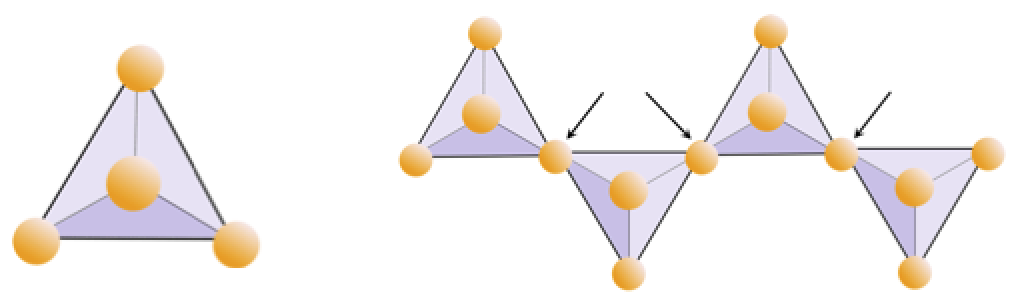
Ejercicio 2.4 Privación de oxígeno
El siguiente diagrama representa una sola cadena en un mineral de silicato. Cuente el número de tetraedros frente al número de iones de oxígeno (esferas amarillas). Cada tetraedro tiene un ión de silicio, por lo que debería dar la proporción de Si a O en los silicatos de cadena sencilla (p. Ej., Piroxeno).
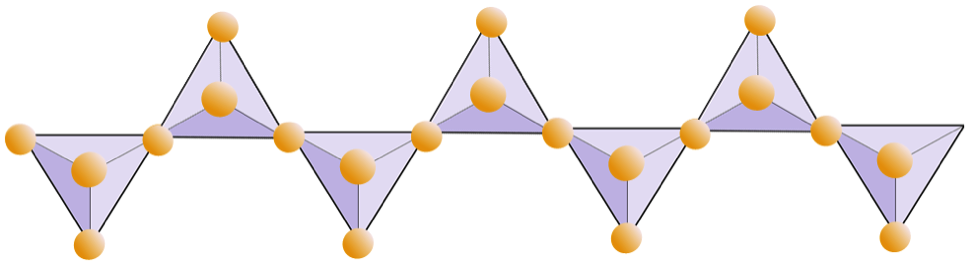
El siguiente diagrama representa una cadena doble en un mineral de silicato. Nuevamente, cuente el número de tetraedros frente al número de iones de oxígeno. Esto debería darle la proporción de Si a O en silicatos de doble cadena (por ejemplo, anfíbol).
En las estructuras de anfíboles, los tetraedros de sílice están unidos en una cadena doble que tiene una relación de oxígeno a silicio más baja que la del piroxeno y, por lo tanto, se necesitan aún menos cationes para equilibrar la carga. El anfíbol es incluso más permisivo que el piroxeno y sus composiciones pueden ser muy complejas. La hornblenda, por ejemplo, puede incluir sodio, potasio, calcio, magnesio, hierro, aluminio, silicio, oxígeno, flúor y el ion hidroxilo (OH–).
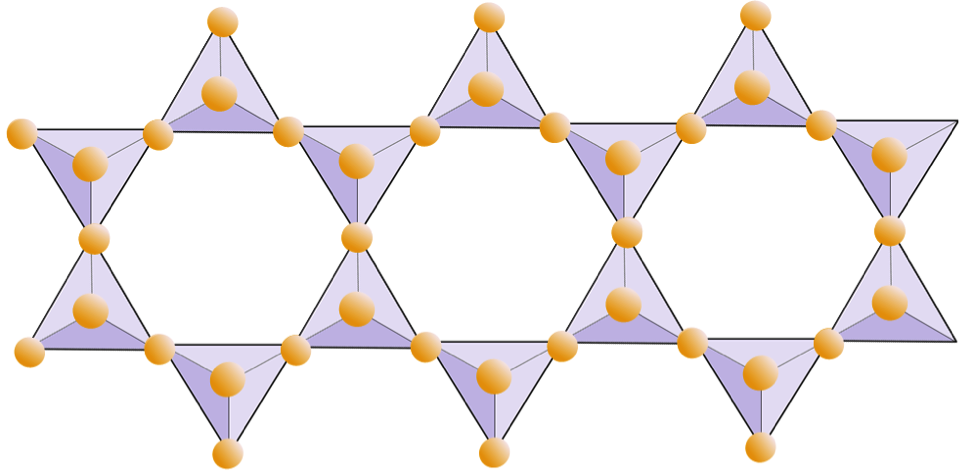
En las estructuras de mica, el Los tetraedros de sílice están dispuestos en láminas continuas, donde cada tetraedro comparte tres aniones de oxígeno con tetraedros adyacentes. Hay incluso más intercambio de oxígenos entre tetraedros adyacentes y, por lo tanto, se necesitan menos cationes de equilibrio de carga para los minerales de silicato en láminas. La unión entre hojas es relativamente débil, y esto explica la división unidireccional bien desarrollada (Figura 2.14). La mica biotita puede tener hierro y / o magnesio y eso la convierte en un mineral de silicato ferromagnesiano (como olivino, piroxeno y anfíbol). La clorita es otro mineral similar que comúnmente incluye magnesio. En la mica moscovita, los únicos cationes presentes son el aluminio y el potasio; por lo tanto, es un mineral de silicato no ferromagnesiano.

Además de moscovita, biotita y clorita, hay muchos otros silicatos laminares (o filosilicatos) que generalmente existen como fragmentos del tamaño de arcilla (es decir, menos de 0,004 mm). Estos incluyen los minerales arcillosos caolinita, illita y esmectita, y aunque son difíciles de estudiar debido a su tamaño muy pequeño, son componentes extremadamente importantes de las rocas y especialmente de los suelos.
Todo el silicato laminar los minerales también tienen agua en su estructura.
Los tetraedros de sílice están unidos en estructuras tridimensionales tanto en los feldespatos como en el cuarzo. Estos son minerales no ferromagnesianos, no contienen hierro ni magnesio.Además de los tetraedros de sílice, los feldespatos incluyen los cationes aluminio, potasio, sodio y calcio en varias combinaciones. El cuarzo contiene solo tetraedros de sílice.
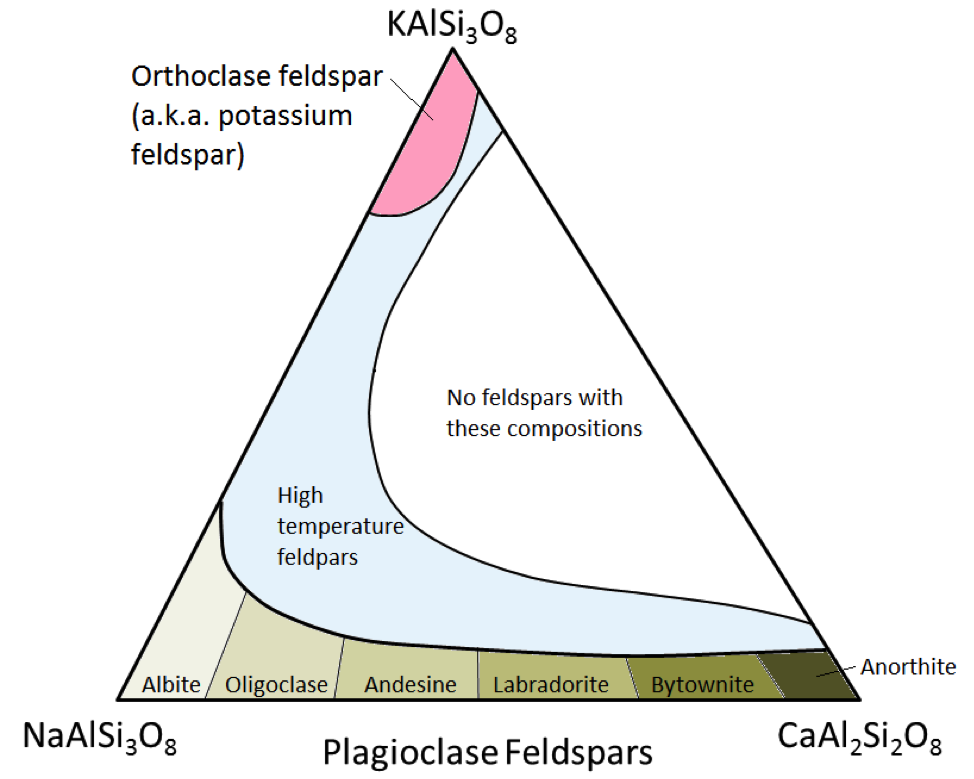
Los tres principales minerales de feldespato son el feldespato de potasio (también conocido como feldespato K o K-spar) y dos tipos de feldespato plagioclasa: albita (solo sodio) y anortita (solo calcio) . Como es el caso del hierro y el magnesio en el olivino, existe un rango continuo de composiciones (series de soluciones sólidas) entre la albita y la anortita en la plagioclasa. Esto se debe a que los iones de calcio y sodio son casi idénticos en tamaño (1,00 Å frente a 0,99 Å). Puede existir cualquier composición intermedia entre CaAl2Si3O8 y NaAlSi3O8 (Figura 2.15). Esto es un poco sorprendente porque, aunque son muy similares en tamaño, los iones de calcio y sodio no tienen la misma carga (Ca2 + versus Na +). Este problema se explica por la correspondiente sustitución de Al3 + por Si4 +. Por tanto, la albita es NaAlSi3O8 (un Al y tres Si) mientras que la anortita es CaAl2Si2O8 (dos Al y dos Si), y los feldespatos de plagioclasa de composición intermedia tienen proporciones intermedias de Al y Si. Esto se denomina «sustitución acoplada».
Los feldespatos de plagioclasa de composición intermedia son oligoclasa (10% a 30% Ca), andesina (30% a 50% Ca), labradorita (50% a 70% % Ca) y bytownita (70% a 90% Ca). El feldespato K (KAlSi3O8) tiene una estructura ligeramente diferente a la de la plagioclasa, debido al mayor tamaño del ion potasio (1,37 Å) y debido a este gran tamaño , el potasio y el sodio no se sustituyen fácilmente entre sí, excepto a altas temperaturas. Es probable que estos feldespatos de alta temperatura se encuentren solo en rocas volcánicas porque las rocas ígneas intrusivas se enfrían lo suficientemente lento a bajas temperaturas para que los feldespatos se conviertan en uno de los formas de temperatura más baja.
En cuarzo (SiO2), los tetraedros de sílice están unidos en un marco tridimensional «perfecto». Cada tetraedro está unido a otros cuatro tetraedros (con un oxígeno compartido en cada esquina de cada tetraedro) y, como resultado, la proporción de silicio a oxígeno es 1: 2. Dado que un catión de silicio tiene una carga de +4 y los dos aniones de oxígeno tienen cada uno una carga de -2, la carga está equilibrada. No es necesario el aluminio ni ninguno de los otros cationes como el sodio o el potasio. La dureza y la falta de escisión en el cuarzo son el resultado de los fuertes enlaces covalentes / iónicos característicos del tetraedro de sílice.
Ejercicio 2.5 ¿Silicatos ferromagnesianos?
Los minerales de silicato se clasifican como ferromagnesianos o no ferromagnesianos dependiendo de si tienen o no hierro (Fe) y / o magnesio (Mg) en su fórmula. A continuación se enumeran varios minerales y sus fórmulas. Para cada uno, indique si es o no un silicato ferromagnesiano.
| Mineral | Fórmula | ¿Silicato ferromagnesiano? |
|---|---|---|
| olivino | (Mg, Fe) 2SiO4 | |
| pirita | FeS2 | |
| plagioclasa | CaAl2Si2O8 | |
| piroxeno | MgSiO3 | |
| hematita | Fe2O3 | |
| ortoclasa | KAlSi3O8 | |
| cuarzo | SiO2 |
| Mineral | Fórmula * | ¿Silicato ferromagnesiano? |
|---|---|---|
| anfíbol | Fe7Si8O22 (OH) 2 | |
| moscovita | K2Al4 Si6Al2O20 (OH) 4 | |
| magnetita | Fe3O4 | |
| biotita | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomita | (Ca, Mg) CO3 | |
| granate | Fe2Al2Si3O12 | |
| serpentina | Mg3Si2O5 (OH) 4 |
* Algunas de las fórmulas, especialmente las más complicadas, se han simplificado.
- Un angstrom es la unidad comúnmente utilizada para la expresión de -Dimensiones de escala. Un angstrom es de 10 a 10 mo 0,0000000001 m. El símbolo de un angstrom es Å. ↵