| Política | Permiso Investigación en gastroenterología
Previsibilidad de la metaplasia intestinal gástrica por eritema moteado en parches visto en endoscopia
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
aDepartment of Gastroenterology and Hepatology, National Center for Global Health and Medicine (NCGM), Tokio, Japón
bDepartamento de Investigación Clínica e Informática Centro Internacional de Investigación Clínica Instituto de Investigación, NCGM, Tokio, Japón
cDivisión de Medicina Interna, Facultad de Medicina de la Universidad de Kosin, Busan, Corea
dDepartamento de Gastroenterología y Hepatología, Universidad Médica de Wakayama, Wakayama, Japón
eDepartment of Clinical Laboratory Patological Division, NCGM, Tokio, Japón
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japan
gAutor para correspondencia: Naoyoshi Nagata, Department of GRAMO astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokio 162-8655, Japón
Manuscrito aceptado para su publicación el 26 de septiembre de 2011
Título corto: Diagnóstico endoscópico de metaplasia intestinal
doi: https://doi.org/10.4021/gr357w
- Resumen
- Introducción
- Métodos
- Resultados
- Discusión
| Resumen | ▴Top |
Antecedentes: la metaplasia intestinal (MI) se considera una lesión premaligna. Sin embargo, el diagnóstico endoscópico de MI se ha considerado difícil. Mediante la endoscopia, encontramos un patrón único de eritema, «Eritema parcheado moteado (MPE)», que incluye MI grave. La infección por Helicobacter pylori (Hp) en sí misma puede causar eritema, que refleja cambios histológicos en la mucosa gástrica. Por lo tanto, inscribimos la erradicación de Hp pacientes para validar la relación entre MPE y hallazgos patológicos.
Métodos: Inscribimos a pacientes con gastritis crónica que se sometieron a una erradicación exitosa de Hp al menos 6 meses antes del estudio. Definimos MPE como múltiples lesiones eritematosas planas o deprimidas. Cuando encontramos un MPE en la endoscopia, realizamos una biopsia tanto en el sitio MPE como en el sitio no MPE. El sitio no MPE se definió como una mucosa adyacente ubicada dentro de los 3 cm del sitio MPE. Todas las muestras de biopsia se evaluaron inmunohistoquímicamente para el subtipo de MI utilizando Tinciones MUC2, MUC5AC, MUC6, CD10 y CDX2. El grado de MI se definió de acuerdo con el Sistema Sydney actualizado. Se calculó la precisión diagnóstica de los hallazgos de MPE para MI patológica. También se evaluó la relación entre el MPE y el subtipo IM.
Resultados: Se seleccionaron un total de 102 pacientes para el estudio. De estos, 55 (54%) pacientes tenían MPE. Se tomaron muestras de biopsia de los sitios MPE y de los sitios no MPE de estos 55 pacientes. Los porcentajes de IM y las puntuaciones medias de IM fueron significativamente más altos en los sitios de MPE (P < 0,001) que en los sitios sin MPE. La sensibilidad y la especificidad para MPE en la detección de MI histológica fueron 72,7% y 84,1%, respectivamente. No se observaron asociaciones significativas en la expresión de MUC2, MUC5AC, MUC6, CD10 y CDX2 entre los sitios MPE y los sitios no MPE. No hubo diferencias significativas en las proporciones (completa / incompleta) de subtipos de MI entre los dos grupos.
Conclusiones: El MPE es un hallazgo endoscópico útil para detectar MI histológica sin el uso de cromoendoscopia y endoscopia con aumento. Sin embargo, el subtipo de MI es difícil de identificar. En la era de la erradicación del Hp, el MPE tiene el potencial de convertirse en un hallazgo predictivo del riesgo de cáncer gástrico.
Palabras clave: metaplasia intestinal; Lesión premaligna; Hallazgo endoscópico; Eritema; Endoscopia de luz blanca; Subtipo, erradicación; Helicobacter pylori
| Introducción | ▴Top |
Se cree que el desarrollo del cáncer gástrico implica un proceso de varios pasos, que incluye infección por Helicobacter pylori (Hp), gastritis crónica, atrofia glandular, metaplasia intestinal (como primario) y finalmente displasia. La MI y la atrofia gástrica se consideran juntas como factores de riesgo para el desarrollo de cáncer gástrico de tipo intestinal y se consideran lesiones premalignas.La atrofia gástrica puede reconocerse por endoscopia y se correlaciona con la evaluación histológica. Sin embargo, el diagnóstico de MI mediante el uso de una endoscopia de luz blanca estándar se ha considerado difícil debido a que la MI carece de distinción de color y su presencia como múltiples lesiones planas.
Recientemente , encontramos que se podía observar un hallazgo eritematoso único en la endoscopia incluso después de la erradicación de Hp. Describimos este hallazgo como «eritema moteado parcheado (MPE)». El MPE puede reconocerse como múltiples lesiones eritematosas planas o ligeramente deprimidas bajo la endoscopia de luz blanca estándar; patológicamente, incluye MI grave. La infección por Hp en sí misma puede causar eritema, visto en la endoscopia, que refleja cambios histológicos como infiltración de células inflamatorias y edema. , reclutamos pacientes que se sometieron a la erradicación de Hp para validar la relación entre el MPE y los hallazgos patológicos.
| Métodos | ▴Top |
Selección de paciente
Los pacientes con gastritis crónica que se sometieron a una erradicación satisfactoria de Hp al menos 6 meses antes del estudio se inscribieron de forma prospectiva para el estudio en el Centro Nacional de Salud y Medicina Global (NCGM) entre enero de 2008 y diciembre de 2008. Criterios de exclusión i Incluyó el uso de antiinflamatorios no esteroideos (AINE), antiácidos y antitrombóticos durante las 4 semanas previas a la endoscopia. También excluimos a los pacientes con antecedentes de cirugía gástrica, enfermedad hemorrágica, cirrosis hepática, insuficiencia renal, insuficiencia cardíaca y cáncer gástrico temprano o avanzado. Se obtuvo el consentimiento informado por escrito de los participantes de acuerdo con la Declaración de Helsinki y su posterior revisión. El protocolo del estudio fue aprobado por el Comité de Ética del NCGM.
Erradicación de Helicobacter pylori
Los pacientes con gastritis crónica y enfermedad ulcerosa péptica inducida por infección por Hp se sometieron a terapia de erradicación. Los pacientes fueron tratados con un régimen de 7 días que consistía en amoxicilina, claritromicina y un inhibidor de la bomba de protones (IBP) dos veces al día, que era el régimen estándar de primera línea aprobado en Japón. Si la erradicación no tuvo éxito, se administró un segundo régimen consistente en amoxicilina, metronidazol e IBP. La erradicación se confirmó mediante un examen histológico negativo de las biopsias gástricas, junto con una prueba de aliento con 13C-urea negativa (13C-UBT) 2 a 3 meses después de la finalización de la terapia de erradicación. Cuando todas las pruebas fueron negativas, un paciente se definió como negativo para la infección por Hp.
Evaluación endoscópica
Al menos 6 meses después de la erradicación de Hp, los pacientes se sometieron a un examen endoscópico. Utilizamos un endoscopio de alta resolución sin aumento (videoscopio Olympus, modelo GIF-H260) para observar la presencia de DPM en la mucosa gástrica. Definimos DPM como múltiples lesiones eritematosas planas o ligeramente deprimidas que se distinguían de mucosa congestionada, hemorragia, angioectasia, eritema manchado y eritema lineal (fig. 1A, B). También distinguimos entre MPE y mucosa rojiza con un epitelio en regeneración acompañado de úlcera o cicatriz de úlcera.
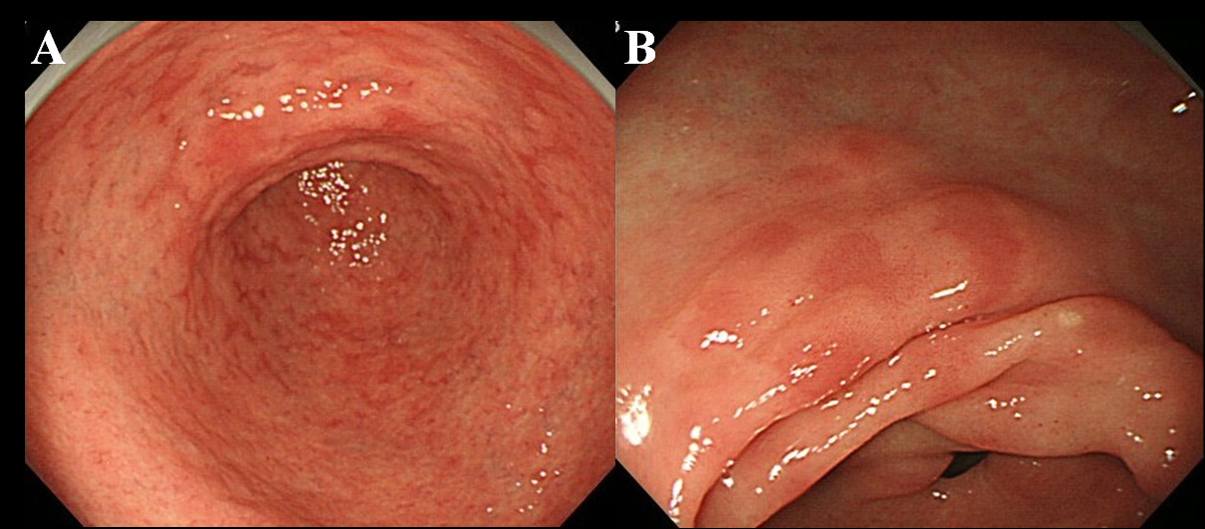 Haga clic para ver una imagen grande |
Figura 1. Hallazgo endoscópico de MPE. (A) Eritema múltiple y plano en el antro; (B) Eritema plano y deprimido en la curvatura menor del antro. |
Cuando encontramos un hallazgo de MPE en la endoscopia, realizamos una biopsia tanto del sitio MPE como del sitio no MPE. El sitio no MPE se definió como una mucosa adyacente ubicada a menos de 3 cm del sitio MPE (Fig. 2).
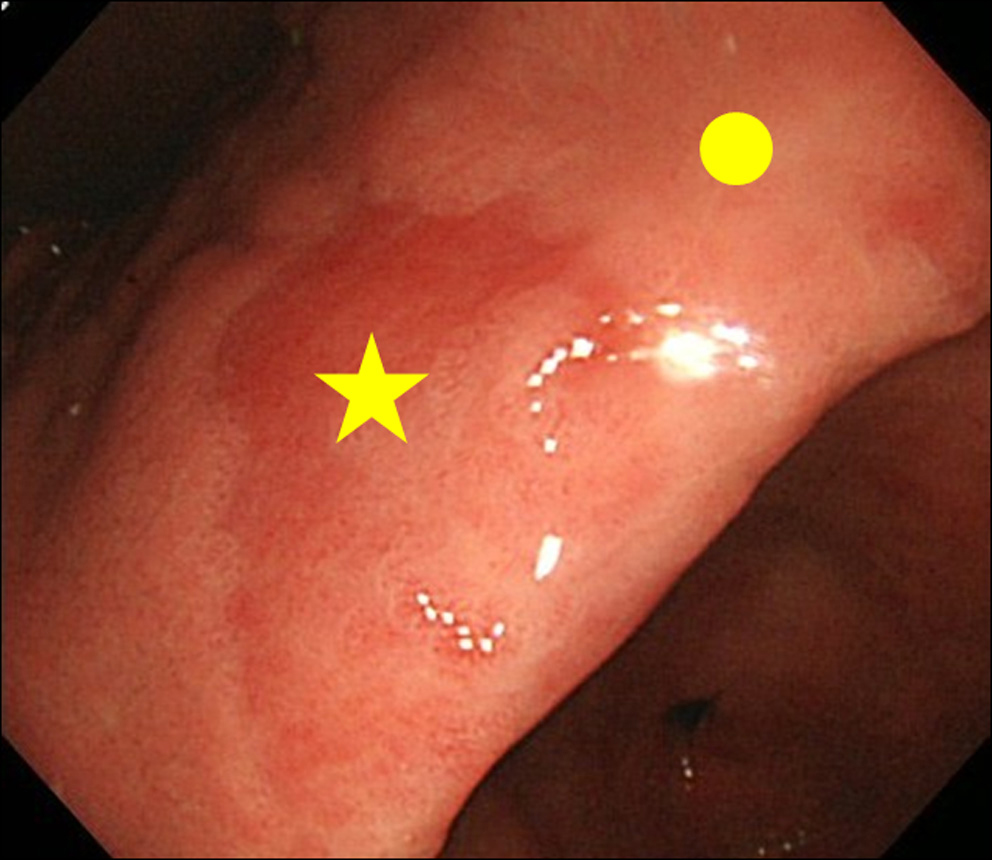 Haga clic para ver la imagen grande |
Figura 2. Sitio de la biopsia. (★) Sitio de biopsia de MPE; (•) Sitio de biopsia de no MPE. El sitio no MPE se definió como una mucosa adyacente ubicada dentro de los 3 cm del sitio MPE. |
La extensión del borde atrófico se clasificó en 3 etapas: leve, moderada y grave, según la definición de Kimura y Takemoto.
Evaluación histológica
Se enviaron muestras de biopsia a nuestro laboratorio, fijadas en formalina tamponada al 10%. Las muestras se procesaron, se incrustaron en parafina y se cortaron en secciones de 4 µm. Los portaobjetos de cada muestra se tiñeron con hematoxilina-eosina (HE) (Fig.3A) y tinción inmunohistoquímica. Las tinciones inmunohistoquímicas incluyeron las siguientes: (1) MUC2, un marcador de mucina intestinal que es útil para detectar células caliciformes (Fig. epitelio foveolar (Fig. 3C), (3) MUC6, un marcador de mucina gástrica, que se expresa en las células mucosas de la zona del cuello del cuerpo y las glándulas pilóricas del antro (Fig. 3D), (4) CD10, un marcador útil para detectar el borde en cepillo del intestino delgado (Fig. 3E), y (5) CDX2, un marcador para la presencia de MI (Fig. 3F). Usamos CDX2 porque estudios recientes han demostrado que la expresión de CDX2 podría observarse ampliamente en las glándulas IM y no desapareció después de la erradicación de Hp. La presencia de MI fue confirmada tanto por HE como por tinción inmunohistoquímica.
Los subtipos de MI se clasificaron como tipos completos o incompletos. El tipo completo se definió como una disminución de la expresión de mucina gástrica (MUC5AC o MUC6) y la coexpresión de mucina intestinal (MUC2) y CD10 (Fig. 3A-F). El tipo incompleto se definió como la expresión de mucina gástrica (MUC5AC o MUC6) y MUC2. Debido a que no existen criterios establecidos para categorizar un caso con los tipos completo e incompleto en una sección, asignamos los subtipos de MI como el tipo predominante.
El grado de La mensajería instantánea se calificó según el sistema de Sydney actualizado (0: ninguno, 1: leve, 2: moderado, 3: marcado).
Análisis estadístico
Dividimos a los pacientes en dos grupos en función de si los pacientes eran positivos o negativos para MPE. Utilizamos la prueba t de Student para comparar la edad y el período de erradicación. Se utilizó la prueba de chi-cuadrado o la prueba de probabilidad exacta de Fisher para las proporciones de sexos y el grado de atrofia endoscópica en los dos grupos.
También comparamos los hallazgos histológicos entre los sitios con MPE y los sitios sin MPE. Para comparar las diferencias entre los dos sitios de biopsia, utilizamos la prueba de rangos con signo de pares coincidentes de Wilcoxon para la IM puntuación mediana y prueba exacta de Fisher para la prevalencia de IM, subtipos de MI y fenotipos de MI. Se calcularon la sensibilidad, la especificidad, los valores predictivos positivos y negativos, y los cocientes de probabilidad positivos y negativos de MPE observados en la endoscopia para la detección de MI patológica. Los valores de p < 0,05 se consideraron significativos. Todos los análisis estadísticos se realizaron con el software Stata, versión 10 (StataCorp LP, College Station, TX, EE. UU.).
| Resultados | ▴Top |
Características de los pacientes
Durante el período de estudio, 157 pacientes que se sometieron a endoscopia digestiva alta y recibieron erradicación de Hp. Se excluyeron 52 de los 157 pacientes del análisis por cualquiera de los siguientes criterios: uso de antiácidos (31), fármacos antitrombóticos (17) o AINE (3); o antecedentes de cirrosis hepática (5), insuficiencia cardíaca (1) o cáncer gástrico temprano (2). Se aplicó más de un criterio de exclusión a algunos pacientes.
Por lo tanto, se seleccionó un total de 102 pacientes para el análisis después de la exclusión. De estos, hubo 55 (54%) pacientes con MPE. No se observaron diferencias significativas en la edad media y el sexo entre los pacientes con MPE positivos y negativos (Tabla 1). No hubo diferencias significativas entre los dos grupos después del período de erradicación de Hp. Sin embargo, la atrofia gástrica con una mayor gravedad (moderada a grave) apareció significativamente con más frecuencia en el grupo con MPE positivo en comparación con el grupo con MPE negativo (65,6% positivo versus 45,0% negativo, P = 0,035).
 Haga clic para ver |
Tabla 1. Características demográficas de los pacientes (n = 102) |
Hallazgos endoscópicos y características patológicas
 Haga clic para ver |
Tabla 2. Comparación de la puntuación de mensajería instantánea entre sitios MPE y no MPE (n = 55) |
No se observaron asociaciones significativas en la expresión de MUC2, MUC5AC, MUC6, C D10 y CDX2 entre los sitios MPE y los sitios no MPE (Tabla 3). No hubo diferencias significativas en las proporciones (completa / incompleta) de subtipos de MI entre los dos grupos (MPE: 18/30 versus no MPE: 8/10, P = 0,778).
 Haga clic para ver |
Tabla 3. Fenotipos y subtipos de metaplasia intestinal |
| Discusión | ▴Top |
En este estudio, nos centramos en una apariencia eritematosa única observada en la endoscopia después de la erradicación de Hp. Llamamos a este hallazgo «MPE» y descubrimos que la presencia de MPE como se ve en la endoscopia era típicamente característica de MI patológica.
El diagnóstico de MI con endoscopia convencional ha se ha considerado difícil porque la MI generalmente aparece en la mucosa plana y presenta pocos cambios morfológicos. Kaminishi et al informaron «cambio nodular de color ceniza» como un indicador de MI; la precisión de los hallazgos de estos investigadores fue alta, con una especificidad del 98-99%, pero la sensibilidad fue baja (6-12%). Kaminishi et al señalaron que la endoscopia convencional es menos útil para confirmar el diagnóstico de MI. Han surgido estudios recientes sobre el hallazgo endoscópico de MI mediante endoscopia con lupa. Se ha informado que los hallazgos distintivos de las fosas gástricas que se observan con la cromoendoscopia con azul de metileno y el «aspecto similar a una vellosidad» que se observa con la endoscopia confocal han sido útiles para diagnosticar la MI. Uedo et al informaron que la aparición de «una cresta azul claro» ( LBC) es un signo preciso de la presencia de MI, como se ve con la endoscopia de aumento de imágenes de banda estrecha (NBI). Sin embargo, debido a los altos costos del equipo y las habilidades adicionales y el tiempo requerido para un examen más detenido con herramientas especiales como NBI o endoscopia con aumento, la detección con este equipo no es práctica en la práctica clínica diaria. Además, existe un mayor riesgo de daño al ADN en la mucosa gastrointestinal cuando se usa cromoendoscopia con azul de metileno seguida de luz blanca, lo que requiere precaución en su uso. Por lo tanto, es más beneficioso diagnosticar MI al encontrar MPE sin el uso de cromoendoscopia y endoscopia con aumento. Los resultados de nuestro estudio sugieren que la presencia de MI puede diagnosticarse con una endoscopia estándar sin biopsia.
¿Por qué se puede observar el MPE incluso después de la erradicación de Hp? Esto podría atribuirse a los cambios histológicos dentro de la mucosa gástrica. Los cambios histológicos notables que siguen a la erradicación incluyen mejoras en la infiltración de células inflamatorias, hiperplasia epitelial y edema. Las imágenes endoscópicas de mucosa eritematosa y edematosa que parecen mejorar reflejan estos cambios histológicos. Por lo tanto, especulamos que el MPE consiste en un área restante de MI eritematoso persistente y un área no MI rápidamente recuperada como resultado de la erradicación exitosa de Hp. La erradicación de Hp hizo que el contraste entre el área de MPE y las áreas no MPE se hiciera más claro. Sin embargo, se desconoce por qué solo el sitio de MPE se observa como una mucosa eritematosa. Probablemente se pueda inferir que un área muy densa de microvasos rodea las glándulas metaplásicas; esto no se ha aclarado en este estudio. Además, la puntuación de IM en el sitio MPE fue significativamente más alta que la puntuación en el sitio no MPE. Especulamos que la aparición de mucosa eritematosa está asociada con la presencia de muchas glándulas metaplásicas.
El presente estudio demostró que el subtipo completo de MI se encontraba predominantemente en la mucosa gástrica . Los subtipos de MI se han clasificado en el tipo completo o incompleto; estos son los subtipos más utilizados. Varios estudios han demostrado que el tipo completo no presenta un mayor riesgo de desarrollar carcinoma, mientras que el tipo incompleto se asocia con un mayor riesgo de transformación maligna. Sin embargo, la asociación entre los subtipos y el riesgo de cáncer gástrico no está ampliamente aceptada. En la actualidad, es difícil identificar cualquiera de los subtipos mediante la endoscopia estándar.
Se ha informado que la terapia de erradicación de Hp es eficaz para prevenir tanto la úlcera gastrointestinal como la el desarrollo de cáncer gástrico. Estos usos de la terapia de erradicación de Hp probablemente surgirán en la práctica clínica en un futuro próximo. Sin embargo, se debe tener precaución contra el riesgo de desarrollar cáncer gástrico después de la erradicación de Hp. Se ha informado que las características del cáncer gástrico después de la erradicación incluyen MI patológicamente grave en el cuerpo y atrofia gástrica grave detectada en la endoscopia. Por lo tanto, es necesario observar cuidadosamente la presencia de MI incluso después de la erradicación de Hp.
En conclusión, la presencia de MPE en el examen endoscópico es característica de la MI patológica.Sería beneficioso en la práctica clínica poder diagnosticar MI patológica sin cromoendoscopia o endoscopia con aumento. MPE tiene el potencial de convertirse en un hallazgo predictivo del riesgo de cáncer gástrico en la era de la erradicación de Hp.
Agradecimientos
Agradecemos al Dr. Hidenobu Watanabe y al Dr. Hiroyoshi Ota por sus servicios de consulta a este estudio en relación con las evaluaciones patológicas. Deseamos expresar nuestro agradecimiento a Hisae Kawashiro, Coordinadora de investigación clínica, por su ayuda con la recopilación de datos.
Subvención de apoyo
Este trabajo fue financiado por la subvención del Centro Nacional de Salud y Medicina Global (21-108).
Conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses.
| ▴Top |
- Correa P. Carcinogénesis gástrica humana: un proceso multifactorial y de varios pasos – Primera conferencia sobre cáncer del premio de la Sociedad Americana Contra el Cáncer Epidemiología y Prevención. Cancer Res. 1992; 52 (24): 6735-6740.
pubmed - Leung WK, Sung JJ. Artículo de revisión: metaplasia intestinal y carcinogénesis gástrica. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Infección por Helicobacter pylori y desarrollo de cáncer gástrico. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Un reconocimiento endoscópico del borde atrófico y su importancia en la gastritis crónica. Endoscopia. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Sitios de biopsia adecuados para el diagnóstico de la infección por Helicobacter pylori y la evaluación de la extensión de la gastritis atrófica. Soy J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Clasificación endoscópica de la gastritis crónica basada en un estudio piloto de la Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Displasia epitelial gástrica. Cómo se relacionan los antecedentes clínico-patológicos con el tratamiento. Cáncer. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Diagnóstico endoscópico de metaplasia intestinal gástrica después de la erradicación de Helicobacter pylori. Endoscopia. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. El sistema Sydney actualizado. Taller internacional sobre histopatología de la gastritis, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Expresión del gen de la mucina en el epitelio gástrico humano normal, preneoplásico y neoplásico. Cancer Res. 1995; 55 (12): 2681-2690.
pubmed - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Las mucinas como moléculas clave para la clasificación de la metaplasia intestinal del estómago. Arco de Virchows. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, García E, Mandel U, et al. La metaplasia intestinal del estómago humano muestra distintos patrones de expresión de mucina (MUC1, MUC2, MUC5AC y MUC6). Cancer Res. 1999; 59 (5): 1003-1007.
pubmed - Groisman GM, Amar M, Livne E. CD10: una herramienta valiosa para el diagnóstico microscópico óptico de la enfermedad de inclusión de microvellosidades (atrofia familiar de microvellosidades). Am J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. Las ectopeptidasas CD10, CD13, CD26 y CD143 se regula positivamente en el cáncer gástrico. Int J Oncol. 2004; 25 (5): 1223-1232.
pubmed - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Expresión ectópica de la proteína homeodominio CDX2 en metaplasia intestinal y carcinomas de estómago. Cáncer Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Expresión aberrante de CDX2 en la mucosa gástrica con y sin metaplasia intestinal: efecto de la erradicación de Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H y col. Cromoendoscopia de aumento para el diagnóstico de displasia y metaplasia intestinal gástrica. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Validación externa de una clasificación para la cromoendoscopia de aumento con azul de metileno en lesiones gástricas premalignas. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Patrones endoscópicos de la mucosa gástrica y su importancia clínico-patológica. Mundial J Gastroenterol. 2003; 9 (11): 2552-2556.
pubmed - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. Un nuevo método para diagnosticar la metaplasia intestinal gástrica: imágenes de banda estrecha con endoscopia de aumento. Endoscopia. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Endoscopia de aumento: ¿mejora el análisis de la superficie mucosa para el diagnóstico de neoplasias gastrointestinales ?. Endoscopia. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Cromoendoscopia con azul de metileno y daño asociado al ADN en el esófago de Barrett. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y.Estudio de seguimiento de cinco años sobre alteraciones histológicas y endoscópicas en la mucosa gástrica después de la erradicación de Helicobacter pylori. Dig Endosc.2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Seguimiento histológico de dos a cuatro años de la mucosa gástrica después de Helicobacter pylori erradicación. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Los perfiles de mucina del estómago normal mucosa, metaplasia intestinal y sus variantes y carcinoma gástrico. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al. Tipos de metaplasia intestinal y el riesgo de cáncer: un estudio de cohorte en Eslovenia. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Detección de una mayor incidencia de cáncer gástrico temprano en pacientes con metaplasia intestinal tipo III que son seguidos de cerca. Intestino. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Artículo de revisión: estados preneoplásicos de la mucosa gástrica: un enfoque práctico para el médico perplejo. Aliment Pharmacol Ther. 2001; 15 (Supl. 1): 43-50.
pubmed - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Efecto de la erradicación de Helicobacter pylori en la incidencia de carcinoma gástrico metacrónico después de la resección endoscópica de cáncer gástrico temprano: un ensayo controlado aleatorio abierto. Lanceta. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Cáncer gástrico detectado tras la erradicación de Helicobacter pylori. Endoscopia digestiva. 2007; 19: 167-173.
Este es un artículo de acceso abierto distribuido según los términos de la licencia de atribución Creative Commons, que permite el uso, la distribución y la reproducción sin restricciones en cualquier medio, siempre que el trabajo original esté debidamente citado.
Gastroenterology Research es publicado por Elmer Press Inc.