Soluciones
Propiedades coligativas
Presión de vapor Depresión
Las propiedades físicas se pueden dividir en dos categorías. Las propiedades extensas (como la masa y el volumen) dependen del tamaño de la muestra. Las propiedades intensivas (como la densidad y la concentración) son propiedades características de la sustancia; no dependen del tamaño de la muestra en estudio. Esta sección introduce una tercera categoría que es un subconjunto de las propiedades intensivas de un sistema. Esta tercera categoría, conocida como propiedades coligativas, solo se puede aplicar a las soluciones. Por definición, una de las propiedades de una solución es una propiedad coligativa si depende únicamente de la relación del número de partículas de soluto y disolvente en la solución, no de la identidad del soluto.
Muy pocas de las propiedades físicas de una solución son propiedades coligativas. Como ejemplo de este conjunto limitado de propiedades físicas, consideremos lo que sucede con la presión de vapor del solvente cuando agregamos un soluto para formar una solución. Definiremos Po como la presión de vapor del líquido puro ![]() el disolvente
el disolvente ![]() y P como la presión de vapor del disolvente después de que se ha añadido un soluto.
y P como la presión de vapor del disolvente después de que se ha añadido un soluto.
Po = presión de vapor del líquido puro o disolvente
P = presión de vapor del disolvente en una solución
Cuando la temperatura de un líquido está por debajo de su punto de ebullición punto, podemos suponer que las únicas moléculas que pueden escapar del líquido para formar un gas son las que se encuentran cerca de la superficie del líquido.
Cuando se agrega un soluto al solvente, algunas de las moléculas de soluto ocupan el espacio cerca de la superficie del líquido, como se muestra en la figura siguiente. Cuando un soluto se disuelve en un solvente, el número de moléculas de solvente cerca de la superficie disminuye y la presión de vapor del solvente disminuye.

Esto no tiene ningún efecto sobre la velocidad a la que las moléculas de disolvente en la fase gaseosa se condensan para formar un líquido. Pero disminuye la velocidad a la que las moléculas de disolvente en el líquido pueden escapar a la fase gaseosa. Como resultado, la presión de vapor del solvente que se desprende de una solución debe ser menor que la presión de vapor del solvente puro.
| P | < | Po | ||
| presión de vapor del disolvente encima de una solución |
presión de vapor del disolvente puro |
Entre 1887 y 1888, Francois-Marie Raoult demostró que la presión de vapor de una solución es igual a la fracción molar del disolvente multiplicada por la presión de vapor del líquido puro.
| P | = | Csolvent Po | ||||
| presión de vapor del disolvente encima de una solución |
presión de vapor del disolvente puro |
Esta ecuación, que se conoce como ley de Raoult, es fácil de entender. Cuando el solvente es puro y la fracción molar del solvente es igual a 1, P es igual a Po. A medida que la fracción molar del solvente se vuelve más pequeña , la presión de vapor del solvente que escapa de la solución también se vuelve más pequeña.
Supongamos, por el momento, que el solvente es el único componente de la solución que es lo suficientemente volátil como para tener una presión de vapor medible. Si esto es cierto, la presión de vapor de la solución será igual a la presión de vapor del solvente que sale de la solución. La ley de Raoult sugiere que la diferencia entre la presión de vapor del solvente puro y la solución aumenta a medida que disminuye la fracción molar del solvente.
El cambio en la presión de vapor que ocurre cuando se agrega un soluto a un solvente es por lo tanto, una propiedad coligativa. Si depende de la fracción molar del soluto, entonces debe depender de la relación entre el número de partículas de soluto y disolvente en la solución, pero no de la identidad del soluto.
![]()
Elevación del punto de ebullición y depresión del punto de congelación
La siguiente figura muestra las consecuencias del hecho de que los solutos reducen la presión de vapor de un solvente. La línea que conecta los puntos B y C en este diagrama de fases contiene las combinaciones de temperatura y presión a las que el solvente puro y su vapor están en equilibrio. Por lo tanto, cada punto de esta línea describe la presión de vapor del solvente puro a esa temperatura. La línea de puntos en esta figura describe las propiedades es de una solución obtenida disolviendo un soluto en el solvente.A cualquier temperatura dada, la presión de vapor del solvente que escapa de la solución es menor que la presión de vapor del solvente puro. Por lo tanto, la línea de puntos se encuentra debajo de la línea continua.
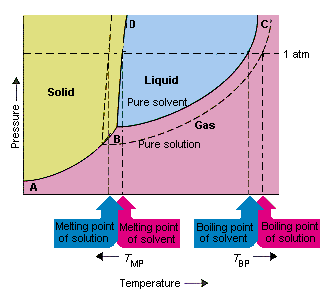
La disminución en la presión de vapor del solvente que ocurre cuando se agrega un soluto al solvente causa un aumento en el punto de ebullición y una disminución en el punto de fusión de la solución.
De acuerdo con esta figura, la solución no puede hervir a la misma temperatura que el disolvente puro. Si la presión de vapor de El solvente que escapa de la solución es menor que la presión de vapor del solvente puro a cualquier temperatura dada, la solución debe calentarse a una temperatura más alta antes de que hierva. La disminución de la presión de vapor del solvente que ocurre cuando se usa para formar una solución por lo tanto aumenta el punto de ebullición del líquido.
Cuando se introdujeron los diagramas de fase, el punto triple se definió como la única combinación de temperatura y presión en la que el gas, el líquido y el sólido pueden existir al mismo tiempo. La figura anterior muestra que el punto triple de la solución ocurre a una temperatura más baja que el punto triple del solvente puro. Por sí mismo, el cambio en el punto triple no es importante. Pero da como resultado un cambio en la temperatura a la cual la solución se congela o se derrite. porque, tenemos que cuidarnos completamente en la línea que separa las regiones sólida y líquida en el fasediagrama. Esta línea es casi vertical porque el punto de fusión de una sustancia no es muy sensible a la presión.
Agregar un soluto a un solvente no cambia la forma en que el punto de fusión depende de la presión. La línea que separa las regiones líquida y sólida de la solución es, por lo tanto, paralela a la línea que cumple la misma función para el solvente puro. . Esta línea debe pasar por el punto triple de la solución, sin embargo. La disminución en el punto triple que ocurre cuando un soluto se disuelve en un solvente, por lo tanto, disminuye el punto de fusión de la solución.
La figura anterior muestra cómo el El cambio en la presión de vapor que ocurre cuando un soluto se disuelve en un solvente conduce a cambios en el punto de fusión y también en el punto de ebullición del solvente. Porque el cambio en la presión de vapor es una propiedad coligativa, que depende solo del número relativo de partículas de soluto y solvente , los cambios en el punto de ebullición y el punto de fusión del disolvente también son propiedades coligativas.
![]()
Cálculos de propiedades coligativas
El mejor camino hacia los demonios La importancia de las propiedades coligativas es examinar las consecuencias de la ley de Raoult. Raoul descubrió que la presión de vapor del solvente que escapa de una solución es proporcional a la fracción molar del solvente.
P = CsolventPo
Pero la presión de vapor de un disolvente no es una propiedad coligativa. Sólo el cambio en la presión de vapor que ocurre cuando se agrega un soluto al solvente puede incluirse entre las propiedades coligativas de una solución.
Debido a que la presión es una función de estado, el cambio en la presión de vapor del solvente que ocurre cuando se agrega un soluto al solvente puede definirse como la diferencia entre la presión de vapor del solvente puro y la presión de vapor del solvente. escapando de la solución.
P = Po – P
Sustituyendo la ley de Raoult en esta ecuación se obtiene el siguiente resultado.
P = Po – Csolvent Po = (1 – Csolvent) Po
Esta ecuación se puede simplificar recordando la relación entre la fracción molar del soluto y la fracción molar del solvente.
Csolute + Csolvent = 1
Sustituyendo esto relación en la ecuación que define P da otra forma de la ley de Raoult.
P = CsolutePo
Esta ecuación nos recuerda que el cambio en la presión de vapor del solvente que ocurre cuando se agrega un soluto al solvente es proporcional a la fracción molar del soluto. A medida que se disuelve más solución en el disolvente, la presión de vapor del disolvente disminuye y aumenta el cambio en la presión de vapor del disolvente.
Debido a que los cambios en el punto de ebullición del disolvente (TBP) que se producen cuando se añade un soluto a un disolvente son el resultado de cambios en la presión de vapor del disolvente, la magnitud del cambio en el punto de ebullición también es proporcional a la fracción molar del soluto.
![]() TBP = kbsolute
TBP = kbsolute
En soluciones diluidas, la fracción molar del soluto es proporcional a la molalidad de la solución, como se muestra en la figura siguiente.

Por lo tanto, la ecuación que describe la magnitud de la elevación del punto de ebullición que se produce cuando se agrega un soluto a un solvente se escribe de la siguiente manera.
![]() TBP = kbm
TBP = kbm
Aquí, ![]() TBP es la elevación del punto de ebullición – el cambio en el punto de ebullición que ocurre cuando un soluto se disuelve en el disolvente
TBP es la elevación del punto de ebullición – el cambio en el punto de ebullición que ocurre cuando un soluto se disuelve en el disolvente ![]() y kb es una constante de proporcionalidad conocida como la constante de elevación del punto de ebullición molal para el disolvente.
y kb es una constante de proporcionalidad conocida como la constante de elevación del punto de ebullición molal para el disolvente.
Se puede escribir una ecuación similar para describir lo que sucede con el punto de congelación (o punto de fusión) de un solvente cuando se agrega un soluto al solvente.
![]() TFP = -kfm
TFP = -kfm
En esta ecuación, ![]() TFP es el punto de congelación depresión
TFP es el punto de congelación depresión ![]() el cambio en el punto de congelación que ocurre cuando el soluto se disuelve en el solvente – y kf es la constante de depresión del punto de congelación molal para el solvente. Se usa un signo negativo en esta ecuación para indicar que el punto de congelación del solvente disminuye cuando se agrega un soluto.
el cambio en el punto de congelación que ocurre cuando el soluto se disuelve en el solvente – y kf es la constante de depresión del punto de congelación molal para el solvente. Se usa un signo negativo en esta ecuación para indicar que el punto de congelación del solvente disminuye cuando se agrega un soluto.
Los valores de kf y kbas, así como los puntos de congelación y de ebullición para varios disolventes puros, se dan en las tablas siguientes.
Constantes de depresión del punto de congelación
Constantes de elevación del punto de ebullición
Problema de práctica 6:
Calcule el peso molecular del azufre si se disuelven 35,5 gramos de azufre en 100,0 gramos de CS2 para producir una solución que tenga un punto de ebullición de 49,48oC.
Haga clic aquí para comprobar su respuesta al problema de práctica 6
Haga clic aquí para ver una solución al problema de práctica 6
Problema de práctica 7:
Determine el peso molecular del ácido acético si una solución que contiene 30.0 gramos de ácido acético por kilogramo de agua se congela a -0,93oC. ¿Concuerdan estos resultados con la suposición de que el ácido acético tiene la fórmula CH3CO2H?
Haga clic aquí para comprobar su respuesta al problema de práctica 7
Haga clic aquí para ver una solución al problema de práctica 7
¿Qué pasaría en el cálculo del problema de práctica 7 si se repitiera con un ácido más fuerte, como el ácido clorhídrico?
Problema de práctica 8:
Explique por qué una solución 0.100 m de HCl disuelto en benceno tiene una depresión del punto de congelación de 0.512oC, mientras que una solución de 0.100 m de HCl en agua tiene una depresión del punto de congelación de 0.352oC.
Haga clic aquí para comprobar su respuesta al problema de práctica 8
En 1884, Jacobus Henricus van «t Hoff introdujo otro término para las expresiones de depresión del punto de congelación y elevación del punto de ebullición para explicar las propiedades coligativas de las soluciones de compuestos que se disocian cuando se disuelven en agua.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Sustituyendo el valor experimental de la depresión del punto de congelación de una solución de HCl 0.100 m en esta ecuación, se obtiene un valor para el término i de 1.89. Si el HCl no se disociara en agua, i sería 1. Si se disocia completamente, sería 2. El valor experimental de 1,89 sugiere que al menos el 95% de las moléculas de HCl se disocian en esta solución.
Práctica Problema 9:
Explique por qué 0.60 gramos de ácido acético se disuelven en 200 gramos de benceno para formar una solución que reduce el punto de congelación del benceno a 5.40oC.
Haga clic aquí para verificar su respuesta a Problema de práctica 9
![]()
Presión osmótica
En 1784, el físico y clérigo francés Jean Antoine Nollet descubrió que la vejiga de un cerdo llena de una solución concentrada de alcohol en agua se expandía cuando se sumergía en agua. La vejiga actuaba como una membrana semipermeable, lo que permitía que las moléculas de agua entraran en la solución, pero evitaba que las moléculas de alcohol se movieran en la otra dirección. El movimiento de un componente de una solución a través de una membrana para diluir la solución se llama ósmosis y la presión que produce se denomina presión osmótica ().
La presión osmótica se puede demostrar con el aparato que se muestra en la figura siguiente. Una membrana semipermeable se ata a través del extremo abierto de un tubo de cardo. A continuación, el tubo se llena parcialmente con una solución de azúcar o alcohol en agua y se sumerge en un vaso de agua. El agua fluirá hacia el tubo hasta que la presión en la columna de agua debido a la fuerza de la gravedad equilibre la presión osmótica que impulsa el agua a través de la membrana.

El agua fluye a través la membrana semipermeable para diluir la solución de alcohol hasta que la fuerza de la gravedad que tira hacia abajo de la columna de esta solución equilibra la presión osmótica que empuja el agua a través de la membrana.
El mismo año en que Raoult descubrió la relación entre la presión de vapor de una solución y la presión de vapor de un disolvente puro, Jacobus Henricus van «t Hoff descubrió que la presión osmótica de una solución diluida () obedecía a una ecuación análoga a la ecuación del gas ideal.
| |
= | nRT | ||
| V |
Esta ecuación sugiere que la presión osmótica es otro ejemplo de una propiedad coligativa, porque esto La presión depende de la relación entre el número de partículas de soluto y el volumen de la solución ![]() n / V
n / V ![]() no de la identidad de las partículas de soluto. también nos recuerda la magnitud de la presión osmótica. De acuerdo con esta ecuación, un 1.00 M s La solución tiene una presión osmótica de 22,4 atm a 0oC.
no de la identidad de las partículas de soluto. también nos recuerda la magnitud de la presión osmótica. De acuerdo con esta ecuación, un 1.00 M s La solución tiene una presión osmótica de 22,4 atm a 0oC.

Esto significa que una solución de 1,00 M debería ser capaz de soportar una columna de agua de 670 pulgadas, o casi 56 pies, de altura !
Los biólogos y bioquímicos a menudo se aprovechan de la presión osmótica cuando aíslan los componentes de una célula. Cuando una célula se agrega a una solución acuosa que contiene una concentración mucho mayor de iones que el líquido dentro de la célula, el agua sale de la célula fluyendo a través de la membrana celular hasta que la célula se contrae tanto que la membrana se rompe. Alternativamente, cuando una célula se coloca en una solución que tiene una fuerza iónica mucho menor, el agua se vierte en la célula y la célula se expande hasta que estalla la membrana celular.
![]()