Fakten zu Cadmiumelementen
Das chemische Element Cadmium wird als Übergangsmetall eingestuft. Es wurde 1817 von Friedrich Stromeyer entdeckt.

Datenzone
| Klassifizierung: | Cadmium ist ein Übergangsmetall |
| Farbe: | bläulich-weiß |
| Atomgewicht: | 112,41 |
| Zustand: | fest |
| Schmelzpunkt: | 321,1 oC, 594,3 K |
| Siedepunkt: | 765 oC, 1038 K |
| Elektronen: | 48 |
| Protonen: | 48 |
| Neutronen in den am häufigsten vorkommenden Isotopen: | 66 |
| Elektronenschalen: | 2,8,18,18,2 |
| Elektronenkonfiguration: | 4d10 5s2 |
| Dichte bei 20 ° C: | 8,65 g / cm3 |
Mehr anzeigen, einschließlich: Wärme, Energien, Oxidation, Reaktionen,
Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 13,1 cm3 / mol |
| Struktur: | hcp: hexagonal dicht gepackt |
| Härte: | 2,0 Mohs |
| Spezifische Wärmekapazität | 0,23 J g-1 K-1 |
| Schmelzwärme | 6,192 kJ mol-1 |
| Zerstäubungswärme | 112 kJ mol-1 |
| Verdampfungswärme | 99,87 kJ mol-1 |
| 1. Ionisierungsenergie | 867,7 kJ mol-1 |
| 2. Ionisierungsenergie | 1631,4 kJ mol-1 |
| 3. Ionisierungsenergie | 3616,2 kJ mol-1 |
| Elektronenaffinität | – |
| Minimale Oxidationszahl | 0 |
| min. gemeinsame Oxidationsnummer | 0 |
| Maximale Oxidationszahl | 2 |
| Max. gemeinsame Oxidation Nr. | 2 |
| Elektronegativität (Pauling-Skala) | 1,69 |
| Polarisierbarkeit Volumen | 7,2 Å3 |
| Reaktion mit Luft | mild, w / ht ⇒ CdO |
| Reaktion mit 15 M HNO3 | mild ⇒ Cd (NO3) 2, NOx |
| Reaktion mit 6 M HCl | mild, ⇒ H2, CdCl2 |
| Reaktion mit 6 M NaOH | keine |
| Oxid (s) | CdO, CdO2 |
| Hydrid (e) | CdH2 |
| Chlorid (e) | CdCl2 |
| Atomradius | 151 pm |
| Ionenradius (1+ Ion) | – |
| Ionenradius (2+ Ion) | 109 pm |
| Ionenradius (3+ Ionen) | – |
| Ionenradius (1-Ion) | – |
| Ionenradius (2-Ionen) | – |
| Ionenradius (3-Ionen) | – |
| Die Wärmeleitfähigkeit | 96,6 W m-1 K-1 |
| Elektrische Leitfähigkeit | 14,7 x 106 S m-1 |
| Gefrier- / Schmelzpunkt: | 321,1 oC, 594,3 K |

Eine kleine Kugel aus Cadmiummetall mit einer Münze als Größenreferenz.

Friedrich Stromeyer, der 1817 Cadmium entdeckte.
Cadmiums Periodensystem-Nachbarschaft
| Gruppe 11 |
Gruppe 12 | Gruppe 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
Entdeckung von Cadmium
Cadmium wurde 1817 vom deutschen Chemiker Friedrich Stromeyer als Verunreinigung in Zinkoxid entdeckt. (1)
Stromeyer machte seine Entdeckung auf Ersuchen der Regierung, die Apotheken in der Stadt Hildesheim zu inspizieren.
In jenen Tagen wurde Zinkoxid, wie es immer noch ist, zur Behandlung von Hauterkrankungen verwendet. Aus irgendeinem Grund verkauften die Apotheken von Hildesheim Zinkcarbonat anstelle des üblichen Zinkoxids.
Stromeyer war sich bewusst, dass das Erhitzen von Zinkcarbonat bis es glühend heiß war, es in Oxid umwandeln würde. Er tat dies mit Proben aus den Apotheken. Er fand heraus, dass sich das strahlend weiße Carbonat in ein Oxid verwandelte, das eigentlich weiß sein sollte, aber tatsächlich gelb / orange war.
Normalerweise würde diese Farbe auf eine Eisen- oder Bleiverunreinigung hinweisen, aber Stromeyer konnte keine Spur finden von diesen Elementen.
Er besuchte die Fabrik in Salzgitter, in der die Apotheken das Zinkcarbonat gekauft hatten. Er fragte, warum sie Zinkcarbonat anstelle des üblichen Oxids verkauften.
Der Manager erklärte ihm, dass ihr Zinkcarbonat die erwartete Farbe – Weiß – habe und leicht zu verkaufen sei.
Als sie versuchten, das Carbonat durch Erhitzen in das Oxid umzuwandeln, es wurde immer gelb. Da Zinkoxid weiß sein sollte, konnten sie es nicht verkaufen. Sie hatten es sorgfältig auf Eisenverunreinigungen analysiert, konnten aber keine finden.
Stromeyer beschloss dann, dieses gelbe Zinkoxid selbst sorgfältig zu analysieren. Er fand heraus, dass die gelbe Farbe durch „das Vorhandensein eines eigenartigen Metalloxids verursacht wurde, dessen Existenz bisher nicht vermutet worden war“.
Er extrahierte dieses neue Metalloxid aus dem Zinkoxid und reduzierte es dann, um das weltweit erste Cadmiummetall zu isolieren. Er verglich sein Aussehen mit dem von Platin und maß seine Dichte mit 8,75 g / cm3 – sehr nahe an der heutigen akzeptierter Wert.
Er arbeitete weiter und stellte fest, dass andere Zinkverbindungen auch sein neues Metall enthielten. Er analysierte ‚reines‘ Zinkmetall und stellte fest, dass sein neues Metall auch darin vorhanden war.
r schätzte, dass das neue Metall zwischen 0,1% und 1% in Zink und seinen Verbindungen vorhanden war, aus denen er 3 Gramm reines Cadmiummetall isolieren konnte.
Stromeyer schlug den Namen Cadmium vor nach ‚Cadmia‘ der lateinische Name für Calamin. Calamin ist ein alter Name für ein Zinkerz.
Cadmium wurde 1818 vom deutschen Chemiker Karl Hermann unabhängig entdeckt. Hermann hatte eine unerwartete gelbe Farbe in Zinksulfid bemerkt Es wurde angenommen, dass das Gelb von Arsenverunreinigungen stammt, aber Hermann erkannte, dass es tatsächlich auf ein zuvor unbekanntes Element zurückzuführen war ment. (2)


Cadmiumtellurid wird zur Herstellung von Dünnschichtsolarzellen verwendet, die dies können absorbieren mehr als 90% des sichtbaren Lichts. Bild: NREL
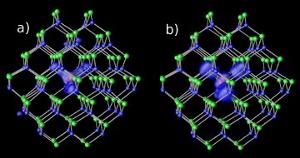
Magnesiumverunreinigungen in Cadmium-Selen-Nanokristallen auf zwei verschiedenen Spaltniveaus : (a) resonant und (b) hybrid. Bild: NERSC
Aussehen und Eigenschaften
Schädliche Wirkungen:
Cadmium und seine Verbindungen sind hochgiftig.
Eigenschaften:
Cadmium ist ein weiches, formbares, duktiles, bläulich-weißes Metall, das leicht mit einem Messer geschnitten werden kann. Es ist ein ausgezeichneter elektrischer Leiter und zeigt eine gute Beständigkeit gegen Korrosion und Angriff durch Chemikalien.
Es ähnelt in vielerlei Hinsicht Zink in seinen chemischen Eigenschaften.
Cadmium läuft in Luft an und ist löslich in Säuren, aber nicht in Laugen.
Das Metall verbrennt an der Luft unter Bildung von braunem Cadmiumoxid (CdO).
Verwendung von Cadmium
Cadmium wird hauptsächlich verwendet in Batterien (insbesondere wiederaufladbare Nickel-Cadmium-, NiCad-, Batterien).
Aufgrund seines niedrigen Reibungskoeffizienten und seiner hohen Ermüdungsbeständigkeit wird Cadmium in Legierungen für Lager verwendet. Cadmium wird in niedrigschmelzenden Legierungen verwendet und ist Bestandteil vieler Arten von Lot. Es wird auch beim Galvanisieren verwendet.
Cadmiumhaltige Verbindungen werden in Schwarz-Weiß-Fernsehleuchtstoffen und in Blau- und Grünleuchtstoffen für Farbfernsehbildröhren verwendet. Cadmiumsulfid wird als gelbes Pigment verwendet, und Cadmiumselenid wird als rotes Pigment verwendet, das häufig als Cadmiumrot bezeichnet wird. Cadmium und Tellur können zu CdTe-Dünnschicht-Photovoltaikmodulen zusammengesetzt werden, deren physikalische Eigenschaften ideal sind Solarzellenproduktion. Sie sind relativ kostengünstig und haben eine nahezu perfekte Bandlücke für die Ernte von Sonnenenergie.
Häufigkeit und Isotope
Häufigkeit der Erdkruste: 150 Gewichtsteile pro Milliarde, 30 Teile pro Milliarde Mol
Sonnensystem im Überfluss: 6 Gewichtsteile pro Milliarde, 70 Molteile pro Billion
Kosten, rein: 46 USD pro 100 g
Kosten, Volumen: 0,77 USD pro 100 g
Quelle: Cadmium kommt am häufigsten in geringen Mengen in Verbindung mit Zinkerzen wie Sphalerit (ZnS) vor. Greenockit (CdS) ist das einzige Cadmiummineral von Bedeutung. Fast das gesamte Cadmium entsteht als Nebenprodukt bei der Raffination von Zink, Kupfer und Bleierz.

- Friedrich Stromeyer, Annals of Philosophy, herausgegeben von Thomas Thomson, Band XIII, 1819, Robert Baldwin, S. 108
- JW Mellor, Eine umfassende Abhandlung über anorganische und theoretische Chemie, Band IV, 1929, Longmans, Green and Co. Ltd., S. 404
Zitieren Sie diese Seite
Für Online-Links Kopieren Sie eine der folgenden Optionen und fügen Sie sie ein:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
oder
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
To Zitieren Sie diese Seite in einem akademischen Dokument. Verwenden Sie dazu das folgende MLA-konforme Zitat:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.