ATP-molekyyli
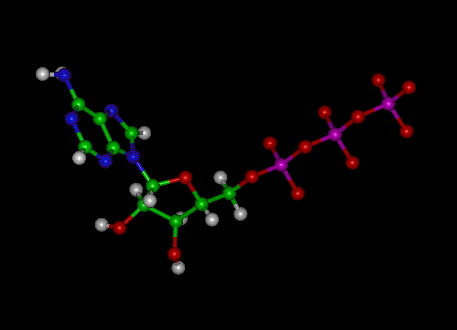
Adenosiinitrifosfaatti (ATP) -molekyyli on tunnettu nukleotidi. biokemiassa solunsisäisen energiansiirron ”molekyylivaluuttana”; toisin sanoen ATP pystyy varastoimaan ja kuljettamaan kemiallista energiaa soluissa. ATP: llä on myös tärkeä rooli nukleiinihappojen synteesissä.
Tämän kuvan 3D-rakennetta varten käytetään JsmolClickia napsauttamalla tätä
Kuva: ATP: n molekyylirakenne
Energiaa vapautuu hydrolysoimalla kolmas fosfaattiryhmä. Kun tämä kolmas fosfaattiryhmä on vapautunut, tuloksena oleva ADP (adenosiinidifosfaatti) voi absorboida energiaa ja palauttaa ryhmän, regeneroiden siten ATP-molekyylin; tämä antaa ATP: lle varastoida energiaa kuten ladattava akku.
Fosforyyliasemat
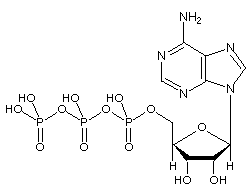
AMP: n ryhmästä alkaviin fosforyyliryhmiin viitataan alfa-, beeta- ja gammafosfaateina.
Fysikaaliset ja kemialliset ominaisuudet
ATP koostuu adenosiinista – joka koostuu adeniinirenkaasta ja riboosisokerista – ja kolmesta fosfaattiryhmästä (trifosfaatti). Fosforyyliryhmiä, lähinnä ryhmää, joka on lähinnä riboosia, kutsutaan alfa (a), beeta (p) ja gamma (y) fosfaateiksi. Näin ollen se liittyy läheisesti adeniininukleotidiin, RNA: n monomeeriin. ATP liukenee hyvin veteen ja on melko stabiili liuoksissa, joiden pH on välillä 6,8 – 7,4, mutta hydrolysoituu nopeasti äärimmäisessä pH: ssa. Näin ollen ATP varastoidaan parhaiten vedettömänä suolana.
ATP on epävakaa molekyyli puskuroimattomassa vedessä, jossa se hydrolysoituu ADP: ksi ja fosfaatiksi. Tämä johtuu siitä, että ATP: n fosfaattiryhmien välisten sidosten vahvuus on pienempi kuin vetysidosten (hydraatiosidokset), sen tuotteiden (ADP ja fosfaatti) ja veden vahvuus. Siten, jos ATP ja ADP ovat kemiallisessa tasapainossa vedessä, melkein koko ATP muuttuu lopulta ADP: ksi. Järjestelmä, joka on kaukana tasapainosta, sisältää Gibbsin vapaata energiaa ja kykenee tekemään työtä. Elävät solut ylläpitävät ATP: n ja ADP: n suhdetta kymmenessä suuruusluokassa tasapainosta, ATP-pitoisuudet viisi kertaa korkeammat kuin ADP: n pitoisuudet. Tämä siirtyminen tasapainosta tarkoittaa, että ATP: n hydrolyysi solussa vapauttaa suuren määrän vapaata energiaa.
Kaksi fosfoanhydridisidosta (ne, jotka yhdistävät vierekkäisiä fosfaatteja) ATP-molekyylissä ovat vastuussa tämä molekyyli. Biokemiallisten reaktioiden yhteydessä näitä anhydridisidoksia kutsutaan usein – ja joskus kiistanalaisiksi – korkeaenergisiksi sidoksiksi (huolimatta siitä, että sidosten katkaiseminen vie energiaa). ATP: hen varastoitua energiaa voidaan vapauttaa anhydridisidosten hydrolyysin jälkeen. ATP-molekyylin ensisijainen fosfaattiryhmä, joka hydrolysoituu, kun energiaa tarvitaan anabolisten reaktioiden ajamiseksi, on y-fosfaattiryhmä. Se sijaitsee kauimpana riboosisokerista, sillä on suurempi hydrolyysienergia kuin joko a- tai β-fosfaatilla. Hydrolyysin jälkeen muodostuneet sidokset – tai jäännöksen fosforylaatio ATP: llä – ovat energialtaan pienempiä kuin ATP: n fosfoanhydridisidokset. Entsyymikatalysoidun ATP-hydrolyysin tai ATP: n fosforylaation aikana elävä järjestelmä voi hyödyntää käytettävissä olevan vapaan energian työn tekemiseksi.
Mikä tahansa epävakaa, mahdollisesti reaktiivisten molekyylien järjestelmä voi toimia tapana tallentaa vapaita energiaa, jos solu säilytti pitoisuutensa kaukana reaktion tasapainopisteestä. Kuitenkin, kuten useimpien polymeeristen biomolekyylien kohdalla, RNA: n, DNA: n ja ATP: n hajoaminen yksinkertaisemmiksi monomeereiksi johtuu sekä energian vapautumisesta että entropian lisääntymisestä molemmissa vakiopitoisuuksissa ja myös solun sisällä havaituista pitoisuuksista.
ATP: n hydrolyysistä vapautuva energian vakiomäärä voidaan laskea energian muutoksista ei-luonnollisissa (vakio) olosuhteissa ja korjata sitten biologisiin pitoisuuksiin. Lämpöenergian (entalpian) nettomuutos standardilämpötilassa ja -paineessa hajotettaessa ATP hydratoituneeksi ADP: ksi ja hydratoiduksi epäorgaaniseksi fosfaatiksi on -30,5 kJ / mol, vapaan energian muutoksella 3,4 kJ / mol. Energia, joka vapautuu pilkkomalla joko fosfaatti (Pi) tai pyrofosfaatti (PPi) yksikkö ATP: stä 1 M vakiotilassa, ovat:
ATP + H
2O → ADP + Pi ΔG ° = −30,5 kJ / mol (−7,3 kcal / mol)
ATP + H
2O → AMP + PPi ΔG ° = −45,6 kJ / mol (−10,9 kcal / mol)
Nämä arvot voidaan käytetään laskemaan energiamuutos fysiologisissa olosuhteissa ja solun ATP / ADP-suhde. Kuitenkin yhä edustavampaa arvoa (joka ottaa huomioon AMP: n) kutsutaan energiamaksuksi. Tämän reaktion Gibbsin vapaalle energialle annetut arvot riippuvat useista tekijöistä, mukaan lukien yleinen ionivahvuus ja maa-alkalimetalli-ionien, kuten Mg2 +
ja Ca2 +
, läsnäolo.Tyypillisissä soluolosuhteissa ΔG on noin −57 kJ / mol (−14 kcal / mol).
Synteesi
ATP voidaan tuottaa erilaisilla soluprosesseilla, tyypillisimmin mitokondrioissa oksidatiivinen fosforylaatio ATP-syntaasin katalyyttisen vaikutuksen alaisena tai kloroplastien kasvien tapauksessa fotosynteesillä. Aluksi glukoosi hajotetaan pyruvaatiksi sytosolissa. Kutakin glukoosimolekyyliä varten syntyy kaksi ATP-molekyyliä. ATP-synteesin loppuvaiheet suoritetaan mitokondriossa, ja ne voivat tuottaa jopa 34 ATP: tä.
ATP ihmiskehossa
ATP: n kokonaismäärä ihmiskehossa on noin 0,1 moolia. Aikuisen päivittäin käyttämä energia vaatii 200 – 300 moolin ATP: n hydrolyysin. Tämä tarkoittaa, että jokainen ATP-molekyyli on kierrätettävä 2000 – 3000 kertaa päivän aikana. ATP: tä ei voida varastoida, joten sen synteesin on seurattava tarkasti sen kulutusta.
Muilla trifosfaateilla
Elävillä soluilla on myös muita ”korkean energian” nukleosiditrifosfaatteja, kuten guaniinitrifosfaattia. Niiden ja ATP: n välillä energiaa voidaan helposti siirtää reaktioilla, kuten nukleosididifosfokinaasin katalysoimilla reaktioilla: Energia vapautuu, kun fosfaatti-fosfaattisidosten hydrolyysi suoritetaan. Tätä energiaa voivat käyttää erilaiset entsyymit, moottoriproteiinit ja kuljetusproteiinit solun työn suorittamiseksi. Hydrolyysi tuottaa myös vapaata epäorgaanista fosfaattia ja adenosiinidifosfaattia, jotka voidaan hajottaa edelleen toiseksi fosfaatti-ioniksi ja adenosiinimonofosfaatiksi. ATP voidaan myös hajottaa suoraan adenosiinimonofosfaatiksi pyrofosfaatin muodostumisella. Tämän viimeisen reaktion etuna on tehokkaasti peruuttamaton prosessi vesiliuoksessa.
ADP: n reaktio GTP: n kanssa
ADP + GTP > ATP + GDP