Francium-elementin tosiasiat
Franciumin kemiallinen alkuaine luokitellaan alkalimetalliksi. Sen löysi vuonna 1939 Marguerite Perey.

Tietovyöhyke
| Luokitus: | Francium on alkalimetalli |
| Väri: | hopeanharmaa-metallinen (oletettu) |
| Atomic paino: | (223), ei stabiileja isotooppeja |
| Tila: | kiinteä |
| Sulamispiste: | 27 oC, 300 K |
| Kiehumispiste: | 677 oC, 950 K |
| Elektronit: | 87 |
| Protonit: | 87 |
| Neutronit runsaimmalla isotoopilla: | 136 |
| Elektronikuoret: | 2, 8,18,32,18,8,1 |
| Elektronikonfiguraatio: | 7s1 |
| Tiheys @ 20oC: | 1,873 g / cm3 |
Näytä lisää, mukaan lukien: Lämmöt, energiat, hapetus,
Reaktiot, yhdisteet, säteet, johtavuus
| Atomimäärä: | 71,07 cm3 / mol |
| Rakenne: | uskotaan olevan piilokopio: runkokeskeinen kuutio |
| Kovuus: | – |
| Ominaislämpökapasiteetti | – |
| Fuusiolämpö | 2 kJ mol-1 |
| sumutuslämpö | 73 kJ mol-1 |
| höyrystyslämpö | 64 kJ mol-1 |
| 1. ionisaatioenergia | 384 kJ mol-1 |
| 2. ionisaatioenergia | – |
| 3. ionisaatioenergia | – |
| Elektroni-affiniteetti | – |
| Minimihapetusluku | 0 |
| Min. yleinen hapetusnro. | 0 |
| Suurin hapetusluku | 1 |
| Maks. yleinen hapetusnro. | 1 |
| Elektronegatiivisuus (Pauling-asteikko) | 0,7 |
| Polarisoitavuus määrä | 48,7 Å3 |
| Reaktio ilman kanssa | – |
| Reaktio 15 M HNO3: lla | – |
| Reaktio 6 M HCl: n kanssa | voimakas, ⇒ H2, FrCl |
| Reaktio 6 M NaOH: lla | voimakas, ⇒ H2, FrOH |
| oksidi (t) | – |
| hydridi (t) | – |
| kloridi (t) | – |
| Atomisäde | – |
| Ionisäde (1+ ioni) | 194 pm |
| Ionisäde (2+ ionia) | – |
| Ionisäde (3+ ionia) | – |
| Ionisäde (1-ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| Lämmönjohtavuus | 3,61 W m-1 K-1 |
| Sähkönjohtavuus | – |
| Jäätymis- / sulamispiste: | 27 oC, 300 K |

Tämä uraanimalminäyte sisältää noin 100 000 atomia frankium-223: ta (3,3 x 10-20 g). Francium on radioaktiivinen; maapallolla on kulloinkin alle 30 g sitä. Kuvan viite (1)
Franciumin löytäminen
Marguerite Perey löysi Franciumin vuonna 1939, kun hän tutki aktinium-227: n radioaktiivista hajoamista.
Löytö tapahtui Pariisin Curie-instituutissa. Elementti on saanut nimensä löytömaastaan – Ranskasta.
Löytö alkoi vuonna 1935, kun Perey 26-vuotiaana luki tutkimusartikkelin, jossa väitettiin, että amerikkalaiset tiedemiehet olivat havainneet beeta-hiukkasia, joita eritti aktinium, joka hänellä oli normaalia korkeampi energiamäärä.
Perey oli utelias tästä havainnosta, ja koska hän oli jo aktiniumiin liittyvän työn asiantuntija, hän päätti suorittaa omat kokeensa aktiniumilla. Hän tuotti erittäin puhtaan aktiniumnäytteen ja tutki sen säteilyä. Perey huomasi, että noin 1% aktiinien radioaktiivisuudesta johtui siitä, että se lähetti alfahiukkasia, ei beeta-hiukkasia. oma ydin. Muodostunut tytärydin oli aiemmin tuntematon elementti, jonka hän päätti kutsua franciumiksi kotimaansa kunnian kunniaksi.
227Ac → 223Fr + 4He
87 protonilla uusi elementti kuului Jaksollisen järjestelmän ryhmä 1, joka yhdistää viisi muuta alkalimetallia: litium, natrium, kalium, rubidium ja cesium.
Franciumin löytäminen saattoi ihmiskunnan löytöihin luonnossa esiintyviä alkuaineita.
Kaikki sen jälkeen löydetyt alkuaineet on löydetty, kun alkuaine on tuotettu laboratoriossa.

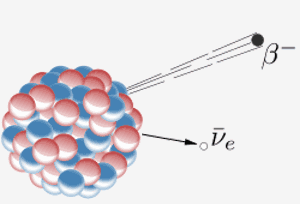
Ydin lähettää beeta-hiukkasen ( elektroni) ja antineutrino. Tämän seurauksena ytimen neutroni muuttuu protoniksi. Kun jaksollisen taulukon elementti 87 (francium) tekee tämän, ylimääräinen protoni tarkoittaa, että siitä tulee elementti 88 (radium).
Ulkonäkö ja ominaisuudet
Haitalliset vaikutukset:
Francium on erittäin radioaktiivinen.
Ominaisuudet:
Francium on raskas, epävakaa, radioaktiivinen metalli, jolla on enintään puoliintumisaika on vain 22 minuuttia. Sen sulamispiste on alhainen (27 oC, 81 oF), ja jos siitä kertyisi riittävästi, se olisi nestemäistä lämpimässä huoneessa.
Francium on toiseksi harvinaisin alkuaine maankuoressa, astatiinin vieressä. Maan päällä on kulloinkin alle kolmekymmentä grammaa frankiumia.
Francium on kaikista alkuaineista pienin elektronegatiivi, joten sen pitäisi olla kemiallisesti reaktiivisin alkalimetalli. Valitettavasti sitä ei ole saatavana riittävinä määrinä osoittamaan, että se reagoi veden kanssa – sitä valmistetaan pieninä määrinä hiukkaskiihdyttimissä. Teoriassa sen reaktio veden kanssa olisi väkivaltaisempaa kuin cesiumin ja hyvin voimakkaampi kuin natriumin.
Franciumia on tutkittu viimeksi New Yorkin Stony Brookin yliopistossa. Siellä tutkijat ansaitsivat jopa kymmenentuhatta frankiumatomia kerrallaan käyttämällä lasersäteitä magneettikentässä mittaamaan niiden ominaisuuksia.
Franciumin käyttötarkoitukset
Frangiumia ei kaupallisesti käytetä, koska se on harvinaista ja epävakaa. Sitä käytetään vain tutkimustarkoituksiin.
Francium Decay
Franciumin isotoopit, joiden massanumerot vaihtelevat välillä 200-232, käyvät yleisimmin alfa- tai beeta-hajoamisessa.
Tässä on vain muutama esimerkki franciumin hajoamispolkuista:
Francium-223 on alkuaineen pisimpään käytetty isotooppi. Sen puoliintumisaika on 22 minuuttia. Se voi lähettää alfa-hiukkasen (heliumytimen) astatiini-219: n muodostamiseksi tai beeta-hiukkasen radium-223: n muodostamiseksi. (Beeta-hiukkanen on elektroni, joka vapautuu ytimestä, kun neutroni muuttuu protoniksi.)
Francium-221: n puoliintumisaika on 5 minuuttia. Se voi lähettää alfa-hiukkasia muodostaen astatiini-217: n tai beeta-hiukkasesta radium-221: n.
Francium-216: n puoliintumisaika on 0,7 mikrosekuntia. Se voi lähettää alfa-hiukkasia muodostaen astatiini-212: n tai positronin radoni-216: n muodostamiseksi.
Francium-212: n puoliintumisaika on 19 minuuttia. Se voi lähettää alfa-hiukkasia astatiini-208: n muodostamiseksi tai siepata orbitaalisen elektronin radoni-212: n muodostamiseksi. (2) (Kiertoradan elektronien sieppauksen aikana ydin sieppaa yhden atomin omista elektroneista ja lähettää neutriinon.)
Runsaus ja isotoopit
Maapallon runsaus: ~ 0 miljoonasosaa , ~ 0 miljoonasosaa
Runsas aurinkokunta: ~ 0 miljardia osaa painosta, ~ 0 miljardia osaa moolina
Puhdas hinta: 100 dollaria per gramma
Kustannukset, irtotavarana: 100 dollaria per gramma
Lähde: Franciumia esiintyy luonnollisesti aktiniumin alfa-radioaktiivisen hajoamisen seurauksena.
Isotoopit: Franciumissa on 33 isotooppia, joiden puoliintumisaika tunnetaan, massanumerolla 200 – 232. Yksikään ei ole stabiili. 223Fr: n puoliintumisaika on pisin 21,8 minuutissa.

- Kuva Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, numero 6.
Lainaa tätä sivua
Kopioi ja liitä jokin seuraavista verkkolinkitykseen:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
tai
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Jos haluat lainata tätä sivua akateemisessa asiakirjassa, käytä seuraava MLA-yhteensopiva lainaus:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.