Immunologian rajat
Johdanto
Preeklampsia on raskausspesifinen sairaus, joka vaikuttaa 3-5% kaikista raskauksista (1, 2). Se ilmenee äskettäin ilmaantuneella verenpainetaudilla 20 viikon raskauden ja proteinurian jälkeen. Istukka on keskeinen taudin patogeneesissä yhdistämällä äiti sikiöön (3). Äidin ja sikiön rajapinta on alue, jossa geneettisesti erilaiset sikiöperäiset kudokset kohtaavat äidin verenkierron, endoteelin ja immuunijärjestelmän. Usein teorioiden taudiksi kutsuttu yleinen käsitys on, että preeklampsia vaikuttaa äidin endoteeliin aiheuttaen häiriöitä endoteelin toiminnassa, mikä johtaa hypertensioon ja proteinuriaan (2). Vakavassa muodossaan preeklampsia voi johtaa sikiön kasvun hidastumiseen, ennenaikaisuuteen, ja äidille se voi aiheuttaa munuaisten ja maksan elinvaurioita sekä eklampsiaa. Lisäksi preeklampsialla voi olla pitkäaikaisia kardiovaskulaarisia seurauksia äidille ja vastasyntyneelle (4). Istukan kehittymistä pidetään riittämätön erityisesti äidin spiraalisen valtimon muutosprosessissa, jossa trofoblastisolut tunkeutuvat äidin puolelle deciduaksi ja muuttavat valtimot matalan vastuksen kanaviksi korvaamalla myös äidin endoteelin (5–7). Tyypillisesti tämä kohdun valtimoiden uudistuminen puuttuu tai on epätäydellistä, etenkin preeklampsian vaikeassa muodossa. Suuri vastustuskyky ahtautuneissa kohdun valtimoissa aiheuttaa turbulentin verenkierron istukan välimäiseen tilaan aiheuttaen oksidatiivista stressiä ja mekaanisia vaurioita istukan villapuille. Tuloksena oleva vaurio lisää mikrohiukkasten ja tulehdusvälittäjien istukan irtoamista, mikä johtaa yleiseen endoteelin aktivaatioon ja toimintahäiriöön (8, 9). Nämä peräkkäiset tapahtumat äidin ja sikiön välisessä rajapinnassa johtavat äidin verenpainetautiin ja muihin edellä kuvattuihin oireisiin. (10, 11). HELLP-oireyhtymälle on ominaista hemolyysi, kohonnut maksaentsyymiarvot ja matalat verihiutaleet. Se vaatii usein tehohoidon tason tarkkailua ja oireenmukaista hoitoa. Oireyhtymän patogeneesi on edelleen varjossa. HELLP-oireyhtymällä on yhteisiä piirteitä tromboottisten mikroangiopatioiden (TMA) kanssa, kuten tromboottinen trombosytopeeninen purppura (TTP) ja hemolyyttinen ureeminen oireyhtymä (HUS). TMA: ita esiintyy erilaisissa sairausryhmissä, joilla on yhteisiä piirteitä mikroangiopaattisesta hemolyysistä, trombosytopeniasta ja mikrotrombiista johtuvista elinten vaurioista. TTP: ssä geneettinen vika tai, kuten valtaosassa tapauksia, hankitut auto-vasta-aineet hajoamista ja metalloproteinaasia vastaan, joilla on tyypin 1 trombospondiinimotiivi 13 (ADAMTS13), entsyymi, joka katkaisee aktivoidun von Willebrandin tekijän (vWF), aiheuttaa epätavallisen suuria muodostuksia aktivoidut vWF-multimeerit endoteelisoluissa, mikä johtaa verihiutaleiden trombooseihin pienissä verisuonissa ja hemolyysiin. Tyypillisen HUS: n aiheuttaa Shiga-toksiinia tuottava bakteeri-infektio (erityisesti Escherichia coli), kun taas epätyypillinen HUS (aHUS) viittaa TMA-tyyppiin, jossa geneettiset puutteet perustuvat komplementtijärjestelmän vaihtoehtoisen reitin säätimiin, jotka laukaisun aiheuttaja voi aiheuttaa kliinisen taudin (12, 13). FDA: n hyväksymä aHUS-hoito on komplementti C5 -antagonistiekkulitsumabin infuusio, joka estää kalvohyökkäyskompleksin (MAC) muodostumisen (kuva 1). Kliinisesti HELLP: llä on samat oireet kuin klassisilla TMA: lla: hemolyysi, trombosytopenia ja maksasairaus. Käytetyn TMA-luokituksen mukaan HELLP-oireyhtymä luokitellaan yleensä osaksi toissijaisia tai hankittuja TMA: ita (taulukko 1).
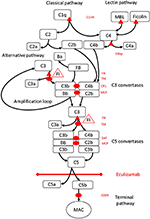
Kuva 1. Ekulitsumabi estää komplementin aktivaation terminaalisen reitin. Komplementtiaktivaatio voidaan käynnistää kolmen aktivointireitin kautta, jotka kaikki johtavat C5-konvertaasien muodostumiseen, joilla on kyky aktivoida pääte, joka johtaa MAC: n muodostumiseen kohdepinnalla. Tämä kaaviokuva komplementtijärjestelmästä näyttää sen merkityksellisimmät aktivaattorit (mustalla kirjasimella) ja estäjät (punaisella). Aktivaattorit voivat olla kalvoon sitoutuneita (soikea) tai liukoisia (kolmio). Vaihtoehtoinen reitti aktivoituu spontaanisti kaikilla pinnoilla, jotka eivät salli estämistä liukoisella säätelykertoimella H (FH). FH toimii kofaktorina C3b: n inaktivaatiolle iC3b: ksi tekijällä I (FI). Trombomoduliini (TM) lisää FH-kofaktorin aktiivisuutta. Lohkottu tekijä B (FB) yhdessä aktivaattorin C3b kanssa muodostaa vaihtoehtoisen reitin konvertaasin, jolla on kyky lohkaista C3 C3b: ksi, mikä luo vaihtoehtoisen reitin aktivaation monistussilmukan.Klassinen komplementtiaktivoitumisreitti voidaan aloittaa esimerkiksi sitoutumalla immuunikomplekseihin C1q: iin, kun taas lektiinireitti aktivoituu mannooseja sitovalla lektiinillä (MBL) tai fikoliinilla, jotka sitoutuvat esimerkiksi mikrobien hiilihydraattimalleihin. Lektiinireitin aktivaatio johtaa mannoosiin liittyvien seriiniproteaasien 1 ja 2 (MASP-1 ja MASP-2, ei kuvassa) pilkkomiseen komplementtikomponentit C4 ja C2 muodostaakseen klassisen reitin konvertaasin C4bC2b. C1-estäjä (C1inh) ja C4bp ovat klassisen reitin liukoisia säätelijöitä, kun taas membraanikofaktoriproteiini (MCP) ja komplementtireseptori 1 (CR1) ovat varhaisen komplementtireitin kalvoon sitoutuneita säätelijöitä. C5-konvertaasien muodostuminen aloittaa komplementin aktivaation ja C5: n pilkkomisen terminaalisen reitin ilman pintaan sitoutuneiden säätimien hajoamisen kiihdytystekijää (DAF) ja MCP: tä. MAC: n kokoonpanoa säätelee pintaan sitoutunut säädin CD59 (protectin). C3: n pilkkominen varhaisissa reiteissä ja C5: n terminaalisessa reitissä vapauttaa anafylatoksiineja C3a ja C5a ja johtaa tulehdukseen. Ekulitsumabi on humanisoitu rekombinanttivasta-aine C5-komplementiproteiinia vastaan, joka estää C5-pilkkoutumista C5-konnaaseilla säätelemällä täten komplementin aktivaation protrombootteja ja proinflammatorisia vaikutuksia. Tässä tapausraportissa kuvatulla potilaalla testattiin geneettisiä mutaatioita geeneissä, jotka koodaavat tekijää H (CFH), FHR5 ja MCP, CFI, CFB, THBD ja ADAMTS13 (ADAMTS13), hyytymiskaskadin vWF-reitin säätelijöitä (ei kuvassa). Geenitestauksen tulokset olivat negatiivisia.

Taulukko 1. HELLP- ja aHUS-diagnoosikriteerit.
Tässä tapaustutkimuksessa ilmoitamme potilas, jolla on monimutkainen raskauden aiheuttama TMA ja onnistunut hoitojakso.
Tapausesitys
Kaksikymmentäyhdeksänvuotias primigravida lähetettiin raskauden ikäisenä 34 + 2 Helsingin yliopiston sairaalaan poliklinikka, jolla on ylävatsakipuja. Aluksi hänen verenpaine oli kohonnut vaatimattomasti (133/91 mmHg) ja virtsan mittatikku oli positiivinen proteiinille. Alun perin ilmoitettu ylävatsakipu parani vähitellen. Ultraäänitutkimuksessa sikiöllä oli normaali biofysikaalinen profiili (BPP), paino-arvio oli -2 SD-käyrällä. Kardiotokografia (CTG) oli normaalia. Veren hemoglobiini (Hb) oli 115 g / l, verihiutaleet 158 E9 / L (normaali alue 150-360 E9 / L), alaniiniaminotransferaasi (ALAT) oli normaali (23 U / L). Virtsan mittatikku oli positiivinen proteiinille (+2) ja laskettu proteinuria oli 1,6 g / 24 h. Kortisonihoito aloitettiin lapsen keuhkojen kypsymisen helpottamiseksi. Potilas vapautettiin suunnitelmalla palata seuraavana päivänä kontrollitarkastukseen ja toinen kortisoniannos. Aikataulun mukaan hän tuli kontrolliin raskausviikoilla 34 + 4. Verenpaine oli 147/87 mmHg, ALT 23, verihiutaleet 177, CTG ja sikiön BPP ultraäänitutkimuksessa oli normaali. Hänet vapautettiin ja uusi tarkastus oli määrä. Saman päivän iltapäivällä ylävatsakipu palasi ja pahensi tasaisesti kohti iltaa. Hän palasi sairaalaan klo 2.20. Hänellä oli kireä ylävatsakipu, levottomuus ja hän oli oksentanut kaksi kertaa ja tuntenut vapinaa. Verenpaine oli selvästi kohonnut 170/94 mmHg: ssä, virtsaproteiinin mittatikku oli voimakkaasti positiivinen, ALAT oli kohonnut 159, Hb 122 ja verihiutaleet 172. Hänet otettiin synnytystä edeltävälle osastolle. Klo 4 aamulla hänellä oli päänsärkyä. Verenpainelääkitys aloitettiin (Labetalol 100 mg kolmesti). Virtsan proteiinien erittyminen saavutti yön korkeimmillaan 13 g / 24 h. Myöhemmin hän aloitti oksentelun, hänellä oli ylävatsakipu, päänsärky ja CTG-seuranta osoitti hidastumista. Potilas siirrettiin kello 7.11 a. Synnytysosastolle ja kun kohdunkaula oli laajentunut kolme senttimetriä, sikiön kalvot murtettiin keinotekoisesti synnytyksen indusoimiseksi. Samaan aikaan laboratoriotestit saatiin päätökseen Hb 122: lla, verihiutaleilla 172. Laktaattidehydrogenaasi (LD) oli kuitenkin selvästi kohonnut 1231 U / l: lla tällä hetkellä. CTG: ssä hidastukset jatkuivat ja bradykardian jatkuessa tehtiin hätäkeisarileikkaus. Uroslapsi (1960 g, −2 SD) syntyi kello 7.25 aamulla napan valtimon pH-arvolla 7,05, BE −6,80, Apgar 1/6/8. Veren menetys leikkauksessa oli 400 ml.
Klo 9 aamulla keisarileikkauksen jälkeen äidin verihiutaleiden määrä oli matalalla 49: llä, Hb oli 102. Iltapäivään mennessä ALAT oli noussut 1800: een, LD 3570 , seerumin kreatiniinitaso oli 153 (μmol / L), kun taas verihiutaleet laskivat 33. Hyytymisessä esiintyi häiriöitä, mikä ilmeni matalana fibrinogeenipitoisuutena (1,1 g / l, viitearvot 2–4 g / l) ja korkeana D – fibriinidimeeri (30,2 mg / l, < 0,5 mg / l) Keisarileikkaushaavasta, johon lisättiin muita ompeleita, oli verenvuotoa.Tällöin annettiin kahdeksan yksikköä verihiutaleita. Kaliumpitoisuus nousi 4,7: stä 5,6: een (mmol / l). Hemolyysi havaittiin selvästi. Coombs-testi oli negatiivinen. Virtsaan erittyi vain 10 ml / h. Laboratoriotesti osoitti selvästi vakavan taudin, jolla oli merkkejä sekä munuais- että maksavaurioista. Lisäksi hyytymisjärjestelmässä oli häiriöitä, jotka osoittivat merkittävää hyytymistä ja merkittävää fibrinolyysiä samanaikaisesti. Magnesiumsulfaatti-infuusio aloitettiin hyperrefleksian takia, jota pidetään kouristusten ennustavana merkkinä, preeklampsian vakavana komplikaationa. 10 mg: n laskimonsisäinen deksametasoni aloitettiin ja potilas siirrettiin tehohoitoyksikköön.
Lisäksi laboratoriotestejä tehtiin muiden lääketieteellisten hätätilanteiden differentiaalidiagnostisiin tarkoituksiin (taulukko 2). ADAMTS13: n aktiivisuus oli normaalia 62% (40–130%), mikä ei sisällä TTP: tä. Seerumin komplementti C3 (0,52 g / L, 0,71–1,41 g / L) ja C4 (0,07 g / L, 0,12–0,34 g / L) olivat vähäisiä. Komplementin liukoisen terminaalisen kompleksin taso (C5b-9, 971 ng / ml, < 366 ng / ml) kohotettiin ensimmäisen synnytyksen jälkeisenä päivänä. Fosfolipidivasta-aineita ei havaittu, hepatiitti B- ja C-infektioserologia ja HIV oli negatiivinen. Ulostenäytteestä tyypillisen HUS: n aiheuttavat taudinaiheuttajat olivat negatiivisia.

Taulukko 2. Taudin diagnostiikan ja hoidon aikataulu.
Potilasta hoidettiin plasmanvaihtohoidolla ensimmäisenä ja toisena synnytyksen jälkeisenä päivänä. ja hemodialysoitiin yhteensä kolme kertaa hoidon aikana (päivät 2, 4 ja 6 synnytyksen jälkeen).
Kolmantena synnytyksen jälkeisenä päivänä potilas oli vakaa ja siirrettiin takaisin naisten sairaalan toipumishuoneeseen. ja oireenmukaista hoitoa jatkettiin. Hypertensiota hoidettiin amlodipiinilla 10 mg kahdesti päivässä ja labetalolilla 200 mg kolmesti päivässä. Neljäntenä synnytyksen jälkeisenä päivänä verihiutaleiden määrän väheneminen jatkui ja potilaalle diagnosoitiin aHUS. aHUS perustuu HELLP-potilaiden spontaaniin toipumiseen, yleensä synnytyksen jälkeisenä kolmantena päivänä, hoito ekulitsumabilla aloitettiin (900 mg laskimoon). he saivat pneumokokkirokotuksen ja profylaktinen antibiootti (penisilliini) aloitettiin. Potilas sai yhteensä neljä viikoittaista ekulitsumabiannosta (900 mg) ja hän alkoi toipua nopeasti. Hän ei tarvinnut lisää hemodialyysia kolmannen hemodialyysin jälkeen kuudennena synnytyksen päivänä (kuva 2). Munuaisten toiminta korjaantui vähitellen, verihiutaleiden määrä kohosi ja hemolyysi ratkesi. Neljä viikkoa synnytyksen jälkeen C3- ja C4-pitoisuus plasmassa normalisoitui.
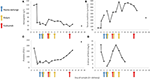
Kuva 2. Taudin alkuvaiheessa havaitut valitut laboratorioarvot sekä plasmanvaihdon, hemodialyysin ja ekulitsumabin antamisen ajoitus. Paneelissa (A) on esitetty veren hemoglobiinimittausten kehitys, paneelissa (B) seerumin kreatiniinitaso, paneelissa (C) verihiutaleiden määrä ja paneelissa (D) fibriiniarvojen D-dimeeri 17 päivän aikana seurantajakso.
Geenitestauksessa ei tunnistettu tunnettuja geenipolymorfismeja. Häntä testattiin mutaatioiden suhteen komplementtiregulaattoreissa, tekijä H (CFH), tekijään H liittyvä proteiini 5 (FHR5) ja kalvokerroinproteiini (MCP), täydentävä vaihtoehtoisen reitin inaktivaattoritekijä I (CFI), vaihtoehtoisen reitin aktivaattoritekijä B (CFB) ) ja seuraavat hyytymiskaskadin komponentit: ADAMTS13, trombomoduliini (THBD) ja solunsisäinen entsyymi, diasyyliglyserolikinaasi E (DGKE), jonka mutaatiot ovat tunnettuja syitä aHUS: lle (14). Lisäksi vasta-aineita tekijää H vastaan ei myöskään havaittu. C4-puutetta ei havaittu.
Yhteenvetona potilaallamme oli vaikea preeklampsia ja hän täytti HELLP-oireyhtymän diagnostiset kriteerit. Vaikka aHUS-geenitestaus pysyi negatiivisena, taudin kliininen kulku (erityisesti vaikea akuutti munuaisvaurio) ja vaste hoitoon (erityisesti ekulitsumabi) viittasivat siihen, että potilaallamme oli raskauden aiheuttama aHUS.
Keskustelu
Edellä kuvatulla primigravidalla diagnosoitiin vaikea preeklampsia, HELLP-oireyhtymä ja raskauden aiheuttama aHUS. Tunnettuja geenimutaatioita, jotka voisivat altistaa aHUS: lle, ei löydetty. TMA-, TTP-, HUS / aHUS- ja sekundaaristen TMA-tyyppien välinen eridiagnoosi on tärkeä. Erityisesti TTP on tunnistettava varhaisessa vaiheessa, koska tautia hoidetaan nopealla päivittäisellä plasmanvaihdolla remissioon asti (15).
Tällä hetkellä laboratoriomenetelmät menetelmät, joilla testataan mahdollisesti aHUS: ta aiheuttavia geneettisiä mutaatioita, pystyvät osoittamaan mutaatioita vain 40–60% aHUS-tapauksista, jättäen mahdollisuuden vääriä negatiivisia tapauksia. Siksi negatiivinen testitulos mutaatioille ei sulje pois todellista aHUS: ta (16).Harvoin aHUS on indusoitu raskauden ja synnytyksen jälkeen. Näissä tapauksissa seuraavien kolmen vuoden aikana ~ 50%: lle kehittyi krooninen munuaissairaus (CKD), jotkut jopa loppuvaiheen munuaissairaus (ESKD). Kun havaittiin geneettisiä mutaatioita, jopa 85%: lle voi kehittyä CKD tai ESKD (17).
On yleisesti hyväksyttyä, että raskauden hypertensiivisissä häiriöissä istukan tulehdus johtaa endoteelin toimintahäiriöön. Jos endoteelin eheys häiriintyy, tämä johtaa komplementin aktivoitumiseen ja hyytymiseen (18). Häiriöidyn äidin endoteelin on myös oletettu vaikuttavan myöhempään ikään äidin sairastuvuuteen, joka liittyy vakavaan preeklampsiaan ja muihin hypertensiivisiin raskauden häiriöihin (2, 19). Vaurioituneen endoteelin on osoitettu toimivan epänormaalisti jopa vuosia sen jälkeen, kun alkuperäiset diagnostiset oireet hävisivät (20–23).
Jopa 46 prosentilla HELLP-potilaista geenimutaatioita on kuvattu vaihtoehtoisen reitin säätimissä. komplementtijärjestelmän (24, 25). Raskauden alkuvaiheessa, kun istukka kehittyy, komplementtijärjestelmän aktivoituminen nähdään kohonneissa Bb-tasoissa seerumissa potilailla, joille myöhemmin kehittyi preeklampsia (26). Komplementtijärjestelmän aktivoitumista on havaittu vaikeassa preeklampsiassa ja HELLP-oireyhtymässä, ja vaikea-asteista preeklampsiaa sairastavien potilaiden virtsassa on havaittu kohonneita terminaalisen kompleksin (C5b-9) tasoja. HELLP-oireyhtymää sairastavilla potilailla komplementtijärjestelmän lisääntynyt aktivaatio osoitettiin toiminnallisilla testeillä ja lisäksi CD55: n ja CD59: n ilmentymisvaikeuksilla, mikä johti heikentyneeseen säätelyyn ja pahensi komplementtijärjestelmän aktivoitumista (27–29).
HELLP-oireyhtymän ja aHUS: n välillä on monia yhtäläisyyksiä. Molemmissa olosuhteissa endoteelin häiriö on selvästi mukana, jota seuraa komplementin ja hyytymisen aktivaatio. Vaikeassa preeklampsiassa ja HELLP-oireyhtymässä vakavan taudin ja TMA: n varhaisissa oireissa annettu ekulitsumabi olisi hyödyllinen munuaisten ja äidin endoteelin suojaamiseksi (30). Endoteelin eheyden säilyttäminen voi mahdollisesti suojata potilasta pitkäaikaisilta terveysriskeiltä, kuten sydän- ja verisuonitauteilta. Tyypillisesti raskauteen liittyvissä TMA-lääkkeissä hemolyysin ja trombosytopenian kliiniset löydökset häviävät ~ 3 päivässä. Jos taudin aktiivisuus kestää kauemmin, differentiaalidiagnostiikkaa on jatkettava ja vasta sitten harkitaan vaihtoehtoista hoitoa (esim. Ekulitsumabi). Ekulitsumabihoidon aloittaminen aikaisemmin hyödyttäisi naisia estämällä munuaisvaurioita ja minimoimalla endoteelin turbulenssin ja systeemisen tulehduksen. Riittävän aikaisin ja vain yhdellä tai kahdella annoksella annettu ekulitsumabi voi mahdollisesti olla riittävä turbulenssin pysäyttämiseen ja tapahtumien kaskadin pysäyttämiseen (31). Toisaalta ekulitsumabi on erittäin kallis lääkitys, mutta toisaalta tehohoitohoidon, plasmanvaihdon, hemodialyysin, mahdollisen munuaisensiirron kustannukset, puhumattakaan emotionaalisista seurauksista äideille ja perheille, ovat edelleen arvioimattomia.
Yhteenvetona voidaan todeta, että potilaamme oli vakavasti sairas, kokenut hemolyysiä, hyytymishäiriöitä, maksavaurioita ja munuaisten vajaatoimintaa, jotka tarvitsivat pääsyä ICU: lle ja hemodialyysi. On mahdollista, että jos ekulitsumabi aloitetaan aikaisemmin, HELLP-oireyhtymän ensimmäisten oireiden perusteella, se on voinut olla hyödyllistä taudin myöhemmässä vaiheessa, mahdollisesti lieventäen munuaisvaurioita ja ehkäistäen siten hemodialyysin ja myöhemmin CKD: n tarvetta. Voisimmeko siis tällä nykyaikaisen immunologisen lääketieteen aikakaudella tehdä enemmän äideille ja perheille kuin vain odottaa ja toivoa parasta?
Eettinen lausunto
Eettistä arviointia ja hyväksymistä ei ollut vaaditaan osallistujien tutkimukseen paikallisen lainsäädännön ja institutionaalisten vaatimusten mukaisesti. Potilaat / osallistujat antoivat kirjallisen tietoon perustuvan suostumuksensa osallistua tähän tutkimukseen.
Kirjoittajan kommentit
AL ja JH-E kehittivät idean käsikirjoitukseen ja kirjoittivat käsikirjoituksen. JH-E ja MH olivat mukana potilaan diagnostisessa ja terapeuttisessa hoidossa. Kaikki kirjoittajat tarkastivat ja muokkaivat käsikirjoitusta ja hyväksyivät sen lopullisen version julkaistavaksi.
Eturistiriita
Kirjoittajat ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P.Haittavat raskaustulokset ja tulevat äidin sydän- ja verisuonisairaudet. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. ” suuret synnytyksen oireyhtymät ”liittyvät syvän istunnon häiriöihin. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systeeminen tulehduksellinen alustus normaalissa raskaudessa ja preeklampsiassa: kiertävien synkytiotrofoblastimikropartikkeleiden rooli. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Synkytiotropoflastista peräisin olevien solunulkoisten rakkuloiden päivitys normaalissa raskaudessa ja preeklampsiassa. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
10. Weinstein L.Hemolyysin oireyhtymä, kohonneet maksaentsyymiarvot ja alhainen verihiutaleiden määrä laskea: vaikea verenpainetauti raskauden aikana. Olen J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Vakavan HELLP-oireyhtymän erottaminen ja tromboottinen mikroangiopatia, tromboottinen trombosytopeeninen purppura ja muut jäljittelijät. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Endoteelitoiminnan heikkeneminen naisilla, joilla on ollut preeklampsia: sydän- ja verisuoniriskin indikaattori. Olen J Physiol Hear Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Henkilökunta AC. Endoteelin toiminta ja kiertävät biomarkkerit ovat häiriintyneet naisilla ja lapsilla preeklampsian jälkeen. Hypertensio. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
23. Stanhewicz AE. Jäljellä oleva verisuonten toimintahäiriö naisilla, joilla on ollut preeklampsia. Olen J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S, et ai. Saksan mutaatiot komplementin vaihtoehtoisella reitillä altistavat HELLP-oireyhtymälle. JCI-näkemys. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, uuden potentiaalisen hoidon akuuttiin munuaisvaurioon, joka liittyy preeklampsiaan / HELLP-oireyhtymään. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed-tiivistelmä | CrossRef-kokoteksti | Google Scholar