Kadmiumelementin tosiseikat
Kemiallinen alkuaine kadmium luokitellaan siirtymämetalliksi. Sen löysi vuonna 1817 Friedrich Stromeyer.

Tietovyöhyke
| Luokitus: | kadmium on siirtymämetalli |
| Väri: | sinivalkoinen |
| Atomipaino: | 112.41 |
| Tila: | kiinteä |
| Sulamispiste: | 321,1 oC, 594,3 K |
| Kiehumispiste: | 765 oC, 1038 K |
| Elektronit: | 48 |
| Protonit: | 48 |
| Neutronit runsaimmalla isotoopilla: | 66 |
| elektronikuoret: | 2,8,18,18,2 |
| Elektronikonfiguraatio: | 4d10 5s2 |
| Tiheys @ 20 ° C: | 8,65 g / cm3 |
Näytä lisää, mukaan lukien: Lämmöt, Energiat, Hapetus, Reaktiot,
Yhdisteet, Säteet, Johtokykyä
| Atomimäärät: | 13,1 cm3 / mol |
| Rakenne: | hcp: kuusikulmainen tiivis pakattu |
| Kovuus: | 2.0 mohs |
| Ominaislämpökapasiteetti | 0,23 J g-1 K-1 |
| Fuusiolämpö | 6,122 kJ mol-1 |
| sumutuslämpö | 112 kJ mol-1 |
| höyrystyslämpö | 99,87 kJ mol-1 |
| 1. ionisaatioenergia | 867,7 kJ mol-1 |
| 2. ionisaatioenergia | 1631,4 kJ mol-1 |
| 3. ionisaatioenergia | 3616,2 kJ mol-1 |
| Elektroni-affiniteetti | – |
| Minimihapetusluku | 0 |
| Min. yleinen hapetusnro. | 0 |
| Suurin hapetusluku | 2 |
| Maks. yleinen hapetusnro. | 2 |
| Elektronegatiivisuus (Pauling-asteikko) | 1,69 |
| Polarisoitavuus määrä | 7,2 Å3 |
| Reaktio ilman kanssa | mieto, w / ht ⇒ CdO |
| Reaktio 15 M HNO3: n kanssa | mieto ⇒ Cd (NO3) 2, NOx |
| Reaktio 6 M HCl: n kanssa | mieto, ⇒ H2, CdCl2 |
| Reaktio 6 M NaOH: lla | ei mitään |
| oksidi (s) | CdO, CdO2 |
| Hydridi (t) | CdH2 |
| Kloridi (t) | CdCl2 |
| Atomisäde | 151 pm |
| Ionisäde (1+ ioni) | – |
| Ionisäde (2+ ionia) | 109 pm |
| Ionisäde (3+ ionia) | – |
| Ionisäde (1-ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| rmal johtavuus | 96,6 W m-1 K-1 |
| Sähkönjohtavuus | 14,7 x 106 S m-1 |
| Jäätymis- / sulamispiste: | 321,1 oC, 594,3 K |

Pieni kadmiummetallipallo, jossa kolikko kokoviitteeksi.

Friedrich Stromeyer, joka löysi kadmiumin vuonna 1817.
Kadmiumin jaksollisen taajuuden alue
| ryhmä 11 |
Ryhmä 12 | Ryhmä 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 CD |
49 Sisään |
| 6 | 79 Au |
80 Hg |
81 Tl |
Kadmiumin löytäminen
Saksalainen kemisti Friedrich Stromeyer löysi kadmiumin vuonna 1817 sinkkioksidin epäpuhtaudesta. (1)
Stromeyer teki löydön saatuaan hallituksen pyynnön tarkastaa apteekit Hildesheimin kaupungissa Saksassa.
Tuolloin sinkkioksidia käytettiin, kuten edelleen, ihosairauksien hoitoon. Jostain syystä Hildesheimin apteekit myivät sinkkikarbonaattia pikemminkin kuin tavallista sinkkioksidia.
Stromeyer oli tietoinen siitä, että sinkkikarbonaatin lämmittäminen punaiseksi muuttaisi sen oksidiksi. Hän teki tämän apteekkien näytteillä. Hän havaitsi, että loistava valkoinen karbonaatti muuttui oksidiksi, jonka olisi pitänyt olla valkoinen, mutta itse asiassa keltainen / oranssi.
Normaalisti tämä väri viittaa raudan tai lyijyn saastumiseen, mutta Stromeyer ei löytänyt jälkiä. näistä.
Hän vieraili Salzgitterin tehtaalla, josta apteekit olivat ostaneet sinkkikarbonaattia. Hän kysyi, miksi he myivät sinkkikarbonaattia tavallisen oksidin sijaan.
Johtaja selitti hänelle, että heidän sinkkikarbonaatti oli odotettu väri – valkoinen – ja sitä oli helppo myydä.
Kun he yrittivät muuttaa karbonaatin oksidiksi kuumentamalla, se muuttui aina keltaiseksi. Koska sinkkioksidin pitäisi olla valkoista, he eivät voineet myydä sitä. He olivat analysoineet sen huolellisesti rautakontaminaation suhteen, mutta eivät löytäneet yhtään.
Sitten Stromeyer päätti analysoida tämän keltaisen sinkkioksidin huolellisesti itse. Hänen mielestään keltainen väri johtui ”erikoisen metallioksidin läsnäolosta, jonka olemassaoloa ei ollut toistaiseksi epäilty”.
Hän otti tämän uuden metallioksidin sinkkioksidista ja pelkisti sen eristääkseen maailman ensimmäisen kadmiummetallin. Hän verrasi sen ulkonäköä platinaan ja mitasi sen tiheydeksi 8,75 g / cm3 – hyvin lähellä nykypäivää hyväksytty arvo.
Hän teki lisätyötä ja huomasi, että myös muut sinkkiyhdisteet sisälsivät hänen uutta metallia. Hän analysoi ’puhdasta’ sinkkimetallia ja huomasi, että hänen uusi metallinsa oli läsnä myös tässä.
Hän arvioi, että uutta metallia oli 0,1% – 1% sinkissä ja sen yhdisteissä, joista hän pystyi eristämään 3 grammaa puhdasta kadmiummetallia.
Stromeyer ehdotti kadmiumin nimeä cadmian jälkeen latinankielinen nimi kalamiinille. Kalamiini on vanha nimi sinkkimalmille.
Saksalainen kemisti Karl Hermann löysi kadmiumin itsenäisesti vuonna 1818. Hermann oli huomannut odottamattoman keltaisen värin sinkkisulfidissa. Keltaisen oletettiin olevan arseenin epäpuhtauksia, mutta Hermann tajusi, että se johtui aiemmin tuntemattomasta eleestä mentti. (2)


Kadmiumtelluridista valmistetaan ohutkalvoisia aurinkokennoja, jotka voivat absorboi yli 90% näkyvästä valosta. Kuva: NREL
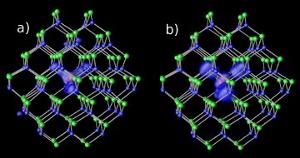
Kadmiumin ja seleenin nanokiteiden magnesium epäpuhtaudet kahdella eri aukkotasolla : (a) resonanssi ja (b) hybridi. Kuva: NERSC
Ulkonäkö ja ominaisuudet
Haitalliset vaikutukset:
Kadmium ja sen yhdisteet ovat erittäin myrkyllisiä.
Ominaisuudet:
Kadmium on pehmeää, muokattavaa, sitkeää, sinivalkoista metallia, joka voidaan helposti leikata veitsellä. Se on erinomainen sähköjohdin ja kestää hyvin korroosiota ja kemikaalien vaikutusta.
Se on kemiallisilta ominaisuuksiltaan monilta osin samanlainen kuin sinkki.
Kadmium tahraa ilmassa ja on liukenee happoihin, mutta ei alkaliin.
Metalli palaa ilmassa muodostaen ruskean kadmiumoksidin (CdO).
Kadmiumin käyttö
Kadmiumin pääasiallinen käyttö on paristoissa (erityisesti ladattavat nikkeli-kadmium-, NiCad-, paristot).
Pienen kitkakertoimen ja korkean väsymiskestävyyden vuoksi kadmiumia käytetään laakereiden seoksissa. Kadmiumia käytetään matalasti sulavissa seoksissa ja se on osa monenlaista juotetta. Sitä käytetään myös galvanoinnissa.
Kadmiumia sisältäviä yhdisteitä käytetään mustavalkoisissa televisiofosforissa ja sini- ja vihreissä fosforeissa väritelevisio-kuvaputkissa. Kadmiumsulfidia käytetään keltaisena pigmenttinä ja kadmiumselenidiä punaisena pigmenttinä, jota usein kutsutaan kadmiumpunaiseksi. aurinkokennojen tuotanto. Ne ovat suhteellisen edullisia ja niiden melkein täydellinen aukko aurinkoenergian keräämiseen.
Runsaus ja isotoopit
Runsaasti maankuorta: 150 paino-osaa miljardia, moolina 30 miljardia osaa
Runsas aurinkokunta: 6 paino-osaa miljardia, moolia kohti 70 biljoonaa osaa moolia kohti
Puhdas hinta: 46 dollaria / 100 g
Kustannus, irtotavarana: 0,77 dollaria 100 grammaa kohti
Lähde: Kadmiumia esiintyy useimmiten pieninä määrinä, jotka liittyvät sinkkimalmeihin, kuten sphaleriittiin (ZnS). Greenockite (CdS) on ainoa kadmiummineraali, jolla on mitään seurauksia. Lähes kaikki kadmium saadaan sivutuotteena sinkin, kuparin ja lyijymalmin puhdistustoiminnoissa.

- Friedrich Stromeyer, Annals of Philosophy, toimittanut Thomas Thomson, osa XIII, 1819, Robert Baldwin, s.108
- JW Mellor, kokonaisvaltainen tutkielma epäorgaanisessa ja teoreettisessa kemiassa, osa IV, 1929, Longmans, Green and Co. Ltd., s. 404 , kopioi ja liitä yksi seuraavista:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
tai
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
mainitse tämä sivu akateemisessa asiakirjassa, käytä seuraavaa MLA-yhteensopivaa viittausta:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.