Lehdet | Politiikka | Lupa-gastroenterologian tutkimus
Mahalaukun suoliston metaplasian ennustettavuus pilkullisella patchy-punoituksella, joka näkyy endoskoopilla
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf. Tokio, Japani
b Kliinisen tutkimuksen ja informatiikan osasto Kansainvälisen kliinisen tutkimuskeskuksen tutkimuslaitos, NCGM, Tokio, Japani
Sisätautien osasto, Kosinin yliopiston lääketieteellinen korkeakoulu, Busan, Korea – Gastroenterologian ja hepatologian osasto, Wakayaman lääketieteellinen yliopisto, Wakayama, Japani – eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokio, Japani
fGastroenterologian ja hepatologian osasto, NCGM, Kohnodai Hospital, Chiba, Japani
gVastaava tekijä: Naoyoshi Nagata, Department of G astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokio 162-8655, Japani
Käsikirjoitus hyväksytty julkaistavaksi 26. syyskuuta 2011
Lyhyt otsikko: Suoliston metaplasian endoskooppinen diagnoosi
doi: https://doi.org/10.4021/gr357w
- Tiivistelmä
- Johdanto
- Menetelmät
- Tulokset
- Keskustelu
| Tiivistelmä | ▴Top |
Tausta: Suoliston metaplasiaa (IM) pidetään pahanlaatuisena leesiona. IM: n endoskooppista diagnoosia on kuitenkin pidetty vaikeaksi. Endoskopian avulla löysimme ainutlaatuisen punoituskuvion ”Mottled Patchy Erythema (MPE)”, johon sisältyy vaikea IM. Helicobacter pylori (Hp) -infektio itsessään voi aiheuttaa punoitusta, mikä heijastaa mahalaukun limakalvon histologisia muutoksia. Siksi otimme Hp: n hävittämisen käyttöön. Potilaat vahvistavat MPE: n ja patologisten löydösten välisen suhteen.
Menetelmät: Otimme mukaan kroonista gastriittia sairastavia potilaita, joille tehtiin Hp: n onnistunut hävittäminen vähintään 6 kuukautta ennen tutkimusta. Kun kohtaamme MPE: n endoskopialla, teimme biopsian sekä MPE-paikasta että muusta kuin MPE-kohdasta. Ei-MPE-kohta määriteltiin vierekkäiseksi limakalvoksi, joka sijaitsee 3 cm: n päässä MPE-kohdasta. Kaikki biopsianäytteet arvioitiin immunohistokemiallisesti IM-alatyypille käyttäen MUC2-, MUC5AC-, MUC6-, CD10- ja CDX2-tahrat. IM-aste määriteltiin päivitetyn Sydney-järjestelmän mukaisesti. Laskettiin patologisen IM: n MPE-löydösten diagnostinen tarkkuus. Myös MPE: n ja IM-alatyypin välinen suhde arvioitiin.
Tulokset: Yhteensä 102 potilasta valittiin tutkimukseen. Näistä 55 (54%) potilaalla oli MPE. Biopsianäytteet otettiin MPE-paikoista ja muut kuin MPE-kohdat näistä 55 potilaasta. IM-prosenttiosuudet ja IM-mediaanipisteet olivat molemmat merkittävästi korkeammat MPE-kohdissa (P < 0,001) kuin ei-MPE-paikoissa. MPE: n herkkyys ja spesifisyys histologisen IM: n havaitsemisessa olivat vastaavasti 72,7% ja 84,1%. Mitään merkittäviä assosiaatioita ei havaittu MUC2: n, MUC5AC: n, MUC6: n, CD10: n ja CDX2: n ilmentämisessä MPE-kohtien ja muiden kuin MPE-kohtien välillä. IM-alatyyppien suhteissa (täydellinen / epätäydellinen) ei ollut merkittäviä eroja kahden ryhmän välillä.
Johtopäätökset: MPE on hyödyllinen endoskooppinen havainto histologisen IM: n havaitsemiseksi ilman kromoendoskooppia ja suurentavaa endoskooppia. Pikaviestien alatyyppiä on kuitenkin vaikea tunnistaa. Hp: n hävittämisen aikakaudella MPE: stä voi tulla ennustava löydös mahasyövän riskille.
Avainsanat: Suoliston metaplasia; Premalignantti vaurio; Endoskooppinen löytö; Punoitus; Valkoisen valon endoskopia; Alatyyppi, hävittäminen; Helicobacter pylori
| Johdanto | ▴Yläosa |
Uskotaan, että mahasyövän kehittymiseen liittyy monivaiheinen prosessi, mukaan lukien Helicobacter pylori (Hp) -infektio, krooninen gastriitti, rauhasatrofia, suoliston metaplasia (IM) dysplasia. Immuunijärjestelmän ja mahalaukun atrofiaa pidetään yhdessä suolistotyyppisen mahasyövän kehittymisen riskitekijöinä, ja niiden katsotaan olevan pahanlaatuisia vaurioita.Mahalaukun atrofia voidaan tunnistaa endoskopialla ja korreloi histologisen arvioinnin kanssa. IM: n diagnosoinnin käyttämällä tavallista valkoisen valon endoskopiaa on pidetty vaikeaksi, koska IM: llä ei ole eroja väreissä ja sen esiintyminen useina litteinä vaurioina.
Äskettäin , havaitsimme, että ainutlaatuinen punoittava löydös endoskopiassa oli havaittavissa myös Hp: n hävittämisen jälkeen. Kuvailemme tätä havaintoa nimellä ”pilkullinen täplikäs punoitus (MPE)”. MPE voidaan tunnistaa useina tasaisina tai hieman masentuneina punoittavina vaurioina tavallisessa valkoisen valon endoskopiassa; patologisesti se sisältää vakavan IM: n. Hp-infektio itsessään voi aiheuttaa punoitusta, joka näkyy endoskopialla, mikä heijastaa histologisia muutoksia, kuten tulehdussolujen tunkeutumista ja turvotusta. otimme mukaan potilaat, joille tehtiin Hp: n hävittäminen vahvistamaan MPE: n ja patologisten löydösten välinen suhde.
| Menetelmät | ▴Top |
Potilaan valinta
Kroonista gastriittia sairastavat potilaat, joille tehtiin Hp: n onnistunut hävittäminen vähintään kuusi kuukautta ennen tutkimusta, kirjattiin prospektiivisesti tutkimukseen National Health and Medicine (NCGM) -keskukseen tammikuun 2008 ja joulukuun 2008 välillä. Tähän ei sisältynyt ei-steroidisten tulehduskipulääkkeiden (NSAID), antasidien ja antitromboottisten lääkkeiden käyttöä 4 viikkoa ennen endoskopiaa. Poissuljettiin myös potilaat, joilla on ollut mahahaava, verenvuototauti, maksakirroosi, munuaisten vajaatoiminta, sydämen vajaatoiminta ja varhainen tai edennyt mahasyöpä. Osallistujat saivat kirjallisen tietoon perustuvan suostumuksen Helsingin julistuksen ja sen myöhemmän tarkistuksen mukaisesti. NCGM: n eettinen komitea hyväksyi tutkimusprotokollan.
Helicobacter pylorin hävittäminen
Potilailla, joilla on Hp-infektion aiheuttama krooninen gastriitti ja mahahaava, tehtiin hävittämishoito. Potilaita hoidettiin seitsemän päivän hoito-ohjelmalla, joka sisälsi amoksisilliinia, klaritromysiiniä ja protonipumpun estäjää (PPI) kahdesti päivässä, mikä oli Japanissa hyväksytty tavallinen ensilinjan hoito. Jos hävittäminen ei onnistunut, annettiin toinen hoito, joka koostui amoksisilliinista, metronidatsolista ja PPI: stä. Hävittäminen vahvistettiin mahan biopsioiden negatiivisella histologisella tutkimuksella sekä negatiivisella 13C-urean hengitystestillä (13C-UBT) 2-3 kuukautta hävittämishoidon päättymisen jälkeen. Kun kaikki testit olivat negatiivisia, potilas määriteltiin negatiiviseksi Hp-infektiolle.
Endoskooppinen arviointi
Potilaille tehtiin endoskooppinen tutkimus vähintään 6 kuukautta Hp: n hävittämisen jälkeen. Käytimme korkean resoluution endoskooppia ilman suurennusta (Olympus-videoskooppi, malli GIF-H260) tarkkailemaan MPE: n esiintymistä mahalaukun limakalvossa. Määritelimme MPE: n useiksi tasaisiksi tai hieman masentuneiksi punoituksellisiksi vaurioiksi, jotka olivat erotettavissa ruuhkaistuneesta limakalvosta, verenvuodosta, angioektaasiasta, täplipunaisesta ja lineaarisesta punoituksesta (kuvat 1A, B). Erotimme myös MPE: n ja punertavan limakalvon, kun uusiutuvassa epiteelissä oli haava tai haava.
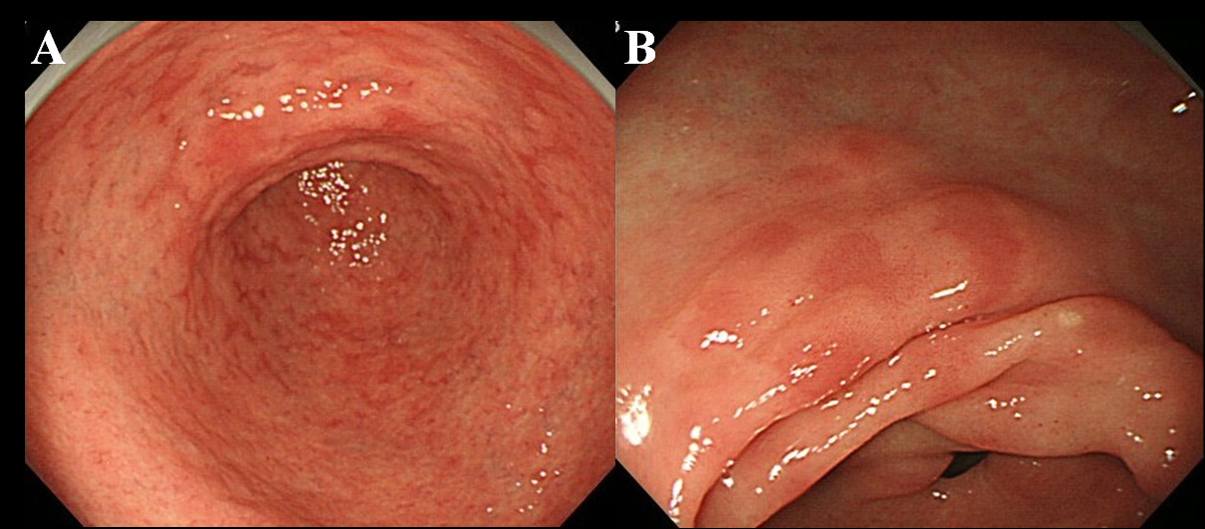 Suurenna kuva napsauttamalla |
Kuva 1. MPE: n endoskooppinen löytö. (A) Useita ja tasaisia punoituksia antrumissa; (B) Tasainen ja masentunut punoitus antrumin pienemmässä kaarevuudessa. |
Kun kohdattiin löydös MPE-löydöksestä endoskopialla, teimme sekä MPE-sivuston että muun kuin MPE-sivuston biopsian. Ei-MPE-kohta määriteltiin vierekkäiseksi limakalvoksi, joka sijaitsee 3 cm: n päässä MPE-kohdasta (kuva 2).
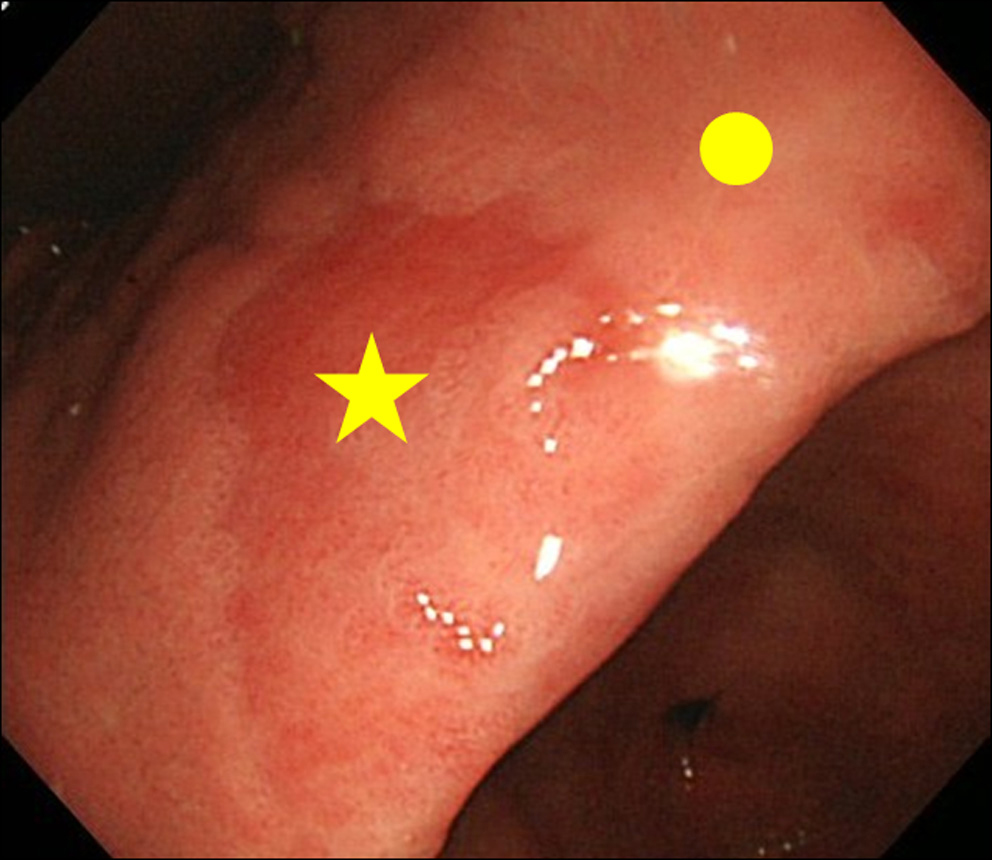 Suurenna kuva napsauttamalla |
Kuva 2. Biopsiatyöpaikka. (★) MPE: n biopsiapaikka; (•) Ei-MPE: n biopsiakohta. Muu kuin MPE-kohta määriteltiin vierekkäiseksi limakalvoksi, joka sijaitsee 3 cm: n päässä MPE-kohdasta. |
Atrofisen rajan laajuus jaettiin kolmeen vaiheeseen: lievä, kohtalainen ja vaikea, kuten Kimura ja Takemoto määrittelivät.
Histologinen arviointi
Biopsianäytteet lähetettiin laboratorioon, kiinnitettynä 10% puskuroituun formaliiniin. Näytteet käsiteltiin, upotettiin parafiiniin ja leikattiin 4 um: n osiin. Kunkin näytteen diat värjättiin käyttämällä hematoksyliini-eosiinia (HE) (kuvio 13A) ja immunohistokemiallinen värjäys. Immunohistokemialliset tahrat sisälsivät seuraavat: (1) MUC2, suoliston mukiinin markkeri, joka on hyödyllinen pikarisolujen havaitsemiseksi (kuva 3B), (2) MUC5AC, mahamutsiinin markkeri, joka ilmentyy limakalvon kaulan soluissa ja foveolaarinen epiteeli (kuva 3C), (3) MUC6, mahamutsiinin markkeri, joka ilmentyy kehon kaulan alueen limakalvosoluissa ja antrumin pylorisissa rauhasissa (kuva 3D), (4) CD10, a käyttökelpoinen markkeri ohutsuolen harjasreunan havaitsemiseksi (kuvio 3E) ja (5) CDX2, markkeri IM: n läsnäololle (kuvio 3F). Käytimme CDX2: ta, koska viimeaikaiset tutkimukset ovat osoittaneet, että CDX2: n ilmentymistä voitiin havaita laajasti IM-rauhasissa, eikä se hävinnyt Hp: n hävittämisen jälkeen. IM: n läsnäolo vahvistettiin sekä HE- että immunohistokemiallisella värjäyksellä.
IM: n alatyypit luokiteltiin täydellisiin tai epätäydellisiin tyyppeihin. Täydellinen tyyppi määriteltiin mahamutsiinin (MUC5AC tai MUC6) vähentyneenä ilmentymänä ja suolistomutsiinin (MUC2) ja CD10: n yhteisekspressiona (kuvat 3A-F). Puutteellinen tyyppi määriteltiin mahamutsiinin (MUC5AC tai MUC6) ja MUC2: n ilmentymänä. Koska ei ole olemassa vakiintuneita ehtoja luokitella tapaus siten, että sekä täydelliset että epätäydelliset tyypit olisivat yhdessä osassa, määritimme pikaviestien alatyypit yleiseksi tyypiksi.
Pikaviestit pisteytettiin päivitetyn Sydney-järjestelmän perusteella (0: ei mitään, 1: lievä, 2: kohtalainen, 3: merkitty).
Tilastollinen analyysi
Jaoimme potilaat kahteen ryhmään sen perusteella, olivatko potilaat positiivisia vai negatiivisia MPE: lle. Käytimme Studentin t-testiä iän ja hävittämisjakson vertaamiseen. Chi-neliötestiä tai Fisherin tarkkaa todennäköisyystestiä käytettiin sukupuolisuhteisiin ja endoskooppisen atrofian asteeseen kahdessa ryhmässä.
Verrattiin myös histologisia havaintoja MPE-sivustojen ja muiden kuin MPE-sivustojen välillä. Vertaaksemme kahden biopsiakohdan välisiä eroja käytimme Wilcoxon Matched-Pairs Signed-Ranks -testiä IM: lle mediaanipisteet ja Fisherin tarkka testi IM-, IM-alatyyppien ja IM-fenotyyppien esiintyvyydelle.Laskettiin endoskoopilla havaitun MPE: n herkkyys-, spesifisyys-, positiiviset ja negatiiviset ennustearvot sekä positiivisen ja negatiivisen todennäköisyyden suhteet patologisen IM: n havaitsemiseksi. P-arvoja < 0,05 pidettiin merkittävinä. Kaikki tilastolliset analyysit tehtiin Stata-ohjelmistolla, versio 10 (StataCorp LP, College Station, TX, USA).
| Tulokset | ▴Top |
Potilaan ominaisuudet
Tutkimusjakson aikana 157 potilasta potilaat, joille tehtiin ylempi endoskooppi ja jotka saivat Hp-hävittämisen, tarkistettiin. Poistettiin 52 potilaasta 157: stä analyysistä minkä tahansa seuraavien kriteerien suhteen: antasidien (31), antitromboottisten lääkkeiden (17) tai NSAID-lääkkeiden (3) käyttö; tai maksakirroosi (5), sydämen vajaatoiminta (1) tai varhainen mahasyöpä (2). Joihinkin potilaisiin sovellettiin useampaa kuin yhtä poissulkemiskriteeriä.
Yhteensä 102 potilasta valittiin analysoitavaksi poissulkemisen jälkeen. Näistä MPE-potilaita oli 55 (54%). MPE-positiivisten ja -negatiivisten potilaiden keskimääräisessä iässä ja sukupuolessa ei havaittu merkittäviä eroja (taulukko 1). Kahden ryhmän välillä ei ollut merkittäviä eroja Hp: n hävittämisjakson jälkeen. Suuremman vakavuuden omaava mahalaukun atrofia (kohtalainen tai vaikea) esiintyi kuitenkin huomattavasti useammin MPE-positiivisessa ryhmässä verrattuna MPE-negatiiviseen ryhmään (positiivinen 65,6% verrattuna negatiiviseen 45,0%, P = 0,035).
 Napsauta nähdäksesi |
Taulukko 1. Potilaiden demografiset ominaisuudet (n = 102) |
Endoskooppiset löydöt ja patologiset piirteet
 Näytä napsauttamalla |
Taulukko 2. Pikaviestipisteiden vertailu MPE: n ja muiden kuin MPE-sivustojen välillä (n = 55) |
MUC2: n, MUC5AC: n, MUC6: n, C: n ilmentämisessä ei havaittu merkittäviä assosiaatioita D10 ja CDX2 MPE-sivustojen ja muiden kuin MPE-sivustojen välillä (taulukko 3). IM-alatyyppien suhteissa (täydellinen / epätäydellinen) ei ollut merkittävää eroa kahden ryhmän välillä (MPE: 18/30 vs. ei-MPE: 8/10, P = 0,778).
 Napsauta nähdäksesi |
Taulukko 3. Suoliston metaplasian fenotyypit ja alatyypit |
| Keskustelu | ▴Top |
Tässä tutkimuksessa keskityimme ainutlaatuiseen punertavaan ulkonäköön, joka nähtiin endoskopialla Hp: n hävittämisen jälkeen. Kutsuimme tätä havaintoa ”MPE: ksi” ja havaitsimme, että endoskopialla havaittu MPE: n esiintyminen oli tyypillistä patologiselle IM: lle.
IM-diagnoosi tavanomaisella endoskopialla on Kaminishi et ai. ilmoitti ”tuhkanvärisenä nodulaarimuutoksena” IM: n indikaattorina; näiden tutkijoiden havaintojen tarkkuus oli korkea, spesifisyys oli 98-99%, mutta herkkyys oli matala (6-12%). Kaminishi et ai. Totesivat, että tavanomainen endoskopia on vähemmän hyödyllinen IM-diagnoosin vahvistamiseksi. Viimeaikaiset tutkimukset ovat koskeneet IM: n endoskooppista löytämistä suurentavaa endoskopiaa käyttämällä. On raportoitu, että metyleenisinisen kromoendoskoopin avulla havaitut mahan kuoppien erottavat löydökset ja konfokaalisella endoskopialla havaittu ”villuksen kaltainen ulkonäkö” ovat olleet hyödyllisiä IM: n diagnosoimiseksi. Uedo et al. LBC) on tarkka merkki IM: n läsnäolosta, kuten nähdään kapeakaistaisen kuvantamisen (NBI) suurentavalla endoskopialla. Korkeat laitekustannukset ja lisätaidot ja aika, jotka tarvitaan tarkempaan tutkimiseen esimerkiksi NBI: n tai endoskoopin suurentamisen avulla, seulonta tällä laitteella ei kuitenkaan ole käytännöllistä päivittäisessä kliinisessä käytännössä. Lisäksi on suurempi riski vahingoittaa DNA: ta ruoansulatuskanavan limakalvossa, kun käytetään kromoendoskooppia metyleenisinisellä ja sen jälkeen valkoisella valolla, mikä vaatii varovaisuutta sen käytössä. Siksi on edullisempaa diagnosoida IM, kun löydetään MPE ilman kromoendoskooppia ja suurentavaa endoskopiaa. Tutkimustuloksemme viittaavat siihen, että IM: n läsnäolo voidaan diagnosoida tavanomaisella endoskopialla ilman biopsiaa.
Miksi MPE: tä voidaan havaita myös Hp: n hävittämisen jälkeen? Tämä voi johtua mahalaukun limakalvon histologisista muutoksista. Hävittämisen jälkeisiin merkittäviin histologisiin muutoksiin sisältyy parannuksia tulehdussolujen tunkeutumisessa, epiteelin hyperplasia ja turvotus. Parantuneiden erytematoosisen ja edematoosisen limakalvon endoskooppiset kuvat heijastavat näitä histologisia muutoksia. Siksi oletamme, että MPE koostuu jäljellä olevasta pysyvän erytematoosisen IM: n alueesta ja nopeasti palautuneesta ei-IM-alueesta, joka johtuu onnistuneesta Hp: n hävittämisestä. Hp: n hävittäminen aiheutti suurimpien sallittujen alueiden ja muiden alueiden välisen kontrastin selkeytymisen. Ei kuitenkaan tiedetä, miksi vain MPE-kohta havaitaan punoittavana limakalvona. Voidaan todennäköisesti päätellä, että erittäin tiheä mikrouunien alue ympäröi metaplastisia rauhasia; tätä ei ole selvitetty tässä tutkimuksessa. Lisäksi MPE-pistemäärä MPE-sivustolla oli merkittävästi korkeampi kuin MPE-alueen ulkopuolisen pistemäärän. Oletamme, että punoittavan limakalvon ulkonäkö liittyy monien metaplastisten rauhasten esiintymiseen.
Tämä tutkimus osoitti, että IM: n täydellinen alatyyppi esiintyi pääasiassa mahalaukun limakalvossa. . IM: n alatyypit on luokiteltu joko täydelliseen tai epätäydelliseen tyyppiin; nämä ovat yleisimmin käytettyjä alatyyppejä. Useat tutkimukset ovat osoittaneet, että täydellisellä tyypillä ei ole lisääntynyttä riskiä karsinooman kehittymiselle, kun taas epätäydellinen tyyppi liittyy lisääntyneeseen pahanlaatuisen transformaation riskiin. Alatyyppien ja mahasyövän riskin välistä yhteyttä ei kuitenkaan hyväksytä laajalti. Tällä hetkellä jommankumman alatyypin tunnistaminen on vaikeaa tavanomaisella endoskopialla.
On raportoitu, että Hp: n hävittämishoito estää tehokkaasti sekä maha-suolikanavan haavaumia että mahasyövän kehittyminen. Nämä Hp-hävittämishoidon käyttötarkoitukset tulevat todennäköisesti esiin kliinisessä käytännössä lähitulevaisuudessa. Mahalaukun syövän kehittymisen riskiä on kuitenkin varottava Hp: n hävittämisen jälkeen. Hävittämisen jälkeisen mahasyövän ominaisuuksien on raportoitu sisältävän patologisesti vakavan IM: n korpuksessa ja vakavan mahalaukun atrofian endoskopialla havaitulla tavalla. Siksi on välttämätöntä tarkkailla IM: n läsnäoloa huolellisesti jopa Hp: n hävittämisen jälkeen.Kliinisessä käytännössä olisi hyödyllistä pystyä diagnosoimaan patologinen IM ilman kromoendoskooppia tai suurentavaa endoskopiaa. MPE: stä voi tulla ennustava löydös mahasyövän riskille Hp: n hävittämisen aikakaudella.
Kiitokset
Kiitämme tohtori Hidenobu Watanabea ja tri Hiroyoshi Otaä heidän neuvontapalveluistaan tässä tutkimuksessa, joka koskee patologisia arviointeja. Kiitämme kliinisen tutkimuksen koordinaattoria Hisae Kawashiroa avusta tiedonkeruussa.
Apuraha
Tätä työtä tuki maailmanlaajuisen terveys- ja lääketieteellisen keskuksen apuraha (21-108).
Eturistiriidat
Kirjoittajat ilmoittavat, ettei heillä ole eturistiriitoja.
| ▴Yläosa |
- Correa P.Ihmisen mahalaukun karsinogeneesi: monivaiheinen ja monitahoinen prosessi – First American Cancer Society Award Lecture on Cancer Epidemiologia ja ehkäisy. Cancer Res. 1992; 52 (24): 6735 – 6740.
julkaistu - Leung WK, Sung JJ. Katsausartikkeli: suoliston metaplasia ja mahalaukun karsinogeneesi. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
julkistettu doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K et ai. Helicobacter pylori -infektio ja mahasyövän kehittyminen. N Engl J Med. 2001; 345 (11): 784 – 789.
pubmed doi - Kimura K, Takemoto T. Atrofisen rajan ja sen merkityksen endoskooppinen tunnistus kroonisessa gastriitissa. Endoskooppi. 1969; 1: 1 – 3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H et ai. Biopsiapaikat, jotka soveltuvat Helicobacter pylori -infektion diagnosointiin ja atrofisen gastriitin laajuuden arviointiin. Olen J Gastroenterol. 1998; 93 (4): 569 – 573.
julkistettu doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A et ai. Kroonisen gastriitin endoskooppinen luokitus perustuu Gastritis-tutkimusyhdistyksen pilottitutkimukseen. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M et ai. Mahalaukun epiteelin dysplasia. Kuinka klinikopatologinen tausta liittyy hoitoon. Syöpä. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Mahalaukun suoliston metaplasian endoskooppinen diagnoosi Helicobacter pylorin hävittämisen jälkeen. Endoskooppi. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P.Gastriitin luokittelu ja luokittelu. Päivitetty Sydney-järjestelmä. Kansainvälinen työpaja gastriitin histopatologiasta, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
julkistettu doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Musiinigeeniekspressio normaalissa, preneoplastisessa ja neoplastisessa ihmisen mahalaukun epiteelissä. Cancer Res. 1995; 55 (12): 2681 – 2690.
julkistettu - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J et ai. Musiinit avainmolekyyleinä mahalaukun suoliston metaplasian luokittelussa. Virchows Arch. 2002; 440 (3): 311-317.
julkaistu doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et ai. Ihmisen vatsan suoliston metaplasialla on erilliset mutsiinin (MUC1, MUC2, MUC5AC ja MUC6) ilmentymismallit. Cancer Res. 1999; 59 (5): 1003 – 1007.
julkaistu - Groisman GM, Amar M, Livne E. CD10: arvokas työkalu mikrohiukkasiin liittyvän taudin (familiaalinen mikrovillainen atrofia) valomikroskooppiseen diagnoosiin. Olen J Surg Pathol. 2002; 26 (7): 902-907.
julkistettu doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. ektopeptidaasit CD10, CD13, CD26 ja CD143: ta säädellään mahasyövässä. JJ Oncol. 2004; 25 (5): 1223-1232.
julkistettu - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O et ai. Homeodomain-proteiinin CDX2 kohdunulkoinen ilmentyminen suoliston metaplasiassa ja mahalaukun karsinoomissa. Syöpä Lett. 2002; 176 (1): 47-55.
julkistettu doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H et ai. CDX2: n ekspressio mahalaukun limakalvossa suoliston metaplasian kanssa tai ilman: Helicobacter pylorin hävittämisen vaikutus. Helicobacter. 2002; 7 (3): 192-198.
julkistettu doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H, et ai. Suurennuskromoendoskooppi mahalaukun suoliston metaplasian ja dysplasian diagnosointiin. Gastrointest Endosc. 2003; 57 (4): 498-504.
julkistettu doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C et ai. Metyleenisinisen suurennuksen kromoendoskooppisen luokituksen ulkoinen validointi premaligatiivisissa mahahaavoissa. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
julkistettu doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Mahalaukun limakalvon endoskooppiset kuviot ja sen kliinopatologinen merkitys. Maailma J Gastroenterol. 2003; 9 (11): 2552-2556.
julkaistiin - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y et ai. Uusi menetelmä mahalaukun suoliston metaplasian diagnosointiin: kapeakaistainen kuvantaminen suurentavalla endoskopialla. Endoskooppi. 2006; 38 (8): 819-824.
pubi doi - Kiesslich R, Jung M. Suurennuksen endoskopia: parantako se limakalvon pinta-analyysiä maha-suolikanavan kasvainten diagnosoimiseksi? Endoskooppi. 2002; 34 (10): 819-822.
julkistettu doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Kromoendoskooppi metyleenisinisellä ja siihen liittyvillä DNA-vaurioilla Barrettin ruokatorvessa. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Viiden vuoden seurantatutkimus mahalaukun histologisista ja endoskooppisista muutoksista Helicobacter pylorin hävittämisen jälkeen. Dig Endosc. 2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Mahalaukun limakalvon histologinen seuranta kahdesta neljään vuoteen Helicobacterin jälkeen pylorin hävittäminen. J Pathol.1999; 188 (1): 24-29.
julkaistu doi - Jass JR, Filipe MI. limakalvo, suoliston metaplasia ja sen variantit sekä mahakarsinooma. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et ai.Suoliston metaplasiatyypit ja mahalaukun riski syöpä: kohorttitutkimus Sloveniassa. Int J Syöpä. 1994; 57 (3): 324-329.
Julkaistu doi - Rokkas T, Filipe MI, Sladen GE. Varhaisen mahasyövän lisääntyneen esiintyvyyden havaitseminen potilailla, joilla on suoliston metaplasia tyyppi III ja joita seurataan tarkasti. Gut. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Katsausartikkeli: mahalaukun limakalvon pre-neoplastiset tilat – käytännöllinen lähestymistapa hämmentyneelle lääkärille. Aliment Pharmacol Ther. 2001; 15 (Suppl 1): 43-50.
julkistettu - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S et ai. Helicobacter pylorin hävittämisen vaikutus metakronisen mahasyövän ilmaantuvuuteen varhaisen mahasyövän endoskooppisen resektion jälkeen: avoin, satunnaistettu kontrolloitu tutkimus. Lansetti. 2008; 372 (9636): 392-397.
julkistettu doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Mahasyöpä havaittu Helicobacter pylorin hävittämisen jälkeen. Ruoansulatuskanavan endoskopia. 2007; 19: 167-173.
Tämä on avoimen käyttöoikeuden artikkeli, jota jaetaan Creative Commons Attribution -lisenssin ehtojen mukaisesti. sallii rajoittamattoman käytön, levittämisen ja jäljentämisen missä tahansa välineessä edellyttäen, että alkuperäiseen teokseen viitataan asianmukaisesti.
Gastroenterologian tutkimus on julkaissut Elmer Press Inc.