Polonium-elementin tosiasiat
Kemiallinen alkuaine polonium luokitellaan kalkogeeniksi ja metalloidiksi. Sen löysivät vuonna 1898 Marie ja Pierre Curie.

Tietovyöhyke
| Luokitus: | Polonium on kalkogeeni ja metalloidi |
| Väri: | hopeanharmaa |
| Atomipaino : | (209), ei stabiileja isotooppeja |
| Tila: | kiinteä |
| Sulamispiste: | 254 oC, 527 K |
| Kiehumispiste: | 960 oC, 1233 K |
| Elektronit: | 84 |
| Protonit: | 84 |
| Neutronit runsaimmalla isotoopilla: | 125 |
| Elektronikuoret: | 2,8 , 18,32,18,6 |
| Elektronikonfiguraatio: | 4f14 5d10 6s2 6p4 |
| Tiheys @ 20oC: | 9,4 g / cm3 |
Näytä lisää, mukaan lukien: Lämmöt, Energiat, Härkä idation,
Reaktiot, yhdisteet, säteet, johtavuus
| Atomimäärä: | 22,23 cm3 / mol |
| Rakenne: | yksinkertainen kuutio |
| Kovuus: | – |
| Ominaislämpökapasiteetti | 0,12 J g-1 K-1 0,12 |
| Fuusiolämpö | 13 kJ mol-1 |
| sumutuslämpö | 142 kJ mol-1 |
| Höyrystymislämpö | 120 kJ mol-1 |
| 1. ionisaatioenergia | 812 kJ mol-1 |
| 2. ionisaatioenergia | – |
| 3. ionisaatioenergia | – |
| Elektroni-affiniteetti | 180 kJ mol-1 |
| Minimihapetusluku | -2 |
| Min. yleinen hapetusnro. | -2 |
| Suurin hapetusluku | 6 |
| Max. yleinen hapetusnro. | 4 |
| Elektronegatiivisuus (Pauling-asteikko) | 2.0 |
| Polarisoitavuus määrä | 6.8 Å3 |
| Reaktio ilman kanssa | lievä, ⇒ PoO2 |
| Reaktio 15 M HNO3: lla | – |
| Reaktio 6 M HCl: llä | mieto, ⇒ PoCl2 |
| Reaktio 6 M NaOH: lla | ei mitään |
| oksideja | PoO2, PoO2 |
| hydridi (t) | PoH2 |
| kloridit | PoCl2 |
| Atomisäde | 190 pm |
| Ionisäde (1+ ioni) | – |
| Ionisäde (2+ ionia) | – |
| Ioninen säde (3+ ioni) | – |
| Ionisäde (1-ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| Lämmönjohtavuus | 0,2 W m-1 K-1 |
| Sähkönjohtavuus | 0,7 x 106 S m-1 |
| Jäätymis- / sulamispiste: | 254 oC, 527 K |

Marie Curie vuonna 1883, 16-vuotias. Polonium oli ensimmäinen elementti, jonka hän löysi 15 vuotta myöhemmin.
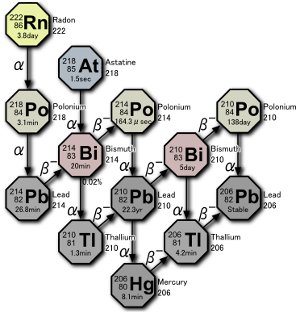
Osa uraanin hajoamissarja. Kolme polonium-isotooppia tuotetaan luonnossa joko itse radonkaasun hajoamisen tai radonin hajoamisesta johtuvien atomien hajoamisen seurauksena. Kuva: Tosaka.
Poloniumin löytäminen
Polonium oli ensimmäinen elementti, jonka Marie ja Pierre Curie löysivät.
He löysivät poloniumin ja sitten radiumin vuonna 1898 Pariisissa tutkien samalla radioaktiivisuutta pitchblendessä (uraanioksidi). / p>
He kirjoittivat: ”Uskomme, että pitchblendestä uutettu aine sisältää metallia, jota ei koskaan tunneta, joka on samanlainen kuin vismuttia analyyttisiltä ominaisuuksiltaan. Jos tämän uuden metallin olemassaolo vahvistetaan, ehdotamme, että sen pitäisi olla kutsutaan poloniumiksi jommankumman alkuperämaan nimen perusteella. ”
Curyn toiveiden mukaisesti polonium on nimetty Puolan mukaan, jossa Marie Curie syntyi ja varttui.
Radioaktiivisten alkuaineiden kanssa työskentelemisen vaaroja ei tiedetty, kun Curies Heidän laboratorion muistikirjansa ovat olleet niin radioaktiivisia, että ne on nyt tallennettu lyijyvuorattuun koteloon. (1)
Ulkonäkö ja ominaisuudet
Haitalliset vaikutukset:
Polonium on haitallista sekä kemiallisen myrkyllisyytensä että radioaktiivisuutensa vuoksi.Poloniumille altistuminen lisää erilaisten syöpien riskiä.
Ominaisuudet:
Polonium on harvinainen, hopeanharmaa, radioaktiivinen, matalasti sulava metalloidi.
Polonium reagoi helposti laimennettujen happojen kanssa, mutta vain vähän alkalien kanssa.
Kaikki sen isotoopit ovat radioaktiivisia.
210Po antaa sinistä hehkua, koska hajoaminen ympäröi sitä ympäröivää ilmaa Tuotteet. 1 gramma Po: ta tuottaa yhtä monta alfa-hiukkasia kuin 5 kg radiumia.
Poloniumin alfa-hajoamisen vapauttama energia on huomattavaa ja lämmittää tilaa sen ympärillä. Vapautuva energia on niin suuri (140 W / g), että noin puoli grammaa sisältävä kapseli saavuttaa yli 500 ° C lämpötilan.
Poloniumin käyttö
Alfa-säteet poloniumia voidaan käyttää staattisen sähkön eliminoimiseksi, kuten paperin, langan ja metallilevyn valssaaminen. Beetasäteilylähteitä käytetään kuitenkin yleisemmin, koska ne ovat vähemmän vaarallisia.
210Po: ta voidaan käyttää atomilämmön lähteenä, mutta isotoopin lyhyen puoliintumisajan (138,4 päivää) vuoksi se ei tarjoa virtaa pitkäaikaiseen käyttöön.
Poloniumia käytetään myös antistaattisissa harjoissa pölyn poistamiseksi valokuvafilmeistä. Se on suljettu harjoissa radioaktiivisten päästöjen hallitsemiseksi.
Runsaus ja isotoopit
Runsaasti maankuorta: Suuruusluokkaa 1 osa kvadriljoonaa kohti.
Runsaasti aurinkokuntaa: vähäinen
Kustannukset , puhdas: per 100g
Kustannukset, irtotavarana: per 100g
Lähde: Polonium on erittäin harvinainen alkuaine, koska sen isotoopit ovat lyhyitä. Sitä esiintyy uraanimalmeissa pieninä määrinä. Se voidaan saada pommittamalla luonnollista vismuttia 209Bi neutroneilla, jolloin saadaan 210Bi, joka sitten hajoaa 210Po: ksi β-hajoamisen kautta. Noin 100 g poloniumia syntetisoidaan vuosittain.
Isotoopit: Poloniumissa on 29 isotooppia, joiden puoliintumisajat ovat tunnettuja, massanumerot 190 – 218. Yksikään ei ole stabiili. Vakain isotooppi on 209Po, puoliintumisaika 102 vuotta.

Lainaa tätä sivua
Online-linkitystä varten kopioi ja liitä yksi seuraavista:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
tai
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Jos haluat lainata tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA-yhteensopivaa viittausta:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.