solu- ja infektiomikrobiologian rajat
Johdanto
Staphylococcus aureus on tärkeä sairaalahoitopotilaista eristetty ihmisen patogeeni, joka aiheuttaa sekä sairaalassa että yhteisössä saatuja infektioita ( Lowy, 1998). Tämä taudinaiheuttaja on etiologinen tekijä useille erilaisille systeemisille infektioille, jotka vaikuttavat ihoon ja pehmytkudokseen sekä tuki- ja liikuntaelin- ja verenkiertoelimistöön (Lowy, 1998; Changchien et ai., 2016). Raportoitiin, että S. aureus voi selviytyä ihmisen monosyyttiperäisistä makrofageista (Kubica et ai., 2008). S. aureuksen virulenssi liittyy läheisesti moniin erittyviin entsyymeihin ja bakteerien tuottamiin toksiineihin (Otto, 2014). Hemolysiini, leukosidiini (Panton – Valentine leukocidin, PVL) ja toksisen sokin oireyhtymä toksiini-1 (TSST-1), jotka helpottavat punasolukalvon vahingoittamista, leukosyyttien fagosyyttisen toiminnan vahingoittamista ja vastaavasti toksisen sokin oireyhtymän aiheuttamista, ovat S. aureuksen patogeeniset prosessit (Löffler et al., 2010; Vandenesch et ai., 2012; Berube and Bubeck Wardenburg, 2013; Andrey et ai., 2015; Al Laham et ai., 2015). Viimeaikaiset tutkimukset ovat osoittaneet, että hemolysiini osallistuu myös S. aureus -biofilmin muodostumiseen (den Reijer et ai., 2016). Monilääkeresistenttien S. aureus -kantojen lisääntyvä esiintyvyys sairaala- ja yhteisöympäristöissä lisää edelleen S. aureuksen vaaroja ja asettaa vakavan haasteen kliiniselle hoidolle (Voss ja Doebbeling, 1995; Evangelista Sde ja de Oliveira, 2015).
Viime aikoina sairaalastamme on löydetty joukko kantoja, jotka kuuluvat S. aureus -luokkaan, jolla on epätäydellinen hemolyyttinen fenotyyppi (SIHP). Näiden SIHP-kantojen aiheuttama hemolyysi eroaa merkittävästi muista S. aureus -kannoista tuotetusta täydellisestä hemolyyttisestä renkaasta (p-hemolyyttinen fenotyyppi). Näitä SIHP-kantoja ei kuitenkaan ole vielä tunnistettu ja karakterisoitu kattavasti. Näiden SIHP-kantojen mikrobiologisten ominaisuuksien tutkimiseksi keräsimme 60 SIHP-kantaa ja tutkimme niitä käyttämällä useita kriteerejä, mukaan lukien hemolyyttinen fenotyyppi, hemolysiinigeenin ilmentyminen, lääkeresistenssiominaisuudet ja virulenssi. Tämä tutkimus osoittaa, että SIHP: t ovat metisilliinille resistenttejä kantoja, jotka ilmentävät voimakkaasti β-hemolysiiniä ja joilla on suuri virulenssipotentiaali.
Materiaalit ja menetelmät
Bakteerikannat
Kuusikymmentä SIHP kantoja eristettiin potilaista, jotka otettiin Soochowin yliopiston toiseen sidossairaalaan vuosina 2013-2015. Jokaisesta potilaasta otettiin kaksoisnäytteet analysointia varten. Näitä isolaatteja viljeltiin sitten Columbian lammasveriagarmaljoilla (CHROMagar Company, Shanghai, Kiina) 35 ° C: ssa ilmakehässä, joka sisälsi 5% CO2 (v / v). Kannat identiteetti S. aureuksena vahvistettiin käyttämällä Phoenix-100 -automaattista mikrobiologista järjestelmää (Becton, Dickinson and Company, USA). S. aureus -kontrollikannat, joilla oli täydellinen hemolyyttinen fenotyyppi, eristettiin sairaalamme potilaista saman ajanjakson aikana. Tässä S. aureusta, jolla oli täydellinen hemolyyttinen fenotyyppi, kutsuttiin SCHP-kannoiksi. S. aureus ATCC25923 -viitekannalla (Shanghai Center for Clinical Laboratory, Kiina) on täydellinen hemolyyttinen fenotyyppi ja se toimi myös kontrollikannana. Soochowin yliopiston toisen sidossairaalan lääketieteellisen etiikan komitea hyväksyi tämän tutkimuksen, ja kaikki isolaatit kerättiin potilaan suostumuksella tähän tutkimukseen.
Vertailuanalyysit epätäydellisestä hemolyyttisestä fenotyypistä
S. aureus kantoja viljeltiin kaupallisilla veri-agar-levyillä eri yrityksiltä (CHROMagar, Autobio Diagnostics Co., Ltd., Kiina ja BioMérieux, Kiina) samoin kuin itse valmistetuista lampaanveren agar-levyistä käyttäen Columbian veriagar-jauhetta (OXIDE, UK). Bakteereja viljeltiin 35 ° C: ssa ilmakehässä, joka sisälsi 5% C02 (tilavuus / tilavuus) 24 tuntia, ja sitten ne käytiin sarjassa. Sitten havaittiin hemolyyttinen ilmiö. Kliinisesti eristettyjä kantoja, joilla oli täydellinen hemolyyttinen fenotyyppi, ja ATCC25923-vertailukantaa havaittiin myös vertailuanalyysien kontrollina.
S. aureuksen neljän hemolysiinigeenin mRNA-tasojen määrittäminen käänteiskopioinnin reaaliaikaisen kvantitatiivisen avulla PCR (qPCR)
RNA: n kokonaisuutto SIHP: stä ja ATCC25923-vertailukannasta suoritettiin aiemmin kuvatulla tavalla (Qin et ai., 2014). Aluksi solut hajotettiin käyttämällä lysostafiinia, lysotsyymiä ja proteinaasi K: ta. RNA uutettiin ja puhdistettiin sitten RNeasy Mini Kitillä (Qiagen) valmistajan suosituksen mukaisesti. RNA: n laatu ja konsentraatio arvioitiin käyttämällä NanoDrop1000: ta. – transkriptoitu cDNA: han käyttämällä käänteiskopiointikittiä (Thermo Fisher Scientific Inc., USA) valmistajan ohjeiden mukaisesti.Lyhyesti qPCR suoritettiin seuraavasti: esidenaturoituminen 94 ° C: ssa 3 minuutin ajan, denaturointi 94 ° C: ssa 30 sekunnin ajan, pariutuminen 52 ° C: ssa 30 sekunnin ajan, venymä 72 ° C: ssa 40 sekuntia, yhteensä 45 jaksoa . Jokaisella näytteellä oli kolme teknistä ja kolme biologista toistoa. Kummankin neljän hemolysiinigeenin ja 16s rRNA -geenin transkriptioprofiili määritettiin käyttämällä 2-ΔΔCt-menetelmää. Transkriptiotaso määritettiin suhteessa 16s: n rRNA-geenin ilmentymiseen. Neljän hemolysiinigeenin (hla, hlb, hlgC ja hld) sekvenssit haettiin GenBank-tietokannasta. Primer 5.0 -ohjelmistoa käytettiin alukkeiden suunnitteluun (taulukko 1), ja nämä alukkeet syntetisoi Sangon Biotech Co., Ltd. (Shanghai, Kiina).
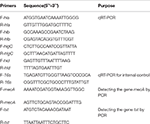
Taulukko 1. Tässä tutkimuksessa käytetyt alukkeet.
SPSS 17.0: ta käytettiin tietojen analysointiin. Mittaustiedot esitetään muodossa x̄ ± s. Kahden riippumattoman näytteen T-testiä käytettiin vertaamaan kummankin neljän hemolysiinigeenin suhteellista ilmentymistä. Tilastolliseksi merkitsevyydeksi määriteltiin p < 0,05.
a-hemolysiini (Hla) -ekspression detektio Western Blotilla
SIHP ja vertailukanta S. aureus ATCC25923 säädettiin arvoon 5,0 McFarland käyttämällä sameusmittaria. Sitten kokonaisproteiini uutettiin kustakin näytteestä, säädettiin samaan konsentraatioon ja elektroforeesille tehtiin SDS-PAGE-geelillä. Sen jälkeen proteiinit siirrettiin nitroselluloosamembraanille ja kalvo suljettiin 5-prosenttisella rasvattomalla maidolla 1 tunti. Vuohen anti-stafylokokki-a-hemolyysiini-polyklonaaliset vasta-aineet (Abcam) lisättiin lopullisena pitoisuutena 2 μg / ml. Reaktioseosta inkuboitiin sitten 4 ° C: ssa yön yli. Sen jälkeen kun kalvo oli pesty, lisättiin 1: 1 000 laimennettuja HRP-leimattuja kani anti-vuohen IgG-vasta-aineita ja inkuboitiin 37 ° C: ssa 2 tuntia. Lopuksi kemiluminesoivat substraatit lisättiin värin kehittymistä varten. Α-hemolysiinin ilmentyminen havaittiin lopulta kuvantimen alla.
SIHP: n mikrobilääkeherkkyystestaus
Mikrotiitteriliemen laimennusmenetelmää käytettiin antimikrobiseen herkkyysseulontaan. Menettely suoritettiin Phoenix-100 -automaattisen mikrobiologisen järjestelmän käyttöohjeen mukaisesti. Tämän seulonnan tulokset tulkittiin käyttämällä kliinisten ja laboratorioiden standardointilaitoksen (CLSI; Clinical and Laboratory Standards Institute, 2014) käyttöön ottamia M100-S24-kriteereitä. Metisilliiniresistentti S. aureus (MRSA) -tila määritettiin käyttämällä kahden antibiootin MIC: tä (pienin estävä pitoisuus). SIHP-kantojen osalta ≥4 μg / ml oli oksallisiinin MIC ja ≥8 μg / ml kefoksitiinin MIC.
mecA- ja tst-geenien havaitseminen
Kaikki 60 SIHP kannoista testattiin lääkeresistenssigeeni mecA ja virulenssigeeni tst. Genomisen DNA: n kiehuva uutto suoritettiin solulyysin jälkeen käyttäen lysostafiinia. Sitten mecA- ja tst-geenit monistettiin genomisesta DNA: sta käyttäen DreamGreen Taq -pakkausta. PCR-olosuhteet olivat seuraavat: esidenaturoituminen 94 ° C: ssa 3 minuutin ajan, denaturointi 94 ° C: ssa 30 sekunnin ajan, pariutuminen 50 ° C: ssa 30 sekunnin ajan, jatkaminen 72 ° C: ssa 1 minuutin ajan. PCR-tuotteet sekvensoitiin ja analysoitiin BLAST: lla validoidakseen odotetut tuotteet. Lääkeresistenssigeenin mecA-sekvenssit ja S. aureuksen virulenssigeenin tst haettiin GenBank-tietokannasta. Primer 5.0 -ohjelmistoa käytettiin alukkeiden suunnitteluun (taulukko 1), ja nämä alukkeet syntetisoi Sangon Biotech Co., Ltd. (Shanghai, Kiina).
S. aureus SIHP -kantojen eloonjäämisen havaitseminen Makrofagit
Jotta verrataan S. aureus SIHP-kantojen eloonjäämistä makrofageissa tst-negatiivisten S. aureus SCHP -kantojen eloonjäämiseen, ihmisen monosyyttisolulinjaa THP-1 ylläpidettiin RPMI-1640: ssä, joka sisälsi 10% (v / v) FBS 37 ° C: ssa ilmakehässä, joka sisältää 5% (v / v) CO2. Makrofagi-infektiota varten THP-1-solut ympättiin 5 x 105 solua kuoppaa kohti 24-kuoppaisissa kudosviljelymaljoissa ja indusoitiin erilaistumaan 10-7 M phorbol 12-myristate 13-asetaatilla (PMA) 48 tuntia. Noin 3 × 108 logaritmifaasin (OD600 0,5–0,6) bakteerien pesäkkeitä muodostavaa yksikköä (CFU) pelletoitiin sentrifugoimalla, pestiin kahdesti PBS: llä ja suspendoitiin uudelleen 1 ml: aan RPMI-1640: tä. Sitten bakteereja lisättiin solun yksikerrokseen MOI: lla 20: 1 ja sentrifugoitiin 5 minuuttia 1000 rpm: llä. Tartunnan saaneita soluja inkuboitiin 20 minuutin ajan 37 ° C: ssa, sitten ne pestiin kolme kertaa esilämmitetyllä PBS: llä (pH 7,4) ja inkuboitiin vielä 1 tunti väliaineessa, joka sisälsi 100 ug / ml gentamisiinia solunulkoisten bakteerien tappamiseksi. Solut pestiin ja hajotettiin solunsisäisen bakteerin kvantifioimiseksi aikanolla-näytteeksi (T0). Lisäsoluja kerättiin 12 tai 24 tunnin inkuboinnin jälkeen tuoreen täydennetyn kudosviljelyalustan läsnä ollessa, joka sisälsi 12 μg / ml gentamisiinia.Bakteerien kasvu THP-1-soluissa määritettiin jakamalla solunsisäisten bakteerien lukumäärä 12 tai 24 tunnissa ajankohdan 0 lukumäärällä (T12 / T0 tai T24 / T0). Koe toistettiin itsenäisesti kolme kertaa.
S. aureus SIHP -kantojen tartuttamien makrofagien sytokiinierityksen havaitseminen
Bakteereilla 12 tunnin ajan infektoituneiden THP-1-makrofagien viljelysupernatantit kerätty. Sytokiinitasot mitattiin FACSCalibur-virtaussytometrialla (BD) käyttäen CBA Human Thl / Th2 -sytokiinipakettia II (BD) valmistuksen ohjeiden mukaisesti.
Multilocus Sequence Typing and Analysis
Tulokset
SIHP-kantojen hemolyyttinen fenotyyppi lampaiden agariverilevyillä
Kuten kuvioissa 1A, B on esitetty, täydellinen hemolyyttinen rengas (β-hemolyyttinen fenotyyppi) havaittiin kontrollissa S . aureus -kannat sen jälkeen, kun kantoja on viljelty veri-agar-levyillä 24 tuntia. SIHP-kannoissa kuitenkin esiintyi erilaisia hemolyyttisiä fenotyyppejä (joita kutsutaan tässä epätäydelliseksi hemolyyttiseksi fenotyypiksi) .Puutteellinen hemolyyttinen fenotyyppi voitiin havaita SIHP-kannoissa, jotka kasvoivat olosuhteet, mukaan lukien vastaavasti mikroaerofiiliset, aerobiset ja anaerobiset olosuhteet (kuvat 1C – E) .Lisäksi 10 sarjaajokohdan jälkeen tämä epätäydellinen hemolyyttinen fenotyyppi säilyi edelleen (kuva 1F).
Suhteellinen Neljän hemolysiinigeenin mRNA-ilmentymistasot
Kuten kuvassa 2 on esitetty, neljän hemolysiinigeenin hla, hlb, hlgC ja hld ilmentämistasot SCHP-kannoissa eivät osoittaneet tilastollisesti merkitseviä eroja (p > 0,05) verrattuna kontrollikantoihin ATCC25923. Hla-, hlgC- ja hld-ilmentymistasot SIHP-kannoissa kuitenkin tukahdutettiin merkittävästi 50-, 16,7- ja 8,3-kertaisilla vastaavasti (p < 0,05) verrattuna kontrollikannat ATCC25923 ja SCHP -kannat, kun taas hlb: n ilmentyminen SIHP-kannoissa kasvoi merkittävästi 7,7-kertaisesti verrokkiin verrattuna (p < 0,05).
a-hemolysiinin havaitseminen Western Blot -laitteella
A-hemolyysi koodaama geeni hla on huokosia muodostava toksiini, jota erittää S. aureus, ja sen molekyylipaino on 33 kDa (Andrey et ai., 2015; Al Laham et ai., 2015). Western blot -analyysi osoitti, että a-hemolysiinin ilmentyminen SIHP-kannoissa oli 40 kertaa pienempi kuin SCHP- ja kontrollikannoissa, mikä on yhdenmukaista qRT-PCR-tietojen kanssa (kuva 3).

Kuva 3. a-hemolysiinin Western blot S. aureuksessa. ATCC29213: kontrolloi S. aureus täydellisellä hemolyyttisellä fenotyypillä; SCHP: S. aureus, jolla on täydellinen hemolyyttinen fenotyyppi, eristetty kliinisistä näytteistä samana aikana; SIHP: S. aureus, jonka hemolyyttinen fenotyyppi on epätäydellinen.
SIHP: n lääkeresistenssi
Lääkeherkkyys testattu käyttäen mikrotiitteriliemen laimennoksia osoitti, että oksasilliinin ja kefoksitiinin MIC-arvot olivat kaikki > 2 ja > 8 μg / ml 60 SIHP -värissä . CLSI M100-S24 -ohjeiden mukaan kaikki 60 SIHP-kantaa luokitellaan MRSA-kannoiksi. PCR havaitsi myös mecA-geenin kaikissa 60 kannassa.
Tst-geenin testaus
Tst-geeni on tärkeä virulenssitekijä S. aureuksessa. PCR osoitti, että kaikilla 50 SIHP-kannalla oli tst-geenejä.
S. aureus SIHP -kantojen selviytymiskyky makrofageissa on suurempi kuin t-negatiivisten S. aureus
Vertailimme SIHP-kantojen ja tst-negatiivisten SCHP-kantojen solunsisäiset eloonjäämiskyvyt makrofageissa. Laskemalla levyiltä talteen otettujen bakteerien määrä havaitsimme, että SIHP-kannan solunsisäinen eloonjäämiskyky oli paljon korkeampi kuin tst-negatiivisen S. aureus -kannan 12 tai 24 tunnin kuluttua infektoituneista THP-1-johdetuista makrofageista (kuvio 4). Aluksi oletimme, että SIHP-kannoilla on potentiaalisesti korkea virulenssi, ja ehdotettiin, että SIHP: lle tulisi kiinnittää enemmän huomiota sairaalassa.
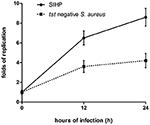
Kuva 4. SIHP-kantojen ja tst-negatiivisten S. aureuksen eloonjääminen THP-1-johdetuissa makrofageissa. Sen jälkeen kun makrofagit olivat infektoituneet bakteereilla 12 ja 24 tunnin ajan, makrofagit hajotettiin ja solunsisäiset elossa olevat bakteerit maljattiin LB-agarille. Solunsisäisten elossa olevien bakteerien replikaatiokerrat laskettiin yllä olevan LB-agarlevyn pesäkemäärien perusteella.
Eristyserot S. aureuksen SIHP-kannan ja tst-negatiivisen S. aureus -kannan sytokiinien ja kemokiinien määrä
Vertaamaan sytokiinien ja kemokiinien erityseroja SIHP-kannalla ja tst-negatiivisilla S. infektoiduilla THP-1-johdetuilla makrofageillaaureus-kannan, havaitsimme pro-inflammatoriset sytokiinit virtaussytometrialla SIHP-kannoilla ja tst-negatiivisissa S. aureus -kannoissa infektoitujen makrofagien viljelysupernatantissa. Tulokset osoittivat IL-2: n, IL-6: n ja IL-17A: n merkittävän korkeamman induktion SIHP-kannoissa, mutta eivät tst-negatiivisilla S. aureus -menetelmillä, mikä viittaa siihen, että SIHP-kannat indusoivat sytokiini / kemokiinivasteita makrofageissa (kuvio 5). Muut makrofaagien erittämät sytokiinit IL-4, IL-10, INF-y ja TNF eivät olleet ilmeisiä eroja SIHP-kantojen ja tst-negatiivisten S. aureus -ryhmien välillä.
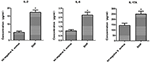
Kuva 5. S. aureuksella infektoitujen makrofagien erittämien sytokiinien ja kemokiinien havaitseminen. * P < 0,05.
monitarkennusjaksojen kirjoittaminen
Määritimme 60 SIHP-isolaatin monitarkkuuden genotyypin, joka oli kerätty sairaalassamme vuosina 2013–2014 saaneista potilaista. S. aureus MLST -tietokannassa suositeltua seitsemän lokuksen mallia sovellettiin. MLST-analyysi osoitti, että kaikki SIHP-kannat luokiteltiin ST5-klooniin.
Keskustelu
Hemolysiini on yksi tärkeimmistä virulenssitekijöistä S. aureukselle (Wiseman, 1975). Kummankin neljän tyyppisen hemolysiinin yhdistetyt vaikutukset johtavat punasolukalvon tuhoutumiseen, mikä johtaa täydellisen läpinäkyvän hemolyyttisen renkaan muodostumiseen veri-agarmaljoilla. Viime vuosina SIHP: tä löydettiin Soochowin yliopiston toisen sidossairaalan kliinisistä näytteistä. Tässä tutkimuksessa pyrimme tunnistamaan nämä kannat ja tutkimaan niiden ominaisuuksia mikrobiologiassa. Alun perin käytimme erilaisia kaupallisia tai itse valmistettuja lampaanveren agar-levyjä kantojen eristämiseksi, inkuboimiseksi ja siirtämiseksi sarjaan. Osoitimme, että on joitain kantoja, joilla on epätäydellinen hemolyyttinen fenotyyppi ja joka ylläpitää sitä pitkäkestoisen alaviljelmän jälkeenkin. Siten voidaan sulkea pois mahdollisuus, että tämä fenotyyppi johtuu ei-bakteeritekijöistä. Tutkimuksemme mukaan SIHP voisi olla alaryhmä ainutlaatuisista S. aureus -kannoista.
Aikaisemmat tutkimukset viittasivat siihen, että kanin punasolut ovat erittäin herkkiä a-hemolysiinille (Hildebrand et ai., 1991). Berube et ai. raportoi, että a-hemolysiinin vaikutus punasolujen hajoamiseen on pitoisuudesta riippuvainen (Berube ja Bubeck Wardenburg, 2013). γ-hemolysiini voi vahingoittaa ihmisten ja eläinten punasoluja (Kaneko ja Kamio, 2004). Vaikka δ-hemolysiini vahingoittaa punasoluja, vain suurina pitoisuuksina se muodostaa solukalvoa hajottavan kalvon läpäisevän huokosen (Verdon et ai., 2009). Tässä tutkimuksessa osoitimme, että SIHP-kantojen ja SCHP-kantojen neljän hemolysiinin ilmentymisellä on merkittävästi erilaiset transkription ekspressioprofiilit. Α-, γ-, 5-hemolysiinin ilmentyminen SIHP-kannoissa, joka voi vahingoittaa punasoluja suoraan, on paljon pienempi kuin SCHP-kantojen, kun taas β-hemolysiinillä on paljon korkeammat ekspressiotasot verrattuna SCHP-kantoihin. Lisäksi a-hemolysiinin proteiiniekspressiotaso vahvistettiin edelleen Western blot -menetelmällä. Raportoitiin, että β-hemolysiini lisää pääasiassa punasolujen herkkyyttä muille toksiineille sen sijaan, että solut hajotettaisiin suoraan, ellei soluja viljellä alemmissa lämpötiloissa (Vandenesch et ai., 2012). Tässä tutkimuksessa p-hemolysiinin korkea ilmentyminen havaittiin SIHP-kannoissa, mutta täydellistä hemolyyttistä rengasta ei koskaan havaittu SIHP-kannoissa, vaikka inkuboitiin 4 ° C: ssa. Nämä tulokset viittaavat siihen, että havaittu puutteellinen SIHP-kantojen fenotyyppi on todennäköisesti kaikkien neljän hemolysiinin vaikutukset, jotka ilmentyvät eri tavalla kuin SCHP-kannat. Aikaisemmat tutkimukset ovat osoittaneet, että kroonisen patogeneesin aikana antibiooteista, mukaan lukien siprofloksasiini ja trimetoprimi, johtuvien selektiivisten paineiden sekä isännän immuunivasteen yhteisvaikutus voi johtaa lisääntyneeseen a-hemolysiinin ilmentymiseen, mikä on erittäin tärkeää S aureus limakalvossa erityisesti hengitystieinfektioissa (Goerke et al., 2006; Huseby et ai., 2010). Tässä tutkimuksessa kaikki SIHP: llä infektoituneet potilaat saivat pitkäaikaista laajakirjoista antibioottien hoitoa, aiheuttaiko tämä selektiivinen paine lääkeresistenttien geenien yliekspressiota ja häiritsikö hemolysiinigeenien ilmentymistä, edelleen mahdollisuus, jota tarvitaan tutkimus.
SIHP: n mikrobiologisten ominaisuuksien tutkimiseksi teimme mikrobilääkeherkkyystestit ja valitsimme virulenssigeenin tst, joka liittyy S. aureuksen patogeenisuuteen. Huomasimme, että kaikki 60 SIHP-kantaa voidaan luokitella MRSA-kannoiksi ja kantaa mecA-geeniä. Antimikrobisten herkkyystestien tulokset osoittivat, että jopa 10 siirron jälkeen näistä 60 SIHP-kannasta linetsolidin ja vain kolmen SIHP-kannan teikoplaniinin MIC-arvot ovat muuttuneet vähän.Nämä MIC-arvojen muutokset eivät kuitenkaan vaikuttaneet mikrobilääkeherkkyyden tulosten arviointiin. Virulenssigeeni tst koodaa toksisen sokin oireyhtymän toksiinia (TSST-1) (Kreiswirth, 1989). Superantigeeninä TSST-1 parantaa endotoksiinien indusoimia sokki- ja immuunivastevasteita (Kulhankova et ai., 2014). PCR-testauksessa havaittiin, että kaikilla 60 SIHP-kannalla oli tst-geeni, mikä viittaa lisääntyneeseen virulenssiin. Äskettäin monet raportit osoittivat, että S. aureus voisi selviytyä ihmisen monosyyttiperäisistä makrofageista ja nämä S. aureus -kannat ovat virulenttimpia (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi ja Bishayi, 2016). Siksi verrattiin SIHP-kantojen ja SCHP-kantojen solunsisäisiä eloonjäämiskykyjä, mikä on tst-negatiivinen S. aureus makrofageissa, ja havaitsimme, että SIHP-kannan solunsisäinen eloonjäämiskyky oli paljon suurempi kuin tst-negatiivisen S. aureus -kannan. Lisäksi potilastietojen analyysi osoitti, että infektiolääkityksen vaikutus useimmilla SIHP-kannoilla infektoituneilla potilailla oli huonompi kuin vastaavilla potilailla, jotka olivat infektoituneet SCHP-kannoilla (tietoja ei esitetty). Tutkimuksemme tarjoaa alustavia kokeellisia todisteita spekulaatiosta, että SIHP-kannoilla on potentiaalisesti korkea virulenssi. neutrofiilien ja makrofagien tuotannosta ja tulehdusta edistävien sytokiinien, erityisesti TNF-a: n, IL-1β: n ja IL-6: n, tuotannosta (Bekeredjian-Ding et ai., 2015; Giai et ai., 2016; Zhao ym., 2016 ). On raportoitu, että tulehduksellisten sytokiinien IL-6 eritys lisääntyi S. aureuksen pitoisuuksien kasvaessa (Chen et ai., 2016). Lisäksi superantigeeniset S. aureus stimuloivat erityisen tehokkaasti IL-17-tuotantoa (Islander et ai., 2010). Tässä tutkimuksessa SIHP-kannat osoittivat makrofagien IL-2-, IL-6- ja IL-17A-induktion merkitsevästi suurempia kuin tst-negatiiviset SCHP-kannat, mikä viittaa siihen, että SIHP-kannat voivat aiheuttaa enemmän sytokiinien eritystä makrofagien tappavaa vaikutusta vastaan. Lisäksi MLST-analyysi osoitti, että kaikki SIHP-kannat luokiteltiin ST5-klooniin. Lisäksi nämä SIHP-kannat ryhmiteltiin spa-tyyppiin t2460 (tietoja ei esitetty).
Yhdistettynä SIHP voi olla uusi MRSA-alaryhmä, jolla voi olla suuri virulenssi, ja enemmän huomiota tulisi kiinnittää näiden kantojen hallinta ja hoito sairaaloissa.
Kirjoittajan panokset
Lausunto eturistiriidoista
Kirjoittajat ilmoittavat, että tutkimus tehtiin ilman kaupallisia ilmoituksia tai taloudelliset suhteet, jotka voidaan tulkita mahdollisiksi eturistiriidoiksi.
Kiitokset
Tätä tutkimusta tuki Kiinan kansallinen luonnontieteellinen säätiö (81572032, 81401636). Jiangsun maakunnan korkeakoulujen säätiö (16KJB320006) ja Suzhoun tiede- ja teknologiaohjelma (SYSD2014094, SYS201551, SS201638).
Kliininen ja laboratorio Standards Institute (2014). M100-S24 mikrobilääkeherkkyyden testausstandardit; Kaksikymmentäneljäs tietolehti. Wayne, PA: CLSI.
Nandi, A. ja Bishayi, B. (2016). Solunsisäisesti selviytynyt Staphylococcus aureus fagosytoosin jälkeen on virulenttimpi indusoimaan sytotoksisuutta hiiren tuoreissa peritoneaalimakrofageissa käyttämällä TLR-2: ta mahdollisena kohteena. Mikrobi. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef-kokoteksti | Google Scholar
Wiseman, G. M. (1975). Staphylococcus aureuksen hemolysiinit. Bakterioli. Ilm. 39, 317–344.
PubMed Abstract | Google Scholar