Analyse rentable de l’utilisation de l’oscillation haute fréquence de la paroi thoracique (HFCWO) chez les patients non kystiques Fibrose Bronchectasie
Résumé
La bronchiectasie est une maladie chronique évolutive caractérisée par une dilatation pathologique irréversible des bronches pulmonaires. Les traitements de la bronchectasie visent à mobiliser les sécrétions des voies respiratoires, à réduire l’inflammation, à prévenir les infections respiratoires, à améliorer la ventilation, à minimiser le nombre d’exacerbations et à améliorer la qualité de vie d’une personne. L’oscillation de la paroi thoracique à haute fréquence (HFCWO) est un traitement de dégagement des voies respiratoires actuellement utilisé pour un certain nombre de maladies chroniques compromettant les voies respiratoires, y compris la bronchectasie non kystique. Cette étude a évalué l’impact économique du traitement HFCWO fourni par le système de dégagement des voies respiratoires SmartVest® sur l’utilisation et le coût des soins de santé liés à la bronchectasie.
Méthodes
Les résultats d’un examen de cas publié précédemment Une étude clinique basée sur les auteurs a servi de base à cette analyse coût-efficacité. Les exacerbations liées à la bronchectasie, y compris le nombre d’hospitalisations, les visites aux urgences et la fréquence des prescriptions d’antibiotiques ont été enregistrées pour chaque patient pendant une période d’un an avant l’utilisation de SmartVest (contrôle standard des soins) et pendant une période d’un an après le démarrage de SmartVest. utilisation. Les taux d’exacerbation pour un an avant SmartVest et un an après SmartVest ont été comparés. Les exacerbations ont été vérifiées à la fois à partir des dossiers médicaux du patient et par entretien téléphonique. Les coûts des antibiotiques ont été déterminés à l’aide de la «tarification des pharmacies à rabais en ligne», tandis que les coûts d’hospitalisation et d’urgences ont été déterminés à l’aide du rapport statistique n ° 146 du projet HCUP (Healthcare Cost and Utilization Project) et de la base de données HCUP National Inpatient Sample (NIS) 2013.
Résultats
Les résultats cliniques précédemment publiés de 59 patients SmartVest atteints de bronchectasie non kystique ont servi de base à cette analyse. Lorsque les données sur les résultats ont été analysées, SmartVest a utilisé, par rapport au standard du contrôle des soins, a été associée à des résultats statistiquement significatifs: une diminution de 58% du coût des antibiotiques, une diminution de 63% du coût des visites à l’urgence et une diminution de 60% du coût d’hospitalisation. Au total, l’analyse des coûts a permis une économie annuelle de 3 045 dollars patient par an d’utilisation de SmartVest.
Conclusions
L’efficacité clinique de l’utilisation de SmartVest comme traitement des patients atteints de bronchectasie non kystique a été précédemment vérifiée par une réduction significative n dans les exacerbations liées aux bronchectasies, ce qui se traduit directement par une réduction globale significative de 60% de l’utilisation et du coût des soins de santé dans cette population. En outre, des avantages secondaires tels que le potentiel de réduire les réadmissions à l’hôpital et le potentiel d’impact sur la dissuasion de la résistance aux antibiotiques peuvent avoir des avantages encore plus importants que la diminution des coûts.
Mots clés
SmartVest, thorax haute fréquence oscillation de la paroi, HFCWO, bronchectasie, coût
Introduction
La bronchiectasie est une maladie chronique et étiologiquement hétérogène. Les caractéristiques communes de la bronchectasie sont l’essoufflement, les exacerbations fréquentes, la toux chronique, l’hémoptysie et la production excessive de crachats. La maladie est généralement caractérisée par des cycles d’altération de la clairance mucociliaire, d’infection bronchique et d’inflammation entraînant des lésions structurelles des voies respiratoires avec une dilatation permanente et anormale.1 La bronchectasie peut être le résultat d’un large éventail de maladies respiratoires et systémiques, y compris la fibrose kystique, syndromes ciliaires dyskinétiques, blessures par inhalation / aspiration, états d’immunodéficience primaire et acquise et un certain nombre de conditions rhumatismales et inflammatoires.2 Une bronchectasie est observée chez 7% à 52% des patients souffrant d’asthme ou de bronchopneumopathie chronique obstructive (BPCO) .3,4 , 37
Seitz, et al, ont analysé un échantillon de 5% de la base de données de réclamations ambulatoires de Medicare pour bronchectasie parmi les bénéficiaires âgés de 65 ans et plus de 2000 à 2007.6 La base de données contient des informations au niveau des réclamations provenant de soins de santé ambulatoires non institutionnels fournisseurs. La bronchectasie a été identifiée par la base de données en utilisant les codes de la Classification internationale des maladies, neuvième révision, codes de modification clinique (CIM-9-CM). La population de l’étude comprenait > 2 millions d’individus uniques inscrits à Medicare Part B pendant au moins un mois de 2000 à 2007. L’étude a déterminé que la prévalence de la bronchectasie dans la population globale était de 1 106 cas. pour 100 000 habitants au cours de la période d’examen de huit ans. L’étude a également révélé que la prévalence de la bronchectasie chez les bénéficiaires de Medicare avait augmenté de 8,7% entre 2000 et 2007 et que le taux d’hospitalisation pour bronchectasie augmentait chaque année à un taux de 2.4% chez les hommes et 3,0% chez les femmes.
Le fardeau global des maladies pulmonaires avancées augmente et, là où des données existent, les coûts liés à la morbidité et à la mortalité de ces maladies semblent importants.2 Cela pourrait, refléter en partie le vieillissement croissant de la population souffrant de maladies pulmonaires chroniques, qui entraîne une augmentation disproportionnée des coûts des soins de santé; le taux d’hospitalisation pour maladie pulmonaire chronique augmente nettement au-dessus de 50 ans, et en particulier chez les femmes âgées.2,7 Sur la base des dossiers de sortie entre 1997 et 2010, on a estimé le coût hospitalier moyen des soins hospitaliers chez les patients l’exacerbation de la pneumonie était de 9300 $.28 En 2001, on a également estimé que le coût annuel des soins médicaux pour les personnes aux États-Unis souffrant de bronchectasie était de 13244 $, ce qui est supérieur au coût annuel de nombreuses autres maladies chroniques, telles que les maladies cardiaques (12000 $) et MPOC (11000 $) .38 Une étude de 2005 a révélé que les patients atteints de bronchectasie non kystique avaient en moyenne 2 jours supplémentaires par an à l’hôpital, avaient 6,1 consultations ambulatoires supplémentaires et 27,2 jours de plus d’antibiothérapie par rapport aux patients non atteints de la maladie.9 En 2005 , les coûts de traitement de la bronchectasie non kystique étaient de 630 millions de dollars par an.5
Les patients atteints de bronchectasie non kystique peuvent avoir des difficultés à nettoyer l’airw les sécrétions respiratoires et peuvent bénéficier de manière significative de la thérapie de dégagement des voies respiratoires.2 Les objectifs du traitement de la bronchectasie sont de mobiliser les sécrétions des voies respiratoires afin de réduire l’inflammation, de prévenir les infections respiratoires, d’améliorer la ventilation, de minimiser le nombre d’exacerbations et d’améliorer la qualité de vie d’un patient. 10-12 Un certain nombre de méthodes thérapeutiques sont actuellement utilisées pour éliminer les sécrétions des voies respiratoires chez les patients atteints de maladie pulmonaire, de troubles de la clairance du mucus respiratoire ou qui risquent de développer l’une ou l’autre de ces conditions.8 Ces méthodes visent généralement à favoriser la clairance des sécrétions en réduisant viscosité du mucus et utilisation des forces de cisaillement pour libérer le mucus de la paroi pulmonaire afin de faciliter la mobilisation pour faciliter l’expectoration. La norme de soins implique une thérapie combinée avec des agents mucolytiques et mucocinétiques, des bronchodilatateurs, une thérapie anti-inflammatoire et une certaine forme de thérapie de dégagement physique / mécanique des voies respiratoires.2 La thérapie de dégagement des voies respiratoires joue un rôle critique car elle aide à éviter la rétention de mucus chargé d’agents pathogènes qui est à l’origine d’une infection récurrente qui provoque une détérioration pulmonaire progressive.2,13,14 Les méthodes de dégagement des voies respiratoires jouent un rôle essentiel dans le maintien de la santé respiratoire tout au long de la vie du patient.
Un certain nombre de dégagements des voies respiratoires sont disponibles, notamment la physiothérapie thoracique, les masques de pression positive de fin d’expiration, les appareils oraux à haute fréquence et l’oscillation de la paroi thoracique à haute fréquence (HFCWO) .2 Les masques de pression positive de fin d’expiration et les appareils oraux à haute fréquence nécessitent un effort actif, la maîtrise de la technique et / ou une agilité physique qui peut limiter leur utilisation.2
Le HFCWO est utilisé pour le dégagement des voies respiratoires chez les patients présentant un large éventail de troubles des voies respiratoires. ng maladies et affections, y compris les troubles génétiques et immunologiques, les maladies neuromusculaires et les affections pulmonaires obstructives, telles que l’asthme et la MPOC.15-18 Contrairement à certaines autres méthodes, le HFCWO nécessite une activité minimale de l’utilisateur et ne dépend pas d’un fournisseur de soins de santé. Des études cliniques, principalement chez des patients atteints de fibrose kystique, ont montré que le HFCWO est sûr et efficace.2,15,19-22 Le HFCWO délivre des impulsions de compression à la paroi thoracique par le biais d’un gilet gonflable connecté à un générateur d’impulsions d’air .2 Le générateur produit un flux d’air alterné dans et hors de la veste qui comprime et libère rapidement la paroi thoracique dans une plage de fréquences et de pressions sélectionnables. Il a été rapporté que la compression oscillatoire appliquée à la paroi thoracique amincit le mucus visqueux, déconnecte le mucus de la paroi pulmonaire et propulse le mucus des voies respiratoires mineures des poumons vers les voies respiratoires principales où il peut être expectoré ou aspiré.2,23, 24 HFCWO peut conduire à une amélioration significative du volume pulmonaire de 15 à 57 ml et du débit jusqu’à 1,6 L / s.22
Une étude de cas antérieure a évalué les résultats cliniques de la thérapie SmartVest® Airway Clearance System en cas d’exacerbation l’utilisation des soins de santé et l’utilisation de médicaments chez les sujets atteints de bronchectasie non kystique.25 L’étude a révélé que l’utilisation de SmartVest entraînait une réduction statistiquement significative de 60% des exacerbations liées à la bronchectasie, y compris l’utilisation d’antibiotiques, les visites aux urgences et les hospitalisations. . L’étude actuelle est conçue pour évaluer l’impact économique de la thérapie SmartVest sur les soins de santé liés à la bronchectasie et les coûts des antibiotiques.
Méthodes
Un récent SmartVest (Electromed, Inc., New Prague, MN , États-Unis), une étude clinique basée sur les résultats de l’examen de cas a servi de base à cette analyse.25 L’étude a enregistré toutes les exacerbations liées à la bronchectasie pour inclure le nombre d’hospitalisations, de visites à l’urgence et l’utilisation d’antibiotiques pendant une période d’un an avant l’utilisation de SmartVest (contrôle de soins standard) et, à titre de comparaison, pendant une période d’un an après le début de Utilisation de SmartVest (traitement). L’étude n’a inclus que les sujets avec un diagnostic de bronchectasie non fibrose kystique qui utilisaient SmartVest depuis au moins un an et dont les dossiers médicaux étaient disponibles pendant un an avant le début du traitement par SmartVest. Les patients étaient exclus s’ils n’avaient pas respecté leur schéma thérapeutique SmartVest prescrit, n’avaient pas pu être contactés par téléphone ou avaient expiré. Toutes les données collectées avant l’utilisation de SmartVest ont été capturées via les dossiers médicaux du patient.
Les dossiers médicaux du patient ont été examinés pour toutes les exacerbations liées à la bronchectasie survenues au cours d’une période d’un an avant le début du traitement par SmartVest. Les sujets ont été contactés et interrogés par téléphone pour recueillir les exacerbations liées à la bronchectasie pendant la période d’un an après le début du traitement par SmartVest. Le questionnaire de l’enquête téléphonique a été développé dans le seul but de l’étude. Au cours de l’entrevue téléphonique, le sujet s’est vu poser des questions spécifiques concernant l’utilisation d’antibiotiques liés à la respiration, les visites au service d’urgence et les hospitalisations. L’entrevue a également demandé si le patient utilisait SmartVest conformément au régime de prescription du médecin.
Les coûts des antibiotiques ont été déterminés à l’aide du «prix des pharmacies à rabais en ligne», mais le coût des visites au cabinet et les honoraires du médecin n’ont pas été inclus . Les coûts d’hospitalisation et de SU ont été déterminés à l’aide des estimations nationales pondérées tirées de l’Échantillon national des patients hospitalisés (NIS) du projet de coût et d’utilisation des soins de santé (HCUP), 2013, Agency for Healthcare Research and Quality (AHRQ), sur la base des données collectées par les États et fournies à AHRQ by the States.26 La base de données du NIS comprend un échantillon probabiliste stratifié d’hôpitaux provenant de bases de données de l’état des patients hospitalisés qui incluent les hospitalisations de patients avec Medicare, Medicaid, une assurance privée et des personnes non assurées.27 Le NIS contient des données de 5 à 8 millions d’hospitalisations d’environ 1 000 hôpitaux. Il est désigné pour représenter environ 20% des hôpitaux de courte durée non fédéraux des États-Unis tels que définis par l’American Medical Associ. ation. Le NIS provient d’États participant au projet de coût et d’utilisation des soins de santé. Le NIS contient des données uniformes sur les séjours des patients hospitalisés à partir des bases de données sur les congés des hôpitaux maintenues par des agences d’État, des associations d’hôpitaux et d’autres organisations privées. Le nombre total de sorties pondérées aux États-Unis sur la base du HCUP NIS était de 35 597 792,28.
Résultats
L’examen des bases de données HCUP et Medicare a révélé des coûts de santé associés à une exacerbation liée à la bronchectasie
être 450 $ (2012) pour une visite à l’urgence et 9 300 $ (2010) pour une hospitalisation pour pneumonie. Les séjours prolongés à l’hôpital en raison de complications ou de comorbidités n’ont pas été calculés. En utilisant les calculs de prix des pharmacies à rabais en ligne, le coût d’un traitement antibiotique standard pour la pneumonie était de 290 $ (2016). Les honoraires du médecin pour une visite au cabinet et la prescription ultérieure n’étaient pas disponibles pour le calcul.
Sur les 104 patients bronchectasiques SmartVest identifiés, 59 patients répondaient aux critères d’inclusion / exclusion.25 Dans la population de l’étude, le nombre moyen des prescriptions d’antibiotiques par an était de 58% de moins pour SmartVest (0,6 / an) par rapport au contrôle standard de soins (1,4 / an) (voir tableau 1). L’utilisation de SmartVest a également réduit de manière significative les visites à l’urgence de 63% (0,08 / an contre 0,03 / an) et les hospitalisations de 60% (0,5 / an contre 0,2 / an). Les coûts annuels par patient des antibiotiques pour les patients traités avec SmartVest étaient inférieurs d’environ 233 $ à ceux traités avec des soins standard (voir le tableau 1). Les hospitalisations, après un an d’utilisation de SmartVest, ont également été considérablement réduites de 2 790 $ par patient et par an. Au total, les résultats globaux ont révélé une économie annuelle de 3 045 $ par patient et par an grâce à l’utilisation de SmartVest.
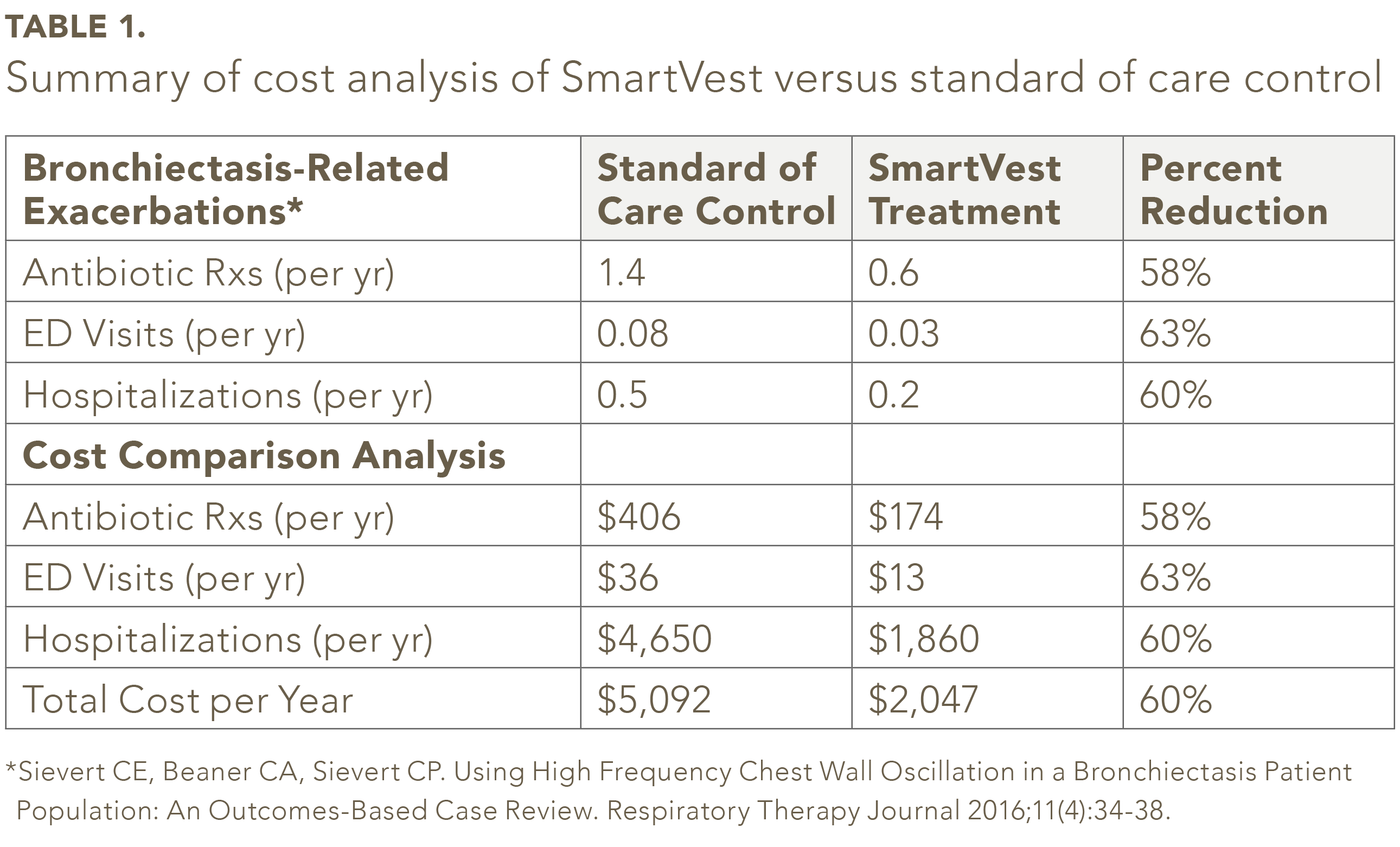
L’analyse n’a pas tenir compte des frais médicaux / de cabinet engagés pour obtenir une prescription d’antibiotique sans hospitalisation. De plus, l’analyse n’a pas tenu compte d’une visite au cabinet pour une exacerbation potentielle qui n’a pas entraîné de prescription ou d’hospitalisation. De plus, l’analyse n’a pas tenu compte des dépenses supplémentaires si l’exacerbation était une pneumonie de souche bactérienne résistante aux antibiotiques qui, selon les rapports, peut coûter plus de 15 000 $ pour chaque épisode.
Discussion
Le but de l’analyse visait à évaluer l’impact économique de l’utilisation de SmartVest sur les coûts médicaux associés à la bronchectasie par rapport à un contrôle standard de soins. À notre connaissance, il s’agit de la première étude à évaluer les coûts de santé liés au traitement des patients atteints de bronchectasie non kystique atteints de fibrose kystique atteints de HFCWO.Le coût global comprenait le coût des antibiotiques, des visites à l’urgence et des hospitalisations liées aux exacerbations associées à la bronchectasie non kystique. L’étude a démontré une réduction significative de l’utilisation des soins de santé et du coût associé lorsque les patients atteints de bronchectasie étaient traités avec SmartVest pendant un an. Le coût global a été réduit de 60%, ce qui se traduit par une économie de 3 045 $ par patient et par an.
Une étude récente qui a évalué les sorties d’hôpital, les réadmissions et les visites à l’urgence pour la BPCO ou la bronchectasie chez les adultes aux États-Unis de 2001 à 2012, le nombre de sorties de l’hôpital a augmenté de 88000.31 L’étude a également révélé qu’environ 7% des patients atteints de BPCO ou de bronchectasie étaient réadmis dans les 30 jours avec une BPCO ou une bronchectasie comme diagnostic principal.31 En revanche, le taux de sortie a diminué pour d’autres maladies.31 La raison de l’augmentation significative des visites à l’hôpital et aux urgences pour la MPOC et les bronchectasies n’est pas claire, car une baisse significative des taux de tabagisme a été observée. Cependant, cela peut refléter le potentiel de diagnostic de la maladie et la nature à long terme de la BPCO et de la bronchectasie dans une population vieillissante.31
Une précédente étude de cas basée sur les résultats a rapporté que l’utilisation de SmartVest réduisait les hospitalisations de 1,5 fois, 25 indiquant le rapport coût-bénéfice du HFCWO sur la réduction de l’utilisation des soins de santé. D’autres études ont également évalué les facteurs (à la fois du système et du patient) qui peuvent réduire la réadmission chez les patients atteints de BPCO et sont, au moins en partie, pertinents pour les patients atteints de bronchectasie. Ces facteurs comprennent la continuité avec les soins primaires fournis par les patients ou le pneumologue, l’intervention du coordonnateur des congés et l’étendue ou le type de thérapie respiratoire32-34
La réduction du nombre d’exacerbations liées à la bronchectasie peut également avoir un impact dans une population de patients atteints de BPCO, l’utilisation de SmartVest a été associée à une amélioration significative du score des cinq symptômes P = 0,002 (évaluation des expectorations, respiration sifflante, toux, essoufflement et tolérance à l’exercice Le traitement par SmartVest a également démontré une amélioration significative du St. George’s Respiratory Questionnaire (SGRQ) P = 0,02, alors qu’aucune amélioration n’a été observée chez les patients traités par un traitement conventionnel.36 De même, notre étude antérieure basée sur les résultats d’une revue de cas a révélé que 68 % des sujets ont indiqué lors de l’entretien téléphonique que l’utilisation de SmartVest avait considérablement amélioré leur qualité de vie.25
Plusieurs limites à la conception de l’étude doivent être prises en compte rouge lors de l’interprétation des résultats. La taille des patients de l’étude était petite et les données sur les hospitalisations, les visites à l’urgence et l’utilisation d’antibiotiques après le début du traitement par SmartVest ont été obtenues principalement par le biais d’entretiens avec les patients. L’étude peut être considérée comme conservatrice en raison de l’absence de coût supplémentaire pour les honoraires du médecin associés à une visite au cabinet entraînant une prescription d’antibiotiques ou de l’absence de coût supplémentaire pour une visite au cabinet qui n’a pas abouti à une prescription d’antibiotique. De plus, le recours aux bases de données HCUP, NIS et AHRQ, qui dépendent des diagnostics saisis sur les demandes, peut être mal codé ou pas du tout codé, ce qui peut entraîner une erreur de mesure par rapport aux variables basées sur la CIM-9-CM.
La réduction des coûts d’utilisation des soins de santé tels que l’utilisation d’antibiotiques, les visites à l’urgence et les hospitalisations sont des objectifs prioritaires des récentes directives sur les soins de santé telles que la loi sur les soins abordables (ACA). Par exemple, l’ACA a établi le Programme de réduction des réadmissions dans les hôpitaux (HRRP), qui a ordonné à CMS de pénaliser les hôpitaux en réduisant les remboursements pour les réadmissions excédentaires de patients pour la même condition. Le HRRP a initialement identifié les trois principales «conditions applicables» pour une mesure ciblée de la réadmission, y compris l’infarctus aigu du myocarde, l’insuffisance cardiaque et la pneumonie. De plus, la CMS a récemment finalisé l’expansion des conditions supplémentaires applicables à partir du programme de l’exercice 2015 pour inclure les patients réadmis pour un exacerbation aiguë de la MPOC. La réduction significative de l’utilisation des soins de santé et des hospitalisations chez les patients atteints de bronchectasie non kystique utilisant SmartVest, comme le démontrent cette étude et d’autres, peut jouer un rôle essentiel en aidant les hôpitaux à réduire les réadmissions et donc à ne pas être pénalisés.
Pour les patients qui ont des infections des voies respiratoires résistantes aux antibiotiques oraux, le fardeau est beaucoup plus lourd et plus grave. Les antibiotiques intraveineux compliquent considérablement les soins car une hospitalisation ou une surveillance à domicile est nécessaire. Le traitement de ces patients comprend la mise en place d’un cathéter veineux central, la coordination les doses de médicaments qui doivent souvent être administrées plusieurs fois par jour, des analyses de sang régulières pour surveiller les effets secondaires, et la mesure des taux sanguins de l’antibiotique pendant plusieurs jours, étapes qui deviennent coûteuses et perturbent la vie des patients.
L’Organisation mondiale de la santé (OMS) a déclaré que la résistance microbienne aux antibiotiques constituait une « menace mondiale majeure avec des implications dévastatrices pour la santé publique. » La résistance aux antimicrobiens menace la prévention et le traitement efficaces d’une gamme toujours croissante d’infections causées non seulement par des bactéries, mais également par des virus et des champignons. Les Centers for Disease Control and Prevention (CDC) des États-Unis considèrent la résistance aux antimicrobiens comme l’une de leurs principales préoccupations et priorités. Aux États-Unis seulement, au moins 2 millions de personnes sont infectées par des bactéries résistantes aux antibiotiques et au moins 23000 personnes meurent chaque année des suites directes de ces infections.39 En réponse à l’inquiétude mondiale, les Centers for Medicare des États-Unis & Medicaid Services (CMS) a récemment publié un changement de règle proposé à ses conditions de participation qui, entre autres changements, obligerait les hôpitaux à mettre en œuvre des programmes de gestion des antibiotiques afin de participer aux programmes Medicare et Medicaid. La gestion des antibiotiques comprend l’amélioration des résultats pour les patients par l’adoption de processus et de procédures qui réduisent l’incidence des infections à pa une attention particulière à la pneumonie telle que les soins de traitement préventif. En tant qu’avantage secondaire par rapport aux résultats de rentabilité de cette étude, une réduction significative du besoin d’antibiotiques chez les patients souffrant de bronchectasie par l’utilisation de SmartVest peut avoir des avantages encore plus importants qu’une diminution des coûts. Un traitement disponible qui pourrait réduire considérablement les infections respiratoires et donc le besoin d’antibiotiques s’intègre bien dans les programmes de contrôle des infections de l’hôpital.
En résumé, l’efficacité clinique de la clairance des voies respiratoires HFCWO démontrée par SmartVest chez les patients atteints de BPCO36 et ceux atteints bronchectasie25 et la réduction significative des coûts d’antibiotiques, de dysfonctionnement érectile et d’hospitalisation observée dans cette étude appuient le rapport coût-bénéfice de l’utilisation de SmartVest et plaident en faveur d’une couverture d’assurance de SmartVest par les payeurs. En outre, des avantages secondaires tels que le potentiel de réduire les réadmissions à l’hôpital et le potentiel d’impact pour dissuader la résistance aux antibiotiques peuvent avoir des avantages encore plus importants que la diminution des coûts.
Télécharger le texte de l’étude
Remerciements
Les auteurs tiennent à remercier Elizabeth Goodwin PhD pour son soutien éditorial.
- King P. Pathogenesis of bronchiectasis. Paediatr Respir Rev 2011; 12 (2): 104-110. 10.1016 / j.prrv.2010.10.011
- Braverman J, Miller H. Compression thoracique à haute fréquence: une thérapie pratique pour les patients atteints de bronchectasie. Thérapie respiratoire 2008; 3 (1): 22-26.
- Patel IS, Vlahos I, Wilkinson TM, et al. Bronchectasie, indices d’exacerbation et inflammation dans la maladie pulmonaire obstructive chronique. Am J Respir Crit Care Med 2004; 170 (4): 400-407. 10.1164 / rccm.200305-648OC
- Gono H, Fujimoto K, Kawakami S, et al. Évaluation de l’épaisseur de la paroi des voies respiratoires et du piégeage de l’air par HRCT dans l’asthme asymptomatique. Eur Respir J 2003; 22 (6): 965-971.
- Weycker D, Edelsberg J, Oster G, et al. Prévalence et charge économique de la bronchectasie. Clinical Pulmonary Medicine 2005; 12 (4): 205-209.
- Seitz AE, Olivier KN, Adjemian J, et al. Tendances de la bronchectasie chez les bénéficiaires de l’assurance-maladie aux États-Unis, 2000 à 2007. CHEST Journal 2012; 142 (2): 432-439.
- Seitz AE, Olivier KN, Steiner CA, et al. Tendances et fardeau des hospitalisations associées à la bronchectasie aux États-Unis, 1993-2006. Poitrine 2010; 138 (4): 944-949. 10.1378 / poitrine.10-0099
- Seitz AE, Olivier KN, Steiner CA, et al. Tendances et fardeau des hospitalisations associées à la bronchectasie aux États-Unis, 1993-2006. CHEST Journal 2010; 138 (4): 944-949.
- Weycker D, Edelsberg J, Oster G, et al. Prévalence et charge économique de la bronchectasie. Clinical Pulmonary Medicine 2005; 12: 205-209.
- Fibrosis. AoCPiC. Normes de soins et bonnes pratiques cliniques pour la prise en charge de la physiothérapie de la fibrose kystique 2011. Disponible sur: https://www. cysticfibrosis.org.uk/media/82076/CD Standards of Care Physio 11 juin .pdf.
- O’Donnell AE. Bronchectasie. Poitrine 2008; 134 (4): 815-823. 10.1378 / poitrine.08-0776
- Barker AF. Bronchectasie. N Engl J Med 2002; 346 (18): 1383-1393. 10.1056 / NEJMra012519
- McCool FD, Rosen MJ. Thérapies non pharmacologiques de dégagement des voies respiratoires: lignes directrices de pratique clinique fondées sur des preuves de l’ACCP. Poitrine 2006; 129 (1 Suppl): 250S-259S. 10.1378 / chest.129.1 suppl.250S
- Salathe M, O’Riordan TG, Wanner A. Traitement de la dysfonction mucociliaire. Chest 1996; 110 (4): 1048-1057.
- Arens R, Gozal D, Omlin KJ, et al. Comparaison de la compression thoracique à haute fréquence et de la physiothérapie thoracique conventionnelle chez les patients hospitalisés atteints de fibrose kystique. Am J Respir Crit Care Med 1994; 150 (4): 1154-1157. 10.1164 / ajrccm.150.4.7921452
- Fink JB, Mahlmeister MJ. Oscillation à haute fréquence des voies respiratoires et de la paroi thoracique. Respir Care 2002; 47 (7): 797-807.
- Hansen LG, Warwick WJ.Système de compression thoracique à haute fréquence pour aider à éliminer le mucus des poumons. Biomed Instrum Technol 1990; 24 (4): 289-294.
- Lange DJ, Lechtzin N, Davey C, et al. Oscillation de la paroi thoracique à haute fréquence dans la SLA: un essai exploratoire randomisé contrôlé. Neurology 2006; 67 (6): 991-997. 10.1212 / 01. wnl.0000237439.78935.46
- Warwick WJ, Hansen LG. L’effet à long terme de la thérapie de compression thoracique à haute fréquence sur les complications pulmonaires de la fibrose kystique. Pediatr Pulmonol 1991; 11 (3): 265-271.
- Kluft J, Beker L., Castagnino M, et al. Une comparaison des traitements de drainage bronchique dans la fibrose kystique. Pediatr Pulmonol 1996; 22 (4): 271-274. 10.1002 / (SICI) 1099-0496 (199610) 22: 4 < 271 :: AID-PPUL7 > 3.0.CO; 2- P
- Scherer TA, Barandun J, Martinez E, et al. Effet de l’oscillation à haute fréquence des voies respiratoires et de la paroi thoracique et de la physiothérapie thoracique conventionnelle sur l’expectoration chez les patients atteints de fibrose kystique stable. Chest 1998; 113 (4): 1019-1027.
- Nicolini A, Cardini F, Landucci N, et al. Efficacité du traitement par oscillation de la paroi thoracique à haute fréquence chez les patients atteints de bronchectasie. BMC Pulm Med 2013; 13:21. 10.1186 / 1471-2466-13-21
- Osman LP, Roughton M, Hodson ME, et al. Étude comparative à court terme de l’oscillation de la paroi thoracique à haute fréquence et des techniques européennes de dégagement des voies respiratoires chez les patients atteints de fibrose kystique. Thorax 2010; 65 (3): 196-200. 10.1136 /
thx.2008.111492 - Chatburn RL. Dégagement des voies respiratoires assisté à haute fréquence. Respir Care 2007; 52 (9): 1224-1235; discussion 1235-1227.
- Sievert CE, Beaner CA, Sievert CP. Utilisation de l’oscillation de la paroi thoracique à haute fréquence dans une population de patients atteints de bronchectasie: un examen de cas basé sur les résultats. Journal de thérapie respiratoire 2016; 11 (4): 34-38.
- HCUP. Aperçu de l’échantillon du service d’urgence national (NEDS) 2016. Disponible sur: https://www .hcup-us.ahrq.gov / nedsoverview.jsp.
- Vue d’ensemble des échantillons de patients hospitalisés au niveau national (national). Disponible à l’adresse: https://www .hcup-us.ahrq.gov / nisoverview.jsp.
- Pfuntner A, Wier LM, Steiner C. Coûts des séjours à l’hôpital dans le États-Unis, 2010: Statistical Brief # 146. Synthèses statistiques du Projet d’utilisation et de coût des soins de santé (HCUP). Rockville (MD): Agency for Healthcare Research and Quality (États-Unis); 2006.
- Stein PD, Matta F. Coûts des visites aux urgences et des hospitalisations pour hypertension artérielle pulmonaire.
J Epidemiol Public Health Rev 2016; 1 (3). doi http://dx.doi. org / 10.16966 / 2471-8211.120 - Kangovi S, Grande D. Remboursement de la gestion des soins de transition pour réduire la réadmission de la MPOC. Poitrine
2014; 145 (1): 149-155. 10.1378 / coffre.13-0787 - Ford ES. Sorties d’hôpital, réadmissions et visites à l’urgence pour la BPCO ou la bronchectasie chez les adultes américains: résultats
de l’échantillon national de patients hospitalisés 2001-2012 et de l’échantillon du service d’urgence national 2006-2011. Poitrine 2015; 147 (4): 989-998. 10.1378 / poitrine.14-2146 - Sharma G, Kuo YF, Freeman JL, et al. Visite de suivi ambulatoire et visite au service des urgences de 30 jours et réadmission chez les patients hospitalisés pour maladie pulmonaire obstructive chronique. Arch Intern Med 2010; 170 (18): 1664-1670. 10.1001 / archinternmed.2010.345
- Lainscak M, Kadivec S, Kosnik M, et al. L’intervention du coordinateur de sortie prévient les hospitalisations chez les patients atteints de BPCO: un essai contrôlé randomisé. J Am Med Dir Assoc 2013; 14 (6): 450 e451-456. 10.1016 / j.jamda.2013.03.003
- Revitt O, Sewell L., Morgan MD, et al. Un programme de réadaptation pulmonaire ambulatoire court réduit les réadmissions suite à une hospitalisation pour une exacerbation de la maladie pulmonaire obstructive chronique. Respirologie 2013; 18 (7): 1063-1068. 10.1111 / resp.12141
- Milne RJ, Hockey H, Rea H. La thérapie d’humidification de l’air à long terme est rentable pour les patients atteints de bronchectasie ou de bronchectasie pulmonaire obstructive chronique modérée ou sévère. Value Health 2014; 17 (4): 320-327. 10.1016 / j.jval.2014.01.007
- Chakravorty I, Chahal K, Austin G. Une étude pilote de l’impact de l’oscillation de la paroi thoracique à haute fréquence chez les patients atteints de maladie pulmonaire obstructive chronique avec hypersécrétion de mucus. Int J Chron Obstruct Pulmon Dis 2011; 6: 693-699. 10.2147 / COPD. S22896.
- Martınez-Garcıa MA, et al. Valeur pronostique de la bronchectasie chez les patients atteints de maladie pulmonaire obstructive chronique modérée à sévère. Am J Respir Crit Care Med 2013; Vol 187, Iss. 8, pp 823–831.
- O’Donnell AE. Bronchectasie. Chest 2008; 134: 815–82.
- Centers for Disease Control and Prevention – Site Web sur la résistance aux antibiotiques / antimicrobiens https://www .cdc.gov / drugresistance /