Dilatation aortique dans la maladie de la valve aortique bicuspide | Revista Española de Cardiología (édition anglaise)
Introduction
La valve aortique bicuspide (BAV) est l’anomalie cardiaque congénitale la plus courante, survenant dans 0,5% à 1,4% de la population ; cette anomalie est sporadiquement transmise génétiquement par une voie autosomique dominante, avec une prédominance masculine 3: 1.1 Le BAV est cliniquement important, non seulement en raison des complications valvulaires (dysfonctionnement valvulaire, endocardite infectieuse), mais aussi en raison de son association avec de nombreuses anomalies vasculaires, y compris la dilatation aortique2 (Figure 1).
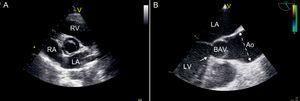
Figure 1. Images échocardiographiques évaluant la valve aortique bicuspide. A: Vue parasternale transthoracique à petit axe montrant la valve aortique bicuspide avec configuration antéro-postérieure. B: Vue en long axe transoesophagien montrant une ouverture systolique anormale (« doming ») d’une valve aortique bicuspide. La dilatation aortique est évidente, commençant au-dessus de la jonction sinotubulaire et étant maximale dans la partie mi-ascendante de l’aorte tubulaire (ligne pointillée). sténose est présente, avec une crête fibreuse provenant de la partie septale de la voie de sortie ventriculaire gauche (flèche). Ao, aorte; BAV, valve aortique bicuspide; LA, oreillette gauche; LV, ventricule gauche; RA, oreillette droite; RV, ventricule droit.
La prévalence rapportée de la dilatation aortique liée au BAV varie de 33% à 80%. Cette variation est basée sur les seuils utilisés pour définir la dilatation, les valeurs normales pour l’âge et la surface corporelle, et la région de L’aorte. Différents types d’anévrismes aortiques ont été décrits selon la région impliquée, 3 étant la dilatation du tractus ascendant moyen (dilatation au niveau de la partie tubulaire ascendante seule) le schéma le plus fréquent observé.4 L’âge et la morphologie du BAV ont également été associés ed avec la dimension de l’aorte ascendante (AscAo), bien que le rôle de la morphologie ne soit pas clairement défini.5, 6
Physiopathologie
Il y a une controverse continue entre 2 théories sur la pathogenèse de la dilatation aortique chez les patients avec BAV. Une théorie soutient que la dilatation de l’AscAo peut être une conséquence de la turbulence du flux sanguin, avec un effet hémodynamique primaire agissant à partir de la vie fœtale et entraînant différents degrés de dégénérescence aortique induite par le stress. Bien que cette hypothèse présente l’avantage d’une relative simplicité, certaines études suggèrent que les altérations hémodynamiques ne peuvent à elles seules être responsables de la dilatation aortique chez ces patients.7 La seconde théorie pose l’hypothèse de la présence d’une anomalie congénitale innée de la structure aortique. L’association entre la disposition des cuspides et la maladie de l’AscAo peut s’expliquer par des modèles de développement anormaux des cellules de la crête neurale, et des anomalies structurelles se produiraient au niveau cellulaire quelle que soit la lésion hémodynamique.8 Cette théorie est devenue de plus en plus populaire au cours de la dernière décennie et a conduit à recommandations plus agressives pour le traitement de l’aorte proximale chez ces patients. Il existe quelques éléments de preuve à l’appui de l’anomalie congénitale prédominante de la paroi:
-
• Chez les patients atteints de BAV (y compris les enfants) dont la valve aortique fonctionne normalement, un élargissement significatif de l’aorte proximale a été observé par rapport à contrôles normaux de même âge. Cependant, un BAV fonctionnant «normalement» est intrinsèquement sténotique, avec un écoulement non axial et turbulent même s’il n’y a pas de gradient de pression transvalvulaire. Ce flux est très excentrique, provoquant des schémas de flux hélicoïdaux anormaux dans l’aorte proximale.9 Ces schémas hémodynamiques anormaux agissent sur de longues périodes et peuvent conduire à des lésions asymétriques de la paroi aortique induites par un stress avec dilatation ultérieure de segments aortiques spécifiques.
-
• Il a été démontré que les patients atteints de BAV avaient des diamètres de racine aortique et d’AscAo plus grands que les patients atteints de valve aortique tricuspide (TAV), même après avoir fait correspondre la gravité hémodynamique des lésions valvulaires.5 Cependant, l’excentricité du jet qui se produit par le biais du BAV n’a pas été analysé.
-
• La dilatation de l’AscAo peut se produire même après le remplacement de la valve aortique.10
-
• Une anomalie intrinsèque de la paroi serait étayée par la mise en évidence d’une anomalie histopathologique sous-jacente aux complications de l’AscAo dans le BAV, à savoir la dégénérescence kystique médiale. Cette découverte pathologique a été observée dans l’aorte de patients atteints de BAV avant la formation d’un anévrisme, et consiste en un composant de matrice extracellulaire réduit et une augmentation des enzymes de dégradation de la matrice dans l’aorte.11, 12, 13 Fait intéressant, bien que des changements histologiques et biomoléculaires similaires se produisent dans Aorte BAV et Marfan, la distribution de ces changements diffère dans les deux conditions, et même dans les anévrismes TAV (Tableau 1), ce qui prône un rôle primordial de l’hémodynamique dans le développement du remodelage réactif de la paroi aortique.
Tableau 1 .Histopathologie de la dégénérescence kystique médiale
Caractéristique Anévrisme BAV Anévrisme de Marfan Anévrisme TAV Réduction des composants ECM Augmentation de l’apoptose des VSMC: réduction de la production de protéines ECM Fragmentation de l’élastine: perte de soutien structurel et d’élasticité Déficit en FB-1: détachement de la VSMC de l’élastine et de la matrice de collagène (perturbation de la matrice) Changement moindre Augmenter les enzymes de dégradation de la matrice Augmenter la MMP -2Augmenter MMP-9Augmenter MMP2 / TIMP-1 Augmenter MMP-12 Augmenter MMP-13 Distribution spatiale CMD Asymétrique Circonférentiel Confiné à la région anévrismale BAV , valve aortique bicuspide; CMD, dégénérescence médiale kystique; ECM, matrice extracellulaire; FB, fibrilline; MMP, métalloprotéinase matricielle; TAV, valve aortique tricuspide; TIMP, inhibiteur tissulaire de la métalloprotéinase; VSMC, cellules musculaires lisses vasculaires.
-
• Enfin, il a été suggéré que la maladie BAV a une héritabilité élevée, la détermination étant presque entièrement génétique. Dans les études sur les familles nombreuses, la prévalence du BAV chez les parents au premier degré (FDR) d’une personne atteinte du BAV a été rapportée à 9%. De plus, certaines études ont rapporté une dilatation de la racine aortique, un anévrisme de l’aorte thoracique ou une dissection aortique chez jusqu’à un tiers des patients atteints de FDR de BAV, qu’un BAV soit ou non présent.14, 15 Bien que de multiples sites génétiques potentiels pour les anévrismes BAV et AscAo aient été suggéré, aucun site défini n’a été fermement établi comme étant responsable de la dilatation aortique dans le BAV.
Taux de dilatation de l’histoire naturelle
Une dilatation aortique a été documentée dans l’enfance, ce qui suggère que cette le processus commence tôt dans la vie. Les informations sur le taux de progression de la maladie aortique associée au BAV varient considérablement, les études rapportant ≈0,3-1,1 mm par an (mm / an) .7 Dans l’étude du comté d’Olmsted, la prévalence de la dilatation d’AscAo (> 40 mm) était de 15%, et dans un sous-ensemble de patients avec des mesures répétées, la prévalence est passée à 39% .16 Bien que de nombreux facteurs de risque soient associés à la dilatation de l’aorte (hypertension, sexe masculin, valvulopathie), la variable la plus importante est probablement l’âge. Des études pédiatriques et adultes ont rapporté que, par rapport aux anévrismes associés au TAV, l’anévrisme lié au BAV s’agrandit plus rapidement et se présente à un âge significativement plus jeune.6, 7 De plus, la dilatation progressive de l’aorte est plus fréquente chez les patients atteints de des aortes plus grosses au départ.
Dissection et rupture aortiques
Bien que la complication aortique la plus redoutée chez les patients atteints de BAV soit la dissection aortique, l’incidence réelle de cette complication reste en débat. La prévalence varie en fonction de la cohorte étudiée, avec une estimation groupée des cas de 4% 17, 18 Certains rapports des centres de référence suggèrent un risque de dissection aortique 5 à 9 fois plus élevé dans le BAV que dans le TAV, alors que d’autres n’ont observé aucune association de ce type .7, 19 Des études récentes ont révélé un risque plus faible. Dans la série de Toronto 20, la prévalence de la dissection était de 0,1% par patient-année de suivi, et dans l’étude du comté d’Olmsted, le risque de dissection aortique sur 25 ans après un diagnostic échocardiographique était de 0,5% .21
En fait, les anévrismes AscAo associés au BAV se disséquent et se rompent avec une gamme de taille comparable à celle des anévrismes d’autres étiologies (moyenne: 60 ± 12 mm; intervalle: 30-108 mm) .22 L’augmentation du risque de dissection et de rupture associé à Le BAV est dû à la prévalence et au taux plus élevés de dilatation aortique, qui survient à un âge significativement plus jeune que les anévrismes idiopathiques AscAo.7, 19 Une comparaison entre les patients atteints de BAV et de TAV a montré que, bien que les patients atteints de BAV avaient un taux de croissance aortique plus élevé ( 1,9 vs 1,3 mm / an), l’incidence de rupture et de dissection était similaire.7 Par conséquent, malgré des taux de croissance plus rapides, des événements négatifs se produisent à des taux similaires et à des diamètres aortiques similaires.
Les patients atteints du syndrome de Marfan ont un probabilité de dissection aortique beaucoup plus élevée à vie n (40%) que les patients atteints de BAV. Cependant, comme la maladie BAV est ≈100 fois plus fréquente que le syndrome de Marfan, la maladie BAV est responsable d’un nombre égal ou supérieur de dissections aortiques que le syndrome de Marfan.22
Diagnostic et surveillance
L’échocardiographie transthoracique (ETT) est généralement la principale technique d’imagerie pour diagnostiquer le BAV (Figure 1), car elle identifie les patients chez qui la racine aortique ou AscAo est hypertrophiée et évalue leur progression dans le temps. La plage normale (AscAo et diamètre de la racine aortique2) doit être corrigée en fonction de l’âge et du sexe.Ces mesures de TTE sont étroitement corrélées aux mesures par tomodensitométrie (TDM) multidétecteurs23 et imagerie par résonance magnétique (IRM) 24, ce qui suggère que la TTE est une modalité d’imagerie précise. Néanmoins, le TTE standard peut ne pas visualiser l’ensemble de l’AscAo et peut ne pas détecter son plus grand diamètre, généralement le plus prononcé dans la partie proximale à mi-AscAo. Il est recommandé de réaliser une IRM ou une tomodensitométrie pour évaluer l’ensemble de l’AscAo lorsqu’il n’est pas correctement visualisé par l’échocardiogramme. Il est également raisonnable d’effectuer une IRM ou une tomodensitométrie de base lors du diagnostic initial d’une dilatation aortique (≥ 45 mm), qui servirait de mesure de référence pendant le suivi en cas de divergences entre les échocardiogrammes en série. Une IRM peut détecter et mesurer avec précision les anévrismes aortiques et confirmer l’anatomie valvulaire, évitant ainsi l’exposition aux contrastes et aux radiations. Récemment, un écoulement hélicoïdal systolique anormal a été démontré par IRM en 4 dimensions, et le degré et la direction de l’excentricité du jet d’écoulement peuvent être cruciaux pour déterminer le risque de formation d’un anévrisme segmentaire.9 L’anatomie aortique spécifique peut dicter quelle étude d’imagerie est optimale. Par exemple, lorsque les anévrismes impliquent la racine aortique, l’IRM est préférable à la tomodensitométrie, car la tomodensitométrie image moins bien la racine et est moins précise dans le dimensionnement de son diamètre. S’il existe une contre-indication à la TDM et à l’IRM, l’ETO est une alternative raisonnable nettement supérieure à l’ETT pour évaluer les anévrismes situés dans la racine aortique (Figure 1), l’arc aortique et l’aorte descendante. La combinaison de l’ETT et de l’angiographie par tomodensitométrie multi-coupes peut fournir toutes les informations nécessaires si une intervention chirurgicale est planifiée.
Lorsqu’un anévrisme de l’aorte thoracique est détecté pour la première fois, il n’est pas possible de déterminer son taux de croissance, et il est donc approprié pour obtenir une étude d’imagerie répétée 6 mois après l’étude initiale. Si la taille de l’anévrisme reste inchangée, il est alors raisonnable d’obtenir une étude d’imagerie sur une base annuelle dans la plupart des cas.25 Cela s’applique également après le remplacement de la valve aortique, car une dilatation aortique progressive peut se produire. Une évaluation de suivi doit être envisagée à des intervalles plus courts en fonction des dimensions aortiques, du taux d’expansion et de l’activité physique. Chez les patients atteints de BAV sans lésions valvulaires significatives et de diamètre aortique normal, un échocardiogramme tous les 2 ans peut être suffisant.
Enfin, le dépistage du FDR des patients BAV doit être envisagé pour détecter une malformation valvulaire aortique et un AscAo dilaté. La TTE peut identifier de manière fiable le FDR avec des anomalies cardiaques structurelles14, 26 (Figure 2). Cependant, l’histoire naturelle du FDR avec une racine aortique légèrement dilatée et un phénotype TAV est inconnue. Par conséquent, des études de suivi à long terme de cette population sont nécessaires, à la fois pour déterminer le taux de dilatation et, à son tour, pour établir la fréquence du dépistage en série des TTE, qui permettrait de détecter raisonnablement la dilatation aortique avant l’apparition de complications.14
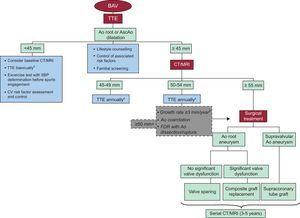
Figure 2. Algorithme montrant le approche générale de la gestion et de la surveillance de la dilatation aortique. Ao, aorte; AscAo, aorte ascendante; BAV, valve aortique bicuspide; CT, tomodensitométrie; CV, cardiovasculaire; FDR, parents au premier degré; IRM, imagerie par résonance magnétique; SBP, pression artérielle systolique; TTE, échocardiogramme transthoracique.aEnvisager un suivi plus précoce en cas de dysfonctionnement valvulaire.bComparaisons en série d’images réalisées avec la même technique d’imagerie, côte à côte, au même niveau aortique.
Management Medical Management
En plus de évaluation d’imagerie de routine, les patients atteints de BAV doivent recevoir des informations sur le risque de dissection et de formation d’anévrisme, ainsi que sur les symptômes typiques de la dissection aortique aiguë (Figure 2).
Les activités ou le mode de vie doivent être modifiés car la haute intensité , les sports de compétition et de collision sont potentiellement dangereux et peuvent précipiter une dissection aortique ou une rupture d’aorte plus que légèrement dilatée (45 mm) .27
Les facteurs de risque cardiovasculaire associés tels que l’hypertension artérielle doivent être contrôlés de manière agressive chez ces patients. Les bêtabloquants peuvent être administrés pour retarder ou prévenir la dilatation ou la progression de la racine aortique chez les patients atteints de BAV (en l’absence de régurgitation aortique sévère) .25, 26 Cependant, la justification de cette recommandation repose sur l’effet du traitement bêtabloquant chez Marfan , 28 et devrait donc être confirmée par de nouvelles recherches. Bien que certaines études aient montré un bénéfice du traitement par un inhibiteur des récepteurs de l’angiotensine et un inhibiteur de l’enzyme de conversion de l’angiotensine chez les personnes atteintes du syndrome de Marfan29, 30, il n’existe actuellement aucune donnée démontrant un bénéfice similaire de ces thérapies dans la maladie d’anévrisme du BAV.
La prise en charge médicale de la maladie BAV n’inclut pas actuellement les statines, qui peuvent potentiellement limiter la dilatation aortique en réduisant l’expression de la métalloprotéinase de la matrice et en améliorant la fonction endothéliale via une augmentation de l’oxyde nitrique synthase endothélial.31 Un récent essai randomisé et contrôlé par placebo impliquant des participants atteints de sténose aortique légère ou modérée a montré que les statines ne modifiaient pas les événements liés à la valve aortique ni la progression de la sténose de la valve aortique.31 Cependant, seulement ≈5% des participants à l’étude avaient un BAV. Des recherches supplémentaires axées sur les effets des statines sur la dilatation, la dissection et la rupture de l’AscAo chez les patients atteints de BAV sont justifiées.
Chirurgie
Le moment optimal de la chirurgie aortique chez les patients atteints de BAV sans indication de chirurgie valvulaire reste incertain en raison de les données limitées disponibles sur l’histoire naturelle de la dilatation aortique asymptomatique (Figure 2). Le diamètre AscAo est la dimension la plus souvent utilisée pour déterminer la taille de l’aorte élargie et est un critère majeur pour recommander une chirurgie élective chez les patients asymptomatiques avec un anévrisme aortique. Les directives actuelles indiquent que la chirurgie pour réparer la racine aortique ou remplacer l’AscAo est indiquée chez les patients atteints de TAV si le diamètre de la racine aortique ou de l’AscAo est ≥ 55 mm, et que les formules qui intègrent la hauteur et la section transversale aortique pour les patients de petite taille doit être utilisé.25, 32, 33 Un seuil plus bas (≥ 50 mm) est recommandé chez les patients Marfan et BAV. Cependant, sur la base de récentes études de suivi à long terme, les différences entre les deux entités sont importantes. Les patients atteints de BAV se situent probablement entre les 2 extrêmes d’un spectre de conditions représentées par le syndrome de Marfan et l’anévrisme dégénératif AscAo, et les critères de taille pour une intervention chirurgicale peuvent être à mi-chemin entre ceux établis pour les deux conditions (50 et 55 mm, respectivement). Chez les patients atteints de BAV présentant des facteurs de risque tels qu’une coarctation aortique, une sténose aortique sévère ou un FDR avec des antécédents de rupture ou de dissection aortique, la chirurgie est recommandée lorsque l’AscAo est ≥ 50 mm et chez ceux subissant un remplacement électif de la valve aortique lorsque celui-ci est ≥ 45 mm. Le taux d’expansion s’est avéré être un autre facteur prédictif majeur de rupture. Un taux de croissance supérieur à 10 mm / an est traditionnellement considéré comme une indication chirurgicale.34 Les progrès récents dans le domaine de l’imagerie cardiovasculaire ont amélioré la reproductibilité des mesures en série. Par conséquent, il y a un accord général pour accepter un taux d’expansion supérieur à 3 mm / an comme valeur seuil pour indiquer la chirurgie, à condition que les comparaisons aient été précisément effectuées côte à côte, avec la même technique d’imagerie, et au même niveau de aorte. Enfin, les critères d’intervention doivent être soigneusement mis en balance avec le risque chirurgical, tant pour le patient (âge, comorbidités, etc.) que pour le centre. Dans les meilleurs centres, la mortalité hospitalière actuelle pour la chirurgie élective de l’AscAo chez les patients jeunes sans comorbidités est d’environ 2% .34, 35 Les caractéristiques des patients, le dysfonctionnement valvulaire aortique, la localisation de la dilatation aortique et le type de chirurgie doivent être pris en compte dans le processus décisionnel. .
Il existe plusieurs options chirurgicales possibles, et le choix dépend de la localisation de l’anévrisme, de l’étendue distale de l’atteinte aortique et de l’état d’anticoagulation souhaité (Tableau 2) .36, 37 En cas de réparation valvulaire ou une intervention d’épargne valvulaire est envisagée, une TEE peut être réalisée avant ou en peropératoire pour définir l’anatomie des cuspides et de l’AscAo.38
Tableau 2. Options chirurgicales pour la maladie de la valve aortique bicuspide
| Technique chirurgicale | Considérations |
| Aortoplastie de réduction avec / sans emballage synthétique externe | • Généralement déconseillé (risque de dilatation récurrente) • Alternative pour les patients avec un s élevé risque d’urgence (surtout si les sinus ne sont pas significativement dilatés) |
| Remplacement de la racine aortique et d’AscAo par réimplantation d’osties coronaires (procédure de Bentall) | Technique standard en patients présentant une valvulopathie significative et une dilatation d’AscAo |
| Remplacement valvulaire aortique et réparation aortique supracoronaire séparée | • Généralement déconseillé (risque de dilatation progressive des sinus) • Alternative pour les patients plus âgés atteints de sténose BAV, de sinus de taille normale et de dilatation de l’AscAo supracoronaire |
| Remplacement de l’aorte valvulaire | Option acceptable pour les jeunes patients souffrant de BAV fonctionnel |
| Autogreffe pulmonaire | • Généralement déconseillée (risque de dilatation de l’autogreffe) • Alternative pour les enfants, adolescents ou jeunes femmes qui souhaitent devenir enceintes |
| Réparation de la valve aortique | Option acceptable si une sélection minutieuse du patient est effectuée |