Faits sur les éléments de cadmium
L’élément chimique cadmium est classé comme métal de transition. Il a été découvert en 1817 par Friedrich Stromeyer.

Zone de données
| Classification: | Cadmium est un métal de transition |
| Couleur: | bleu-blanc |
| Poids atomique: | 112.41 |
| État: | solide |
| Point de fusion: | 321,1 oC, 594,3 K |
| Point d’ébullition: | 765 oC, 1038 K |
| Électrons: | 48 |
| Protons: | 48 |
| Neutrons dans l’isotope le plus abondant: | 66 |
| Coquilles d’électrons: | 2,8,18,18,2 |
| Configuration électronique: | 4d10 5s2 |
| Densité à 20oC: | 8,65 g / cm3 |
Afficher plus, y compris: Chaleur, Energies, Oxydation, Réactions,
Composés, Radii, Conductivités
| Volume atomique: | 13,1 cm3 / mol |
| Structure: | hcp: hexagonal compact |
| Dureté: | 2,0 mohs |
| Capacité thermique spécifique | 0,23 J g-1 K-1 |
| Chaleur de fusion | 6,192 kJ mol-1 |
| Chaleur d’atomisation | 112 kJ mol-1 |
| Chaleur de vaporisation | 99,87 kJ mol-1 |
| 1ère énergie d’ionisation | 867,7 kJ mol-1 |
| 2ème énergie d’ionisation | 1631,4 kJ mol-1 |
| 3ème énergie d’ionisation | 3616,2 kJ mol-1 |
| Affinité électronique | – |
| Nombre minimal d’oxydation | 0 |
| Min. n ° d’oxydation commun. | 0 |
| Indice d’oxydation maximal | 2 |
| Max. oxydation commune no. | 2 |
| Électronégativité (échelle de Pauling) | 1,69 |
| Polarisabilité volume | 7,2 Å3 |
| Réaction avec l’air | doux, w / ht ⇒ CdO |
| Réaction avec 15 M HNO3 | doux ⇒ Cd (NO3) 2, NOx |
| Réaction avec 6 M HCl | doux, ⇒ H2, CdCl2 |
| Réaction avec 6 M NaOH | aucun |
| Oxyde (s) | CdO, CdO2 |
| Hydrure (s) | CdH2 |
| Chlorure (s) | CdCl2 |
| Rayon atomique | 151 pm |
| Rayon ionique (1+ ion) | – |
| Rayon ionique (2+ ion) | 109 pm |
| Rayon ionique (3+ ion) | – |
| Rayon ionique (1 ion) | – |
| Rayon ionique (2 ions) | – |
| Rayon ionique (3 ions) | – |
| Le Conductivité rmale | 96,6 W m-1 K-1 |
| Conductivité électrique | 14,7 x 106 S m-1 |
| Point de congélation / fusion: | 321,1 oC, 594,3 K |

Une petite boule de cadmium métallique, avec une pièce de monnaie pour référence de taille.

Friedrich Stromeyer, qui a découvert le cadmium en 1817.
Voisinage du tableau périodique du cadmium
| Groupe 11 |
Groupe 12 | Groupe 13 | |
| 4 | 29 Cu |
30 Zn |
31 Ga |
| 5 | 47 Ag |
48 Cd |
49 In |
| 6 | 79 Au |
80 Hg |
81 Tl |
Découverte du cadmium
Le cadmium a été découvert par le chimiste allemand Friedrich Stromeyer en 1817 sous forme d’impureté dans l’oxyde de zinc. (1)
Stromeyer a fait sa découverte après une demande du gouvernement d’inspecter les pharmacies de la ville de Hildesheim, en Allemagne.
À cette époque, l’oxyde de zinc était utilisé, comme il l’est encore, pour traiter les affections cutanées. Pour une raison quelconque, les pharmacies de Hildesheim vendaient du carbonate de zinc plutôt que l’oxyde de zinc habituel.
Stromeyer savait que chauffer le carbonate de zinc jusqu’à ce qu’il soit rouge le convertirait en oxyde. Il a fait cela avec des échantillons des pharmacies. Il a découvert que le carbonate blanc brillant s’est transformé en un oxyde qui aurait dû être blanc, mais qui était en fait jaune / orange.
Normalement, cette couleur suggérerait une contamination par le fer ou le plomb, mais Stromeyer n’a trouvé aucune trace de ces éléments.
Il a visité l’usine de Salzgitter où les pharmacies avaient acheté le carbonate de zinc. Il a demandé pourquoi ils vendaient du carbonate de zinc au lieu de l’oxyde habituel.
Le responsable lui a expliqué que leur carbonate de zinc était de la couleur attendue – le blanc – et qu’il était facile à vendre.
Lorsqu’ils ont essayé de convertir le carbonate en oxyde par chauffage, il a toujours viré au jaune. Puisque l’oxyde de zinc devait être blanc, ils ne pouvaient pas le vendre. Ils l’avaient soigneusement analysé pour la contamination par le fer, mais n’en trouvaient pas.
Stromeyer a alors décidé qu’il analyserait soigneusement cet oxyde de zinc jaune lui-même. Il a découvert que la couleur jaune était causée par « la présence d’un oxyde métallique particulier, dont l’existence n’avait pas encore été soupçonnée. »
Il a extrait ce nouvel oxyde métallique de l’oxyde de zinc, puis l’a réduit pour isoler le tout premier cadmium au monde. Il a comparé son apparence à celle du platine et a mesuré sa densité à 8,75 g / cm3 – très proche de celle d’aujourd’hui valeur acceptée.
Il a poursuivi ses recherches et a découvert que d’autres composés de zinc contenaient également son nouveau métal. Il a analysé le métal de zinc «pur» et a découvert que son nouveau métal était présent même dans celui-ci.
Il a estimé que le nouveau métal était présent entre 0,1% et 1% dans le zinc et ses composés, dont il a pu isoler 3 grammes de cadmium métallique pur.
Stromeyer a suggéré le nom de cadmium après «cadmia», le nom latin de la calamine. La calamine est un ancien nom pour un minerai de zinc.
Le cadmium a été découvert indépendamment par le chimiste allemand Karl Hermann en 1818. Hermann avait remarqué une couleur jaune inattendue dans le sulfure de zinc . Le jaune était supposé provenir d’impuretés d’arsenic, mais Hermann s’est rendu compte qu’il était en fait dû à un élément auparavant inconnu ment. (2)


Le tellurure de cadmium est utilisé pour fabriquer des cellules solaires à couches minces, qui peuvent absorbe plus de 90% de la lumière visible. Image: NREL
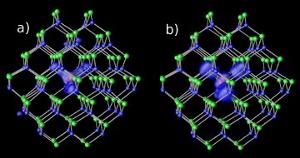
Impuretés de magnésium dans les nanocristaux de cadmium-sélénium à deux niveaux d’écart différents : (a) résonant et (b) hybride. Image: NERSC
Apparence et caractéristiques
Effets nocifs:
Cadmium et ses composés sont hautement toxiques.
Caractéristiques:
Le cadmium est un métal mou, malléable, ductile, blanc bleuté, qui se coupe facilement avec un couteau. C’est un excellent conducteur électrique et montre une bonne résistance à la corrosion et à l’attaque des produits chimiques.
Il est similaire à bien des égards au zinc dans ses propriétés chimiques.
Le cadmium se ternit à l’air et est soluble dans les acides mais pas dans les alcalis.
Le métal brûle dans l’air pour former de l’oxyde de cadmium brun (CdO).
Utilisations du cadmium
L’utilisation principale du cadmium est dans les batteries (notamment rechargeables nickel-cadmium, NiCad, batteries).
En raison de son faible coefficient de frottement et de sa grande résistance à la fatigue, le cadmium est utilisé dans les alliages pour roulements. Le cadmium est utilisé dans les alliages à bas point de fusion et est un composant de nombreux types de brasure. Il est également utilisé dans la galvanoplastie.
Les composés contenant du cadmium sont utilisés dans les luminophores de télévision noir et blanc et dans les luminophores bleu et vert pour les tubes image de télévision couleur. Le sulfure de cadmium est utilisé comme pigment jaune et le séléniure de cadmium est utilisé comme pigment rouge, souvent appelé rouge de cadmium.
Le cadmium et le tellure peuvent être mélangés dans des modules photovoltaïques à couche mince CdTe dont les caractéristiques physiques sont idéales pour production de cellules solaires. Ils sont relativement peu coûteux et ont une bande interdite presque parfaite pour la récolte d’énergie solaire.
Abondance et isotopes
Abondance de la croûte terrestre: 150 parties par milliard en poids, 30 parties par milliard en moles
Système solaire en abondance: 6 parties par milliard en poids, 70 parties par billion en moles
Coût, pur: 46 USD par 100 g
Coût, en vrac: 0,77 USD par 100g
Source: Le cadmium est le plus souvent présent en petites quantités associées aux minerais de zinc, comme la sphalérite (ZnS). La greenockite (CdS) est le seul minéral de cadmium de quelque conséquence que ce soit. Presque tout le cadmium est obtenu comme sous-produit des opérations de raffinage du minerai de zinc, de cuivre et de plomb.

- Friedrich Stromeyer, Annals of Philosophy, édité par Thomas Thomson, Volume XIII, 1819, Robert Baldwin, p108
- JW Mellor, A Comprehensive Treatise in Inorganic and Theoretical Chemistry, Volume IV, 1929, Longmans, Green and Co. Ltd., p404
Citez cette page
Pour les liens en ligne , veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium</a>
ou
<a href="https://www.chemicool.com/elements/cadmium.html">Cadmium Element Facts</a>
À citer cette page dans un document académique, veuillez utiliser la citation suivante conforme MLA:
"Cadmium." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cadmium.html>.