Faits sur les éléments de polonium
L’élément chimique polonium est classé comme chalcogène et métalloïde. Il a été découvert en 1898 par Marie et Pierre Curie.

Zone de données
| Classification: | Le polonium est un chalcogène et un métalloïde |
| Couleur: | gris argenté |
| Poids atomique : | (209), pas d’isotopes stables |
| État: | solide |
| Point de fusion: | 254 oC, 527 K |
| Point d’ébullition: | 960 oC, 1233 K |
| Électrons: | 84 |
| Protons: | 84 |
| Neutrons dans l’isotope le plus abondant: | 125 |
| Coquilles d’électrons: | 2,8 , 18,32,18,6 |
| Configuration électronique: | 4f14 5d10 6s2 6p4 |
| Densité à 20oC: | 9,4 g / cm3 |
Afficher plus, y compris: Chaleur, Energies, Ox idation,
réactions, composés, rayons, conductivités
| Volume atomique: | 22,23 cm3 / mol |
| Structure: | cubique simple |
| Dureté: | – |
| Capacité thermique spécifique | 0,12 J g-1 K-1 0,12 |
| Chaleur de fusion | 13 kJ mol-1 |
| Chaleur d’atomisation | 142 kJ mol-1 |
| Chaleur de vaporisation | 120 kJ mol-1 |
| 1ère énergie d’ionisation | 812 kJ mol-1 |
| 2ème énergie d’ionisation | – |
| 3ème énergie d’ionisation | – |
| Affinité électronique | 180 kJ mol-1 |
| Nombre minimal d’oxydation | -2 |
| Min. n ° d’oxydation commun. | -2 |
| Indice d’oxydation maximal | 6 |
| Max. oxydation commune no. | 4 |
| Électronégativité (échelle de Pauling) | 2.0 |
| Polarisabilité volume | 6,8 Å3 |
| Réaction avec l’air | doux, ⇒ PoO2 |
| Réaction avec 15 M HNO3 | – |
| Réaction avec 6 M HCl | doux, ⇒ PoCl2 |
| Réaction avec NaOH 6 M | aucun |
| Oxyde (s) | PoO2, PoO2 |
| Hydrure (s) | PoH2 |
| Chlorure (s) | PoCl2 |
| Rayon atomique | 190 pm |
| Rayon ionique (1+ ion) | – |
| Rayon ionique (2+ ion) | – |
| Ionique rayon (3+ ions) | – |
| Rayon ionique (1-ion) | – |
| Rayon ionique (2 ions) | – |
| Rayon ionique (3 ions) | – |
| Conductivité thermique | 0,2 W m-1 K-1 |
| Conductivité électrique | 0,7 x 106 S m-1 |
| Point de congélation / fusion: | 254 oC, 527 K |

Marie Curie en 1883, 16 ans. Le polonium a été le premier élément qu’elle a découvert, 15 ans plus tard.
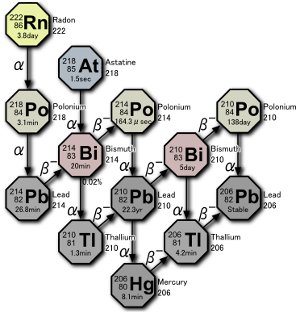
Une partie de la série de désintégration de l’uranium. Trois isotopes du polonium sont produits dans la nature, soit par la désintégration du radon lui-même, soit par la désintégration d’atomes résultant de la désintégration du radon. Image de Tosaka.
Découverte du polonium
Le polonium a été le premier élément découvert par Marie et Pierre Curie.
Ils ont découvert le polonium puis le radium en 1898 à Paris, tout en étudiant la radioactivité de la pitchblende (oxyde d’uranium).
Ils ont écrit: « Nous pensons que la substance que nous avons extraite de la pitchblende contient un métal jamais connu auparavant, similaire au bismuth dans ses propriétés analytiques. Si l’existence de ce nouveau métal est confirmée, nous suggérons qu’il devrait l’être appelé polonium d’après le nom du pays d’origine de l’un de nous. »
Conformément aux souhaits des Curie, le polonium porte le nom de la Pologne, où Marie Curie est née et a grandi.
Les dangers du travail avec des éléments radioactifs n’étaient pas connus lorsque les Curie ont fait leurs découvertes. Leurs cahiers de laboratoire de cette époque sont si radioactifs qu’ils sont maintenant stockés dans un étui plombé. (1)
Apparence et caractéristiques
Effets nocifs:
Le polonium est nocif à la fois par sa toxicité chimique et sa radioactivité. Le polonium 210 est un émetteur alpha. En tant que tel, il est très dangereux en cas d’ingestion ou d’inhalation.L’exposition au polonium augmente le risque de contracter divers cancers.
Caractéristiques:
Le polonium est un métalloïde rare, gris argenté, radioactif et à bas point de fusion.
Le polonium réagit facilement avec les acides dilués, mais seulement légèrement avec les alcalis.
Tous ses isotopes sont radioactifs.
Le 210Po émet une lueur bleue, car l’air qui l’entoure est excité par la désintégration des produits. 1 gramme de Po émet autant de particules alpha que 5 kilogrammes de radium.
L’énergie libérée par la désintégration alpha du polonium est considérable et chauffe l’espace qui l’entoure. L’énergie libérée est si grande (140 W / g) qu’une capsule contenant environ un demi-gramme atteint une température supérieure à 500 ° C.
Utilisations du polonium
Les rayons alpha émis par le polonium peut être utilisé pour éliminer l’électricité statique produite lors de processus tels que le papier à rouler, le fil et la tôle. Cependant, les sources de rayons bêta sont plus couramment utilisées car elles sont moins dangereuses.
Le 210Po peut être utilisé comme source de chaleur atomique, mais en raison de la courte demi-vie de l’isotope (138,4 jours), il ne fournit pas d’énergie pour des utilisations à long terme.
Le polonium est également utilisé dans les brosses antistatiques pour éliminer la poussière sur les pellicules photographiques. Il est scellé dans des brosses pour contrôler les émissions radioactives.
Abondance et isotopes
Abondance de la croûte terrestre: De l’ordre de 1 partie par quadrillion.
Abondance du système solaire: négligeable
Coût , pur: pour 100g
Coût, en vrac: pour 100g
Source: Le polonium est un élément très rare en raison de la courte demi-vie de tous ses isotopes. Il se trouve dans les minerais d’uranium en quantités infimes. Il peut être obtenu en bombardant du bismuth naturel, 209Bi, avec des neutrons pour donner 210Bi, qui se désintègre ensuite en 210Po par désintégration β. Environ 100 g de polonium sont synthétisés chaque année.
Isotopes: Le polonium possède 29 isotopes dont les demi-vies sont connues, avec des nombres de masse de 190 à 218. Aucun n’est stable. L’isotope le plus stable est le 209Po, avec une demi-vie de 102 ans.

Citer cette page
Pour créer des liens en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/polonium.html">Polonium</a>
ou
<a href="https://www.chemicool.com/elements/polonium.html">Polonium Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation suivante conforme MLA:
"Polonium." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/polonium.html>.