Faits sur les éléments du francium
L’élément chimique francium est classé comme métal alcalin. Il a été découvert en 1939 par Marguerite Perey.

Zone de données
| Classification: | Francium est un métal alcalin |
| Couleur: | gris argenté-métallique (présumé) |
| Atomique poids: | (223), pas d’isotopes stables |
| État: | solide |
| Point de fusion: | 27 oC, 300 K |
| Point d’ébullition: | 677 oC, 950 K |
| Électrons: | 87 |
| Protons: | 87 |
| Neutrons dans l’isotope le plus abondant: | 136 |
| Coquilles d’électrons: | 2, 8,18,32,18,8,1 |
| Configuration électronique: | 7s1 |
| Densité à 20oC: | 1,873 g / cm3 |
Afficher plus, y compris: Chaleur, Energies, Oxydation,
Réactions, composés, rayons, conductivités
| Volume atomique: | 71,07 cm3 / mol |
| Structure: | supposée être bcc: cubique centrée sur le corps |
| Dureté: | – |
| Capacité thermique spécifique | – |
| Chaleur de fusion | 2 kJ mol-1 |
| Chaleur d’atomisation | 73 kJ mol-1 |
| Chaleur de vaporisation | 64 kJ mol-1 |
| 1ère énergie d’ionisation | 384 kJ mol-1 |
| 2ème énergie d’ionisation | – |
| 3ème énergie d’ionisation | – |
| Affinité électronique | – |
| Nombre minimal d’oxydation | 0 |
| Min. n ° d’oxydation commun | 0 |
| Indice d’oxydation maximal | 1 |
| Max. oxydation commune no. | 1 |
| Électronégativité (échelle de Pauling) | 0.7 |
| Polarisabilité volume | 48,7 Å3 |
| Réaction avec l’air | – |
| Réaction avec 15 M HNO3 | – |
| Réaction avec 6 M HCl | vigoureux, ⇒ H2, FrCl |
| Réaction avec NaOH 6 M | vigoureux, ⇒ H2, FrOH |
| Oxyde (s) | – |
| Hydrure (s) | – |
| Chlorure (s) | – |
| Rayon atomique | – |
| Rayon ionique (1+ ion) | 194 pm |
| Rayon ionique (2+ ions) | – |
| Rayon ionique (3+ ions) | – |
| Rayon ionique (1-ion) | – |
| Rayon ionique (2 ions) | – |
| Rayon ionique (3 ions) | – |
| Conductivité thermique | 3,61 W m-1 K-1 |
| Conductivité électrique | – |
| Point de congélation / fusion: | 27 oC, 300 K |

Cet échantillon de minerai d’uranium contient environ 100 000 atomes de francium-223 (3,3 x 10-20 g). Le francium est radioactif; il en existe moins de 30 g sur Terre à un moment donné. Image Réf. (1)
Découverte de Francium
Francium a été découvert par Marguerite Perey en 1939 alors qu’elle faisait des recherches sur la désintégration radioactive de l’actinium-227.
La découverte a eu lieu à l’Institut Curie à Paris. L’élément tire son nom du pays de sa découverte – la France.
La découverte a commencé, en 1935, lorsque Perey, âgé de 26 ans, a lu un document de recherche affirmant que des scientifiques américains avaient découvert des particules bêta émises par l’actinium qui avait une quantité d’énergie plus élevée que la normale.
Perey était curieuse de connaître cette découverte, et étant déjà une experte des travaux liés à l’actinium, elle a décidé de mener ses propres expériences sur l’actinium. Elle a produit un échantillon d’actinium ultra-pur et a étudié son rayonnement. Perey a découvert qu’environ 1% de la radioactivité des actiniums était causée par l’émission de particules alpha, et non de particules bêta.
Perey avait découvert que l’actinium-227 pouvait se désintégrer en émettant un noyau d’hélium (également appelé particule alpha) depuis son propre noyau. Le noyau fille formé était un élément encore inconnu qu’elle a choisi d’appeler francium pour honorer son pays d’origine, la France.
227Ac → 223Fr + 4He
Avec 87 protons, le nouvel élément appartenait Groupe 1 du tableau périodique, réunissant les cinq autres métaux alcalins: lithium, sodium, potassium, rubidium et césium.
La découverte du francium a complété les découvertes par l’humanité des éléments naturels.
Tous les éléments découverts depuis lors ont été découverts lorsque l’élément a été produit en laboratoire.

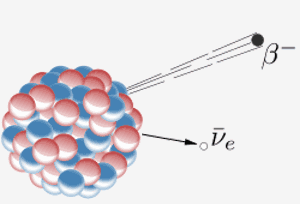
Un noyau émet une particule bêta ( un électron) et un antineutrino. Le résultat de ceci est qu’un neutron dans le noyau se transforme en proton. Lorsque l’élément 87 du tableau périodique (francium) fait cela, le proton supplémentaire signifie qu’il devient l’élément 88 (radium).
Apparence et Caractéristiques
Effets nocifs:
Le francium est hautement radioactif.
Caractéristiques:
Le francium est un métal lourd, instable et radioactif avec une demi-vie maximale de seulement 22 minutes. Il a un point de fusion bas (27 oC, 81 oF) et, s’il pouvait en accumuler suffisamment, il serait liquide dans une pièce chaude.
Le francium est le deuxième élément le plus rare de la croûte terrestre, à côté d’astatine. Moins de trente grammes de francium existent sur Terre à un moment donné.
Le francium est le moins électronégatif de tous les éléments, il devrait donc être le métal alcalin le plus réactif chimiquement. Malheureusement, il n’est pas disponible en quantité suffisante pour montrer qu’il réagit avec l’eau – il est fabriqué en infimes quantités dans des accélérateurs de particules. En théorie, sa réaction avec l’eau serait plus violente que celle du césium et beaucoup plus violente que celle du sodium.
Le francium a été étudié plus récemment à l’Université Stony Brook de New York. Les scientifiques y ont piégé jusqu’à dix mille atomes de francium à la fois en utilisant des faisceaux laser dans un champ magnétique afin de mesurer leurs propriétés.
Utilisations du francium
Sur le plan commercial, il n’y a aucune utilisation du francium, en raison de sa rareté et de son instabilité. Il est utilisé à des fins de recherche uniquement.
Décomposition du Francium
Les isotopes du Francium, avec des nombres de masse allant de 200 à 232, subissent le plus souvent une désintégration alpha ou bêta.
Voici quelques exemples de chemins de désintégration du francium:
Le francium-223 est l’isotope de plus longue durée de vie de l’élément. Il a une demi-vie de 22 minutes. Il peut émettre une particule alpha (un noyau d’hélium) pour former de l’astatine-219 ou une particule bêta pour former du radium-223. (Une particule bêta est un électron émis par un noyau lorsqu’un neutron se transforme en proton.)
Le francium-221 a une demi-vie de 5 minutes. Il peut émettre une particule alpha pour former de l’astatine-217 ou une particule bêta pour devenir du radium-221.
Le francium-216 a une demi-vie de 0,7 microseconde. Il peut émettre une particule alpha pour former de l’astatine-212 ou un positron pour former du radon-216.
Le francium-212 a une demi-vie de 19 minutes. Il peut émettre une particule alpha pour former de l’astatine-208 ou capturer un électron orbital pour former du radon-212. (2) (Lors de la capture d’électrons orbitaux, le noyau capture l’un des propres électrons de l’atome et émet un neutrino.)
Abondance et isotopes
Abondance de la croûte terrestre: ~ 0 partie par million , ~ 0 partie par million
Système solaire d’abondance: ~ 0 partie par milliard en poids, ~ 0 partie par milliard en moles
Coût, pur: $ par 100g
Coût, en vrac: $ par 100g
Source: Le francium se produit naturellement à la suite de la désintégration radioactive alpha de l’actinium.
Isotopes: Le francium a 33 isotopes dont la demi-vie sont connus, avec des nombres de masse de 200 à 232. Aucun n’est stable. 223Fr a la demi-vie la plus longue à 21,8 minutes.

- Photo de Konrad Roeder
- EK Hyde, un. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, p765, Issue 6.
Citez cette page
Pour créer un lien en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
ou
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser le citation conforme MLA suivante:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.