Frontières de la microbiologie cellulaire et infectieuse
Introduction
Staphylococcus aureus est un pathogène humain important isolé des patients hospitalisés dans le monde entier, qui provoque des infections nosocomiales et communautaires ( Lowy, 1998). Ce pathogène est l’agent étiologique de plusieurs infections systémiques différentes, affectant la peau et les tissus mous, ainsi que les systèmes musculo-squelettique et circulatoire (Lowy, 1998; Changchien et al., 2016). Il a été signalé que S. aureus pouvait survivre dans les macrophages humains dérivés de monocytes (Kubica et al., 2008). La virulence de S. aureus est étroitement associée à une variété d’enzymes sécrétées et de toxines produites par les bactéries (Otto, 2014). L’hémolysine, la leucocidine (Panton – Valentine leucocidin, PVL) et la toxine du syndrome de choc toxique-1 (TSST-1), qui facilitent l’endommagement de la membrane des globules rouges, la fonction phagocytaire des leucocytes et l’induction du syndrome de choc toxique respectivement, sont essentielles pour le processus pathogènes de S.aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube et Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Des études récentes ont démontré que l’hémolysine participe également à la formation du biofilm de S. aureus (den Reijer et al., 2016). La prévalence croissante des souches de S. aureus multirésistantes dans les environnements hospitaliers et communautaires augmente encore les dangers de S. aureus et pose un sérieux défi pour la thérapie clinique (Voss et Doebbeling, 1995; Evangelista Sde et de Oliveira, 2015).
Récemment, un certain nombre de souches appartenant à une classe de S. aureus avec un phénotype hémolytique incomplet (SIHP) ont été trouvées dans notre hôpital. L’hémolyse causée par ces souches SIHP est significativement différente de l’anneau hémolytique complet (phénotype β-hémolytique) produit dans d’autres souches de S. aureus. Cependant, ces souches SIHP n’ont pas encore été identifiées et caractérisées de manière exhaustive. Pour explorer les caractéristiques microbiologiques de ces souches de SIHP, nous avons collecté 60 souches de SIHP et les avons étudiées en utilisant plusieurs critères, notamment le phénotype hémolytique, l’expression du gène de l’hémolysine, les caractéristiques de résistance aux médicaments et la virulence. Cette étude démontre que les SIHP sont des souches résistantes à la méthicilline qui expriment fortement la β-hémolysine et possèdent un potentiel de virulence élevé.
Matériel et méthodes
Souches bactériennes
Soixante SIHP Les souches ont été isolées de patients admis dans le deuxième hôpital affilié de l’Université de Soochow entre 2013 et 2015. Des échantillons en double de chaque patient ont été prélevés pour analyse. Ces isolats ont ensuite été cultivés sur des plaques de gélose au sang de mouton Columbia (CHROMagar Company, Shanghai, Chine) à 35 ° C dans une atmosphère contenant 5% de CO2 (v / v). L’identité des souches comme S. aureus a été confirmée en utilisant le système de microbiologie automatisé Phoenix-100 (Becton, Dickinson and Company, USA). Les souches de S. aureus témoins, avec un phénotype hémolytique complet, ont été isolées chez des patients de notre hôpital au cours de la même période. Ici, S. aureus avec le phénotype hémolytique complet était appelé souches SCHP. La souche de référence S. aureus ATCC25923 (Shanghai Center for Clinical Laboratory, Chine) possède le phénotype hémolytique complet et a également agi comme souche témoin. Le comité d’éthique médicale du deuxième hôpital affilié de l’Université de Soochow a approuvé cette étude et tous les isolats ont été collectés avec le consentement du patient dans cette étude.
Analyses comparatives du phénotype hémolytique incomplet
Le S. aureus Les souches ont été cultivées sur des plaques de gélose au sang commerciales de différentes sociétés (CHROMagar, Autobio Diagnostics Co., Ltd., Chine et BioMérieux, Chine) ainsi que sur des plaques de gélose au sang de mouton auto-préparées en utilisant de la poudre d’agar au sang de Columbia (OXIDE, Royaume-Uni). Les bactéries ont été cultivées à 35 ° C dans une atmosphère contenant 5% de CO2 (v / v) pendant 24 h puis ont subi un passage en série. Le phénomène hémolytique a alors été observé. Des souches cliniquement isolées avec un phénotype hémolytique complet et la souche de référence ATCC25923 ont également été observées comme contrôle pour des analyses comparatives.
Détermination des niveaux d’ARNm de quatre gènes d’hémolysine de S. aureus par transcription inverse Quantitative en temps réel PCR (qPCR)
L’extraction de l’ARN total du SIHP et de la souche de référence ATCC25923 a été entreprise comme décrit précédemment (Qin et al., 2014). Initialement, les cellules ont été lysées à l’aide de la lysostaphine, du lysozyme et de la protéinase K. L’ARN a ensuite été extrait et purifié en utilisant RNeasy Mini Kit (Qiagen) selon le protocole recommandé par le fabricant. La qualité et la concentration de l’ARN ont été évaluées à l’aide du NanoDrop1000. L’ARN a ensuite été inversé -transcrit en ADNc en utilisant un kit de transcription inverse (Thermo Fisher Scientific Inc., USA) selon les instructions du fabricant.Brièvement qPCR a été conduit comme suit: pré-dénaturation à 94 ° C pendant 3 min, dénaturation à 94 ° C pendant 30 s, recuit à 52 ° C pendant 30 s, allongement à 72 ° C pendant 40 s, un total de 45 cycles . Chaque échantillon avait trois répétitions techniques et trois répétitions biologiques. Le profil transcriptionnel de chacun des quatre gènes de l’hémolysine et du gène de l’ARNr 16s a été déterminé en utilisant la méthode 2-ΔΔCt. Le niveau de transcription a été déterminé par rapport à l’expression du gène de l’ARNr 16s. Les séquences de quatre gènes d’hémolysine (hla, hlb, hlgC et hld) ont été extraites de la base de données GenBank. Le logiciel Primer 5.0 a été utilisé pour concevoir les amorces (tableau 1) et ces amorces ont été synthétisées par Sangon Biotech Co., Ltd. (Shanghai, Chine).
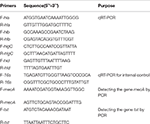
Tableau 1. Amorces utilisées dans cette étude.
SPSS 17.0 a été utilisé pour l’analyse des données. Les données de mesure sont présentées sous forme de x̄ ± s. Un test T pour deux échantillons indépendants a été utilisé pour comparer l’expression relative de chacun des quatre gènes d’hémolysine. La signification statistique a été définie comme étant p < 0,05.
Détection de l’expression de l’α-hémolysine (Hla) par Western Blot
La concentration du Le SIHP et la souche de référence S. aureus ATCC25923 ont été ajustés à 5,0 McFarland à l’aide d’un turbidimètre. La protéine totale a ensuite été extraite de chaque échantillon, ajustée à la même concentration et a subi une électrophorèse sur un gel SDS-PAGE. Les protéines ont ensuite été transférées sur une membrane de nitrocellulose et la membrane a été bloquée avec du lait écrémé à 5% pendant 1 h. Des anticorps polyclonaux de chèvre anti-staphylococcique α-hémolysine (Abcam) ont été ajoutés à une concentration finale de 2 μg / mL. Le mélange réactionnel a ensuite été incubé à 4 ° C pendant une nuit. Après le lavage de la membrane, des anticorps IgG de lapin anti-chèvre marqués à la HRP dilués à 1: 1000 ont été ajoutés et incubés à 37 ° C pendant 2 h. Enfin, des substrats chimioluminescents ont été ajoutés pour le développement de la couleur. L’expression de l’α-hémolysine a finalement été observée sous l’imageur.
Test de sensibilité aux antimicrobiens du SIHP
La méthode de dilution en bouillon de microtitrage a été utilisée pour effectuer le dépistage de la sensibilité aux antimicrobiens. La procédure a été réalisée conformément au manuel opérationnel du système de microbiologie automatisé Phoenix-100. Les résultats de ce dépistage ont été interprétés à l’aide des critères M100-S24 introduits par le Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014). Le statut de S. aureus résistant à la méthicilline (SARM) a été déterminé en utilisant la CMI (concentration minimale inhibitrice) de deux antibiotiques. Pour les souches SIHP, ≥4 μg / mL était la CMI de l’oxallicine et ≥8 μg / mL était la CMI de la céfoxitine.
Détection des gènes mecA et tst
Tous les 60 SIHP souches ont été testées pour le gène de résistance aux médicaments mecA et le gène de virulence tst. L’extraction par ébullition de l’ADN génomique a été réalisée après la lyse cellulaire à l’aide de la lysostaphine. Les gènes mecA et tst ont ensuite été amplifiés à partir de l’ADN génomique à l’aide du kit DreamGreen Taq. Les conditions de PCR étaient les suivantes: pré-dénaturation à 94 ° C pendant 3 min, dénaturation à 94 ° C pendant 30 s, annelage à 50 ° C pendant 30 s, extension à 72 ° C pendant 1 min. Les produits de PCR ont été séquencés et analysés par BLAST pour valider comme étant les produits attendus. Les séquences du gène de résistance aux médicaments mecA et du gène de virulence tst de S. aureus ont été extraites de la base de données GenBank. Le logiciel Primer 5.0 a été utilisé pour concevoir les amorces (tableau 1) et ces amorces ont été synthétisées par Sangon Biotech Co., Ltd. (Shanghai, Chine).
Détection de la survie des souches de S. aureus SIHP dans Macrophages
Pour comparer la survie des souches de S.aureus SIHP dans les macrophages avec celle des souches de S.aureus SCHP tst négatives, la lignée cellulaire de monocytes humains THP-1 a été maintenue dans RPMI-1640 contenant 10% (v / v) FBS à 37 ° C dans une atmosphère contenant 5% (v / v) de CO2. Pour l’infection des macrophages, les cellules THP-1 ont été ensemencées à 5 × 105 cellules par puits dans des boîtes de culture tissulaire à 24 puits et induites à se différencier par 10 à 7 M de phorbol 12-myristate 13-acétate (PMA) pendant 48 h. Approximativement 3 x 108 unités formant colonies (CFU) de bactéries en phase logarithmique (OD600 0,5-0,6) ont été culottées par centrifugation, lavées deux fois avec du PBS et remises en suspension dans 1 ml de RPMI-1640. Ensuite, des bactéries ont été ajoutées à la monocouche cellulaire à une MOI de 20: 1, et centrifugées pendant 5 minutes à 1000 tr / min. Les cellules infectées ont été incubées pendant 20 min à 37 ° C, puis ont été lavées trois fois avec du PBS préchauffé (pH 7,4) et incubées pendant 1 h supplémentaire dans un milieu contenant 100 ug / ml de gentamicine pour tuer les bactéries extracellulaires. Les cellules ont été lavées et lysées pour quantifier la bactérie intracellulaire en tant qu’échantillon au temps zéro (T0). Des cellules supplémentaires ont été collectées après 12 ou 24 h d’incubation en présence de milieu de culture tissulaire supplémenté frais contenant 12 pg / ml de gentamicine.La croissance des bactéries dans les cellules THP-1 a été déterminée en divisant le nombre de bactéries intracellulaires à 12 h ou 24 h par le nombre au temps 0 (T12 / T0 ou T24 / T0). L’expérience a été répétée trois fois indépendamment.
Détection de la sécrétion de cytokines des macrophages infectés par S. aureus SIHP souches
Les surnageants de culture de macrophages THP-1 infectés pendant 12 h par des bactéries ont été collectées. Les niveaux de cytokines ont été mesurés par cytométrie en flux FACSCalibur (BD) en utilisant un kit CBA Human Thl / Th2 Cytokine II (BD) selon les instructions du fabricant.
Typage et analyse de séquences multi-focus
Résultats
Phénotype hémolytique de souches SIHP sur plaques de sang de gélose de mouton
Comme le montrent les figures 1A, B, l’anneau hémolytique complet (phénotype β-hémolytique) a été observé dans le contrôle S . aureus après culture de souches sur plaques de gélose au sang pendant 24 h. Cependant, différents phénotypes hémolytiques (appelés ici phénotype hémolytique incomplet) ont été présentés dans les souches SIHP. De plus, le phénotype hémolytique incomplet a pu être observé dans les souches SIHP qui ont grandi dans des environnements différents. conditions incluant des conditions microaérophiles, aérobies et anaérobies respectivement (figures 1C – E). De plus, après 10 passages en série, ce phénotype hémolytique incomplet était toujours maintenu (figure 1F).
Relative Niveaux d’expression de l’ARNm de quatre gènes d’hémolysine
Comme le montre la figure 2, les niveaux d’expression des quatre gènes d’hémolysine hla, hlb, hlgC et hld dans les souches SCHP n’ont présenté aucune différence statistiquement significative (p > 0,05) par rapport à celle des souches témoins ATCC25923. Cependant, les niveaux d’expression de hla, hlgC et hld dans les souches SIHP ont été significativement supprimés de 50, 16,7 et 8,3 fois respectivement (p < 0,05) par rapport à celui de les souches témoins ATCC25923 et SCHP, tandis que l’expression de hlb dans les souches SIHP était significativement multipliée par 7,7 par rapport aux témoins (p < 0,05).
Détection de l’α-hémolysine par Western Blot
L’α-hémolysine codée par Le gène hla est une toxine porogène sécrétée par S.aureus et son poids moléculaire est de 33 kDa (Andrey et al., 2015; Al Laham et al., 2015). L’analyse par Western blot a montré que l’expression de l’α-hémolysine dans les souches SIHP était 40 fois inférieure à celle des souches SCHP et témoins, ce qui est cohérent avec les données de qRT-PCR (Figure 3).

Figure 3. Western blot de α -hémolysine chez S. aureus. ATCC29213: contrôle S. aureus avec le phénotype hémolytique complet; SCHP: S. aureus avec le phénotype hémolytique complet isolé à partir d’échantillons cliniques au cours de la même période; SIHP: S. aureus avec un phénotype hémolytique incomplet.
Résistance aux médicaments du SIHP
Sensibilité aux médicaments testée en utilisant des dilutions de bouillon de microtitrage ont démontré que les valeurs CMI pour l’oxacilline et la céfoxitine étaient toutes > 2 et > 8 μg / mL respectivement dans 60 colorants SIHP . Selon les directives CLSI M100-S24, les 60 souches SIHP sont classées comme souches de SARM. La PCR a également détecté le gène mecA dans les 60 souches.
Test du gène tst
Le gène tst est un facteur de virulence important chez S. aureus. La PCR a montré que les 50 souches SIHP portaient les gènes tst.
La capacité de survie des souches de S. aureus SIHP dans les macrophages est supérieure à celle des souches de S. aureus tst négatives
Nous avons comparé les capacités de survie intracellulaire des souches SIHP et de la souche SCHP négative tst dans les macrophages. En comptant le nombre de bactéries récupérées à partir des plaques, nous avons constaté que la capacité de survie intracellulaire de la souche SIHP était beaucoup plus élevée que celle de la souche de S. aureus tst négative après des macrophages infectés dérivés de THP-1 12 ou 24 h (figure 4). Au préalable, nous avons émis l’hypothèse que les souches de SIHP possédaient une virulence potentielle élevée, et il a été suggéré que le SIHP devrait faire l’objet d’une plus grande attention à l’hôpital.
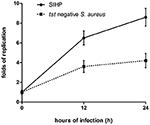
Figure 4. Survie des souches SIHP et de S. aureus tst négatif dans les macrophages dérivés du THP-1. Après que les macrophages aient été infectés par des bactéries pendant 12 et 24 h, les macrophages ont été lysés et les bactéries intracellulaires survivantes ont été étalées sur de la gélose LB. Les plis de réplication des bactéries intracellulaires survivantes ont été calculés en fonction du nombre de colonies sur la plaque de gélose LB ci-dessus.
Les différences de sécrétion des cytokines et chimiokines de macrophages infectés par S. aureus SIHP souches et tst négatif S. aureus
Pour comparer les différences de sécrétion de cytokines et chimiokines dans les macrophages dérivés de THP-1 infectés par la souche SIHP et tst négatif S.aureus, nous avons détecté des cytokines pro-inflammatoires par cytométrie en flux dans le surnageant de culture de macrophages infectés par les souches SIHP et la souche tst négative de S. aureus. Les résultats ont montré une induction significativement plus élevée d’IL-2, IL-6 et IL-17A dans les souches SIHP, mais pas par S. aureus négatif, suggérant que les souches SIHP induisent des réponses cytokines / chimiokines dans les macrophages (Figure 5). Les autres cytokines IL-4, IL-10, INF-γ et TNF sécrétées par les macrophages ne présentaient pas de différences évidentes entre les souches SIHP et les groupes affectés par S. aureus négatif.
Figure 5. Détection des cytokines et chimiokines sécrétées par les macrophages infectés par S. aureus. * P < 0,05.
Saisie de séquence multi-focus
Nous avons déterminé le génotype multilocus de 60 isolats SIHP prélevés sur des patients admis dans notre hôpital entre 2013 et 2014. Le schéma à sept locus recommandé dans la base de données S. aureus MLST a été appliqué. L’analyse MLST a montré que toutes les souches SIHP étaient classées en clone ST5.
Discussion
L’hémolysine est l’un des facteurs de virulence les plus importants pour S. aureus (Wiseman, 1975). Les effets combinés de chacun des quatre types d’hémolysine entraînent la destruction de la membrane des globules rouges qui conduit à la formation de l’anneau hémolytique entièrement transparent sur les plaques de gélose au sang. Ces dernières années, des SIHP ont été trouvés dans les échantillons cliniques du deuxième hôpital affilié de l’Université de Soochow. Dans cette étude, nous avons cherché à identifier ces souches et à étudier leurs caractéristiques en microbiologie. Au départ, nous avons utilisé différentes plaques de gélose au sang de mouton du commerce ou auto-préparées pour isoler, incuber et faire passer les souches en série. Nous avons montré qu’il existe certaines souches qui présentent et conservent un phénotype hémolytique incomplet même après une sous-culture prolongée. Ainsi, la possibilité que ce phénotype soit induit par des facteurs non bactériens peut être exclue. Nos études suggèrent que le SIHP pourrait être un sous-ensemble de souches uniques de S. aureus.
Des études antérieures suggéraient que les globules rouges de lapin sont très sensibles à l’α-hémolysine (Hildebrand et al., 1991). Berube et coll. ont rapporté que l’effet de l’α-hémolysine sur la lyse des globules rouges dépend de la concentration (Berube et Bubeck Wardenburg, 2013). La γ-hémolysine peut endommager les globules rouges des humains et des animaux (Kaneko et Kamio, 2004). Alors que la δ-hémolysine endommage les globules rouges, seulement à des concentrations élevées, elle forme un pore trans-membranaire qui lyse la membrane cellulaire (Verdon et al., 2009). Dans cette étude, nous avons montré que l’expression de quatre hémolysines de souches SIHP et de souches SCHP a des profils d’expression transcriptionnelle significativement différents. L’expression de l’α-, γ-, δ-hémolysine dans les souches SIHP, qui pourrait endommager directement les globules rouges, est bien inférieure à celle des souches SCHP, tandis que la β-hémolysine a des niveaux d’expression bien plus élevés que les souches SCHP. De plus, le niveau d’expression protéique de l’α-hémolysine a été validé par Western blot. Il a été rapporté que la β-hémolysine augmente principalement la sensibilité des globules rouges à d’autres toxines au lieu de lyser les cellules directement, à moins que les cellules ne soient cultivées à des températures plus basses (Vandenesch et al., 2012). Dans cette étude, la forte expression de la β-hémolysine a été détectée dans les souches SIHP, mais l’anneau hémolytique complet n’a jamais été observé dans les souches SIHP même incubées à 4 ° C. Ces résultats suggèrent que le phénotype incomplet observé des souches SIHP est très probablement les effets des quatre hémolysines qui sont exprimées d’une manière différente par rapport aux souches SCHP. Des études antérieures ont montré que lors de la pathogenèse chronique, l’effet combiné des pressions sélectives résultant d’antibiotiques dont la ciprofloxacine et le triméthoprime ainsi que la réponse immunitaire de l’hôte peuvent conduire à une augmentation de l’expression de l’α-hémolysine, ce qui est très important pour la colonisation de S . aureus dans les muqueuses, en particulier dans les infections des voies respiratoires (Goerke et al., 2006; Huseby et al., 2010). Dans cette étude, tous les patients infectés par SIHP ont reçu un traitement à long terme d’antibiotiques à large spectre, si cette pression sélective induisait une surexpression de gènes résistants aux médicaments et interférait avec l’expression des gènes d’hémolysine reste une possibilité qui nécessite davantage
Pour explorer les caractéristiques microbiologiques du SIHP, nous avons réalisé des tests de sensibilité aux antimicrobiens et choisi le gène de virulence tst associé à la pathogénicité de S. aureus. Nous avons constaté que les 60 souches de SIHP pouvaient être classées comme souches de SARM et portaient le gène mecA. Les résultats des tests de sensibilité aux antimicrobiens ont montré que même après 10 passages, sur ces 60 souches SIHP, les valeurs CMI du linézolide et de la teicoplanine de seulement trois souches SIHP ont peu changé.Cependant, ces changements des valeurs de CMI n’ont pas influencé l’évaluation des résultats de la sensibilité aux antimicrobiens. Le gène de virulence tst code pour la toxine du syndrome de choc toxique (TSST-1) (Kreiswirth, 1989). En tant que super antigène, le TSST-1 améliore les réponses de choc et de suppression immunitaire induites par les endotoxines (Kulhankova et al., 2014). Les tests PCR ont révélé que les 60 souches de SIHP possédaient le gène tst suggérant une virulence accrue. Récemment, de nombreux rapports ont montré que S.aureus pouvait survivre dans les macrophages humains dérivés de monocytes et que ces souches de S. aureus sont plus virulentes (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi et Bishayi, 2016). Par conséquent, nous avons comparé les capacités de survie intracellulaire des souches SIHP et des souches SCHP qui est le tst négatif S. aureus dans les macrophages, et avons constaté que la capacité de survie intracellulaire de la souche SIHP était beaucoup plus élevée que celle de la souche S. aureus tst négatif. En outre, l’analyse des données des patients a montré que l’effet du traitement anti-infectieux chez la plupart des patients infectés par des souches SIHP était pire que celui des patients similaires infectés par des souches SCHP (données non présentées). Notre étude fournit des preuves expérimentales préliminaires pour la spéculation que les souches de SIHP possèdent une virulence potentielle élevée.
Au cours du processus d’infection de S. aureus invasif, les molécules associées aux pathogènes initient le système immunitaire inné conduisant à l’activation et au recrutement des neutrophiles et des macrophages et la production de cytokines pro-inflammatoires, notamment TNF-α, IL-1β et IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016; ). Il a été rapporté que la sécrétion de cytokines inflammatoires IL-6 augmentait avec les concentrations croissantes de S.aureus (Chen et al., 2016). En outre, S. aureus superantigénique est particulièrement efficace pour stimuler la production d’IL-17 (Islander et al., 2010). Dans cette étude, les souches SIHP ont montré une induction significativement plus élevée d’IL-2, IL-6 et IL-17A des macrophages par rapport aux souches SCHP tst négatives, ce qui suggère que les souches SIHP pourraient induire plus de sécrétion de cytokines contre l’effet destructeur des macrophages. De plus, l’analyse MLST a montré que toutes les souches SIHP étaient classées en clone ST5. De plus, ces souches de SIHP ont été regroupées dans le type spa de t2460 (données non présentées).
Pris ensemble, le SIHP peut être un nouveau sous-ensemble de SARM avec une virulence potentiellement élevée, et plus d’attention devrait être accordée à contrôle et traitement de ces souches dans les hôpitaux.
Contributions des auteurs
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute publicité ou des relations financières qui pourraient être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Cette étude a été soutenue par la National Natural Science Foundation of China (81572032, 81401636), the Natural Science Fondation pour les collèges et universités de la province du Jiangsu (16KJB320006), et le programme scientifique et technologique de Suzhou (SYSD2014094, SYS201551, SS201638).
Clinique et laboratoire Institut des normes (2014). Normes de performance M100-S24 pour les tests de sensibilité aux antimicrobiens; Vingt-quatrième supplément d’information. Wayne, PA: CLSI.
Nandi, A., et Bishayi, B. (2016). Les Staphylococcus aureus ayant survécu intracellulairement après phagocytose sont plus virulents pour induire une cytotoxicité dans des macrophages péritonéaux murins frais en utilisant TLR-2 comme cible possible. Microb. Pathog. 97, 131-147. doi: 10.1016 / j.micpath.2016.06.007
Résumé PubMed | CrossRef Texte intégral | Google Scholar
Wiseman, G. M. (1975). Les hémolysines de Staphylococcus aureus. Bacteriol. Rev. 39, 317–344.
Résumé PubMed | Google Scholar