Frontières de la pharmacologie
Introduction
L’argousier fait partie des Elaeagnaceae. Il est actuellement cultivé à une échelle de production, principalement en Russie et en Chine, et dans un nombre croissant de variétés à travers le monde (c’est-à-dire en Finlande, en Allemagne et en Estonie).
À la fois in vitro et chez l’homme et l’animal des études in vivo sur l’argousier ont trouvé une gamme de produits chimiques bioactifs dans ses feuilles, racines, graines et baies, connues sous le nom de myrtille ou ananas de Sibérie, ainsi que l’huile qui en est extraite; ces composés présentent une large gamme d’activités anti-inflammatoires, anticancéreuses, antioxydantes et anti-athérosclérotiques (Zeb, 2006; Basu et al., 2007; Kumar et al., 2011; Suryakumar et Gupta, 2011; Xu et al., 2011; Christaki, 2012; Teleszko et al., 2015; Olas, 2016; Ulanowska et al., Sous presse). Plusieurs oligo-éléments et vitamines (en particulier A, C et E), lipides, caroténoïdes, acides aminés, acides gras insaturés et composés phénoliques qui se trouvent dans les baies sont présentés dans le tableau 1 (Olas, 2016; Gradt et al., 2017; Ulanowska et al., Sous presse). Leur concentration dans les baies dépend du climat, de la taille, de la maturité de la plante et de la procédure utilisée pour traiter et stocker le matériel végétal (Fatima et al., 2012; Malinowska et Olas, 2016). Gao et coll. (2000) rapportent des changements dans les propriétés antioxydantes, ainsi que d’autres types d’activité biologique, dans les baies d’argousier pendant la maturation, qui étaient fortement corrélées avec la teneur en composés phénoliques totaux et en acide ascorbique. De plus, l’activité antioxydante de l’extrait lipophile a augmenté de manière significative et correspond à l’augmentation de la teneur totale en caroténoïdes.
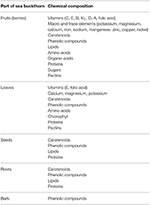
Tableau 1. La composition chimique des différentes parties de l’argousier (44; modifié).
Une multitude d’ingrédients sains se trouve non seulement dans les fruits crus, mais également dans une variété de préparations telles que les confitures, les jus, les marmelades ou les teintures. Les baies d’argousier peuvent également être utilisées pour faire des tartes et des liqueurs (Li et Hu, 2015). Hu (2005) rapporte que les graines d’argousier peuvent être utilisées pour fabriquer de l’huile et que les feuilles peuvent être utilisées pour faire du thé. Alors que les thés fabriqués à partir des graines ont des propriétés laxatives et aident à perdre du poids, les infusions de feuilles ont des propriétés antidiarrhéiques; de plus, les thés aux fruits renforcent le système immunitaire et montrent une activité contre les maladies de la peau (Frohne, 2010; Sarwa, 2001).
Les propriétés positives et uniques de l’argousier sont connues depuis au moins le VIIe siècle Colombie-Britannique (Suryakumar et Gupta, 2011; Li et Hu, 2015). La plante était utilisée non seulement en médecine naturelle, mais également en médecine vétérinaire comme moyen de soulager les helminthiases chez les chevaux et de leur fournir plus de masse et un beau pelage brillant. Actuellement, ses produits sont utilisés dans de nombreuses industries, notamment les industries pharmaceutique, cosmétique et alimentaire, mais aussi comme élément décoratif, comme bois de chauffage, ou encore comme outil de réhabilitation de zones dégradées. Selon les archives historiques, l’argousier a été utilisé pour la première fois comme médicament en Chine et, à une époque plus moderne, la plante a été officiellement inscrite à la pharmacopée chinoise en 1977 (The State of Pharmacopoeia Commission of PR China, 1977).
Des études modernes ont montré que les parties de l’argousier peuvent servir de remèdes naturels contre les maladies cardiovasculaires, ainsi que les maladies de la peau, du foie et de l’estomac. Le potentiel thérapeutique de ses composés bioactifs est démontré dans le tableau 2. Cet article de synthèse résume les connaissances actuelles concernant les différents organes de l’argousier et examine s’ils peuvent représenter un «juste milieu» pour le traitement du cancer. Il est important de noter que les informations sources de cet article sont dérivées non seulement de modèles in vitro, mais également de modèles in vivo.
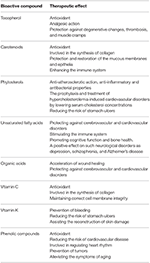
Tableau 2. Composés bioactifs de l’argousier et leurs effets thérapeutiques (44; modifié).
Activité anticancéreuse de l’argousier
Un certain nombre de produits phytopharmaceutiques, en particulier des composés phénoliques tels que les proanthocyanidines, la curcumine et le resvératrol, se sont avérés offrir des avantages significatifs dans la chimioprévention du cancer (Barrett, 1993; Bagchi et Preuss, 2004; Bagchi et al., 2014; Shanmugam et al., 2015; Ko et al., 2017) et la radiothérapie (Cetin et al., 2008). estiment que des apports alimentaires plus élevés en composés phénoliques, en particulier les procyanidines et les flavonoïdes, sont associés à un risque moindre de cancer (Barrett, 1993; Bagchi et Preuss, 2004; Duthie et al., 2006; Zafra-Stone et al., 2007; Cetin et al., 2008; Seeram, 2008; Bagchi et al., 2014; Chen et al., 2014; Wang et al., 2014; Giampieri et al., 2016; Kristo et al., 2016).L’argousier possède un large éventail d’activités biologiques et pharmacologiques, y compris des propriétés anticancéreuses. Bien que les mécanismes moléculaires qui les sous-tendent restent flous, ces composés sont connus pour être présents dans différents organes et leurs produits, en particulier dans le jus et l’huile (Xu et al., 2011). L’activité antitumorale de l’argousier peut être attribuée à des composés antioxydants, en particulier des composés phénoliques tels que les flavonoïdes, y compris le kaempférol, la quercétine et l’isorhamnetine; ceux-ci protègent les cellules des dommages oxydatifs qui peuvent conduire à une mutation génétique et au cancer (Christaki, 2012).
Études in vitro
Diverses études in vitro ont démontré que l’argousier a une activité anticancéreuse . Par exemple, Zhang et al. (2005) ont étudié les changements dans l’expression des gènes liés à l’apoptose dans la lignée cellulaire de carcinome du sein humain Bcap-37 induits par les flavonoïdes de graines d’argousier. Leur analyse bioinformatique a révélé que l’expression de 32 gènes analysés, dont CTNNB1, IGFBP4, GADD34 et caspase 3, associés à l’apoptose des cellules Bcap-37, était influencée par le traitement aux flavonoïdes.
Teng et al. (2006) ont découvert que l’isorhamnetine (3′-méthoxy-3,4′5,7-tétra hydroxyl flavone; un flavonoïde isolé de l’argousier) a des effets cytotoxiques contre les cellules de carcinome hépatocellulaire humain (BEL-7402), avec une CI50 d’environ 75 μg / ml après 72 h de traitement. Li et coll. (2015) ont également découvert que l’isorhamnetine avait des effets anti-prolifération sur les cellules cancéreuses du poumon in vitro lorsqu’elle est appliquée à des concentrations allant de 10 à 320 μg / ml, et in vivo chez des souris C57BL / 6 lorsqu’elle est administrée par voie orale (50 mg / kg / j) pendant 7 jours. Les auteurs suggèrent que le mécanisme d’action de l’isorhamnetine peut impliquer l’apoptose des cellules induite par la régulation négative des oncogènes et la régulation positive des gènes apoptotiques. D’autres observations ont montré que l’isorhamnetine supprime la prolifération des cellules des lignées cellulaires du cancer colorectal humain (HT-29, HCT 116 et SW480), induit un arrêt du cycle cellulaire à la phase G2 / M et supprime la prolifération cellulaire en inhibant le PI3K-Akt -mTOR voie. De plus, l’isorhamnetine a réduit les niveaux de phosphorylation des protéines Akt (Ser473), phosph-p70S6 kinase et phosph-4E-BP1 (t37 / 46), et a amélioré l’expression de la protéine cycline B1 à des concentrations de 20 et 40 μM (Li et al., 2014).
Dans une étude sur les cellules cancéreuses du sein humaines MDA-MB-231, Wang et al. (2014) ont noté que les procyanidines d’argousier isolées des graines avaient des effets inhibiteurs sur la synthase des acides gras (SAF): une enzyme clé pour la biosynthèse des acides gras à longue chaîne de novo, dont des niveaux élevés se trouvent dans les cellules cancéreuses. Cette inhibition était dose-dépendante à des concentrations allant de 0 à 0,14 μg / ml. Une concentration de 0,087 μg / ml a inhibé 50% de l’activité du SAF. De plus, la croissance cellulaire a été supprimée par un traitement avec des procyanidines d’argousier à des concentrations comprises entre 10 et 60 μg / ml. De plus, les procyanidines testées se sont révélées induire l’apoptose cellulaire d’une manière dose-dépendante. Les auteurs suggèrent que ces procyanidines peuvent induire l’apoptose des cellules MDA-MB-231 en inhibant l’activité intracellulaire du SAF.
Olsson et al. (2004) ont comparé l’effet de 10 extraits différents de fruits et de baies, y compris des baies d’argousier, sur la prolifération des cellules cancéreuses du demi-côlon HT29 et des cellules cancéreuses du sein MCF-7. Ils ont observé que l’argousier avait l’effet d’inhibition le plus élevé de la prolifération des cellules HT29 et MCF-7 à ses deux concentrations administrées les plus élevées (0,25 et 0,5%). Les auteurs suggèrent que l’inhibition de la prolifération des cellules cancéreuses était corrélée aux concentrations de caroténoïdes et de vitamine C. De plus, ils proposent la présence d’une action synergique entre les caroténoïdes, la vitamine C et les anthocyanes. De plus, McDougall et al. (2008) notent que l’extrait de baies d’argousier possède des effets légèrement antiprolifératifs contre les cellules cancéreuses du col de l’utérus et du demi-côlon cultivées in vitro.
Boivin et al. (2007) ont déterminé l’activité antiproliférative des jus de 13 types de baies, dont l’argousier, à des concentrations de 10 à 50 μg / ml contre cinq lignées cellulaires cancéreuses in vitro: AGS – adénocarcinome de l’estomac, ACF-7 – adénocarcinome de la glande mammaire, PC-3 – adénocarcinome prostatique, Caco-2 – adénocarcinome colorectal et MDA-MB-231 – adénocarcinome de la glande mammaire. Il a été constaté que le jus de baies d’argousier, comme les jus de mûre et d’aronia noir, avait des propriétés anti-prolifératives. Cependant, aucune corrélation n’a été trouvée entre les propriétés anti-prolifératives des jus de baies et leur capacité antioxydante, et l’inhibition de la prolifération des cellules cancéreuses par les jus n’impliquait pas l’apoptose dépendante de la caspase. Malgré cela, la suppression de l’activation induite par le facteur de nécrose tumorale (TNF) du facteur nucléaire kappa-amplificateur de chaîne légère des cellules B activées (NFκB) a été observée.
Récemment, Guo et al.(2017) ont étudié la composition phytochimique des baies de quatre sous-espèces différentes d’argousier, ainsi que leurs propriétés antioxydantes et antiprolifératives contre les cellules cancéreuses du foie humain HepG2 in vitro: H. rhamnoides L. subsp. sinensis (Sinensis), H. rhamnoides L. subsp. yunnanensis (Yunnanensis), H. rhamnoides L. subsp. mongolica (Mongolica) et H. rhamnoides L. subsp. turkestanica (Turkestanica). Parmi ces sous-espèces, H. rhamnoides L. subsp. sinensis a démontré la teneur phénolique totale la plus élevée et l’activité antioxydante totale correspondante, tandis que les plus grandes propriétés antioxydantes et antiprolifératives cellulaires ont été observées chez H. rhamnoides L. subsp. yunnanensis. Ces propriétés ont été attribuées à l’action des acides phénoliques et des aglycones flavonoïdes.
Zhamanbaeva et al. (2014) ont étudié les effets de l’extrait d’éthanol de feuilles d’argousier sur la croissance et la différenciation des cellules de leucémie myéloïde aiguë humaine (KG-1a, HL60 et U937). Bien qu’un extrait végétal inhibe la croissance cellulaire en fonction de la souche cellulaire et de la dose d’extrait, l’étude n’identifie pas le contenu chimique de l’extrait testé. Ils ont utilisé trois concentrations de l’extrait: 25, 50 et 100 μg / ml. Les résultats suggèrent que l’effet antiprolifératif de l’extrait d’argousier sur les cellules de leucémie myéloïde aiguë a été partiellement déterminé par l’activation du point de contrôle de la phase S, ce qui a probablement conduit à une décélération du cycle cellulaire et à l’induction de l’apoptose.
Ailleurs, Zhamanbayeva et coll. (2016) ont étudié l’activité antiproliférative et améliorant la différenciation de divers extraits de plantes (10-100 μg / ml), y compris l’extrait eau-éthanol de feuilles d’argousier: il a été trouvé qu’il avait une teneur totale en polyphénols d’environ 46 mg d’équivalent GA / g d’extrait séché, teneur totale en flavonoïdes d’environ 23 mg d’équivalent quercétine / g d’extrait séché. Les auteurs ont observé que les extraits testés, y compris l’extrait d’argousier, réduisaient la croissance et la viabilité des cellules de leucémie myéloïde aiguë; en outre, à des doses non cytotoxiques, ils potentialisent également la différenciation cellulaire induite par une faible concentration de 1α, 25-dihydroxyvitamine D3, de manière dépendante du type cellulaire. De plus, les extraits testés ont fortement inhibé la peroxydation des lipides microsomaux et ont protégé les érythrocytes normaux contre le choc hypo-osmotique.
Une étude récente de Kim et al. (2017) propose que l’extrait de feuille d’argousier, contenant environ 70 mg / g de composés phénoliques totaux et environ 460 μg / g de catéchine, puisse inhiber la prolifération rapide des cellules de gliome C6 de rat lorsqu’il est administré à 0,62, 6,2 et 62 μg / ml, probablement en provoquant les premiers événements d’apoptose. Les auteurs suggèrent également que la réduction de la prolifération et de la viabilité des cellules de gliome C6 après l’administration de l’extrait végétal était accompagnée d’une diminution de la production d’espèces réactives de l’oxygène, qui sont essentielles pour la prolifération des cellules tumorales. De plus, l’argousier a non seulement régulé à la hausse l’expression de la protéine pro-apoptotique Bcl-2 associée X (Bax), mais a également favorisé sa localisation dans le noyau.
Diverses études rapportent que l’huile d’argousier possède également propriétés anti-tumorales. Cette huile peut être incorporée dans des capsules, de la gélatine et des liquides oraux (Yang et Kallio, 2002). De plus, les études de toxicité ne rapportent aucun effet indésirable chez les sujets recevant de l’huile d’argousier (Upadhyay et al., 2009). Kumar et coll. (2011) indiquent que l’huile d’argousier joue un rôle important dans le traitement du cancer, y compris la chimiothérapie et la radiothérapie, et que la prise d’huile d’argousier peut aider à contrer de nombreux effets secondaires ou traitements, restaurer la fonction rénale et hépatique, augmenter l’appétit et maintenir généralement les patients dans bonne santé. Wang et coll. (1989) ont observé que l’huile de graine retardait la croissance tumorale de 3 à 50%. Zhang et coll. (Zhang, 1989) ont démontré que l’injection d’huile de graines (1,59 g / kg de poids corporel) inhibait significativement le taux de croissance des tumeurs transplantées de mélanome (B16) et de sarcome (S180) chez la souris. Wu et coll. (1989) attribuent l’effet protecteur de l’huile de graines d’argousier contre le cancer du col de l’utérus à la présence de vitamines A et E. Enfin, Sun et al. (2003) notent que les flavonoïdes de l’huile extraite de graines d’argousier exercent une action inhibitrice sur la lignée cellulaire de cancer du foie BEL-7402 en induisant l’apoptose.
Les graines et la pulpe de baies d’argousier contiennent divers autres composés bioactifs , y compris les acides gras insaturés et les phytostérols. Il est connu que les acides gras insaturés ont une influence multidirectionnelle sur la santé humaine, par exemple en stimulant le système immunitaire. De plus, les phytostérols ont des propriétés anticancéreuses (Sajfratova et al., 2010; Dulf, 2012). Plus de détails sur la composition et les aspects bénéfiques pour la santé de l’huile d’argousier sont donnés par Olas (2018). L’effet de l’argousier sur les cellules cancéreuses dans différents modèles in vitro est décrit dans le tableau 3.

Tableau 3.L’effet de l’argousier sur les cellules cancéreuses dans des modèles in vitro.
Études in vivo
Argousier s’est avéré avoir des propriétés anticancéreuses dans des études in vitro et in vivo sur des modèles animaux. Une étude de l’action chimiopréventive des fruits de l’argousier par Padmavathi et al. (2005) ont découvert qu’ils inhibaient la papillomagenèse cutanée induite par le diméthylobenzénoantracène chez la souris. Les auteurs suggèrent que l’inhibition de la carcinogenèse peut être attribuée à l’induction concomitante d’enzymes de phase II, à savoir la glutathion S-transférase, la glutathion peroxydase, la catalase, la superoxyde dismutase et la glutathion réductase dans le foie de souris. De plus, les auteurs suggèrent également que l’action anticancéreuse des fruits de l’argousier pourrait être basée sur son amélioration de l’activité de liaison à l’ADN du facteur régulateur de l’interféron-1 (IRF-1), un facteur de transcription antioncogène connu causant la suppression de la croissance et l’apoptose.
Nersesyan et Muradyan (2004) rapportent que le jus d’argousier protège les souris contre l’action génotoxique du cisplatine: un médicament anticancéreux bien connu qui est également très toxique pour les cellules normales. Du jus d’argousier (300 ml) préparé ex tempore a été administré à des souris par gavage pendant des périodes de 5 ou 10 jours. 3 h après le dernier gavage, les souris ont reçu du cisplatine à des concentrations de 1,2 ou 2,4 mg / kg.
Yasukawa et al. (2009) ont trouvé un extrait à l’éthanol à 70% de branches d’argousier (1 mg d’extrait de plante / souris) pour avoir des propriétés antitumorales dans un test de carcinogenèse in vivo en deux étapes avec deux groupes de 15 souris; 7,12-diméthylbenzanthracène comme indicateur, et 12-O-tétracécanoyl-phorbol-13-acétate comme promoteur. Parmi les trois composés phénoliques (catéchine, gallocatéchine et épigallocatéchine) et l’acide ursolique triterpénoïde isolés de l’extrait, l’épigallocatéchine et l’acide ursolique se sont révélés les plus actifs.
Wang et al. (2015) ont constaté que non seulement les composés phénoliques ou les extraits / fractions phénoliques d’argousier ont des propriétés anticancéreuses: HRWP-A, un polysaccharide homogène hydrosoluble avec des unités répétées de résidus (1 → 4) -β-D-galactopyranosyluronique, de dont 85,2% sont estérifiés avec des groupes méthyle, démontre également des activités anticancéreuses et immunostimulantes in vivo. Un test d’activité antitumorale a démontré que HRWP-A pouvait inhiber de manière significative la croissance du carcinome pulmonaire de Lewis (LLC) chez les souris porteuses de tumeurs. En outre, ce composé a amélioré la prolifération des lymphocytes, augmenté les activités des macrophages et favorisé l’activité des cellules tueuses naturelles chez les souris porteuses de tumeurs. Les auteurs ont utilisé trois doses différentes de polysaccharide (50, 100 et 200 mg / kg), qui ont été administrées par voie intragastrique chaque jour pendant 14 jours.
Capacité radioprotectrice de l’argousier
En raison en raison de sa teneur élevée en composés biologiquement actifs et en antioxydants, l’argousier est inclus dans la thérapie anticancéreuse pour son activité radioprotectrice, qui a été démontrée dans un certain nombre d’études de Goel et al. (2002, 2003a, b, 2004, 2005). Agrawala et Goel (2002) ont découvert que l’extrait entier de baies d’argousier fraîches avait des propriétés protectrices (H. rhamnoides — RH-3; 25–35 mg / kg de poids corporel), en particulier pour les micronoyaux radio-induits dans la moelle osseuse de souris. De plus, Goel et al. (2002) ont découvert que RH-3 inhibait la réaction de Fenton et la production de radicaux hydroxyles médiée par les radiations in vitro.
Kumar et al. (2002) rapportent que RH-3 a inhibé les cassures de brins d’ADN induites par le rayonnement et l’hydroperoxyde de butyle tertiaire d’une manière dose-dépendante, comme l’a révélé le test Comet. Ils notent également un fort compactage de la chromatine se produisant à des concentrations de 100 et 120 pg / ml de RH-3 et plus, ce qui rend les noyaux résistants aux radiations, même à une dose de 1 000 Gy. Goel et coll. (2003a) rapportent la protection des cryptes jéjunales par RH-3 contre l’irradiation gamma mortelle du corps entier (10 Gy), et que l’activité de la caspase-3 était également significativement plus faible chez les souris recevant du RH-3 avant l’irradiation par rapport aux témoins irradiés. Fait intéressant, une dose radioprotectrice de RH-3 (30 mg / kg de poids corporel) a induit une fragmentation significative de l’ADN (étudiée par spectrofluorimétrie) dans les thymocytes chez la souris in vivo. De plus, le traitement à l’argousier avant l’irradiation a amélioré l’apoptose induite par les rayonnements in vivo (Goel et al., 2004). Goel et coll. (2005) suggèrent également que le traitement pré-irradiation des souris avec 30 mg / kg d’extrait de baies d’argousier protège l’intégrité fonctionnelle des mitochondries du stress oxydatif induit par les radiations. Ces expériences ont examiné les niveaux de divers biomarqueurs du stress oxydatif, y compris l’anion superoxyde, la peroxydation lipidique et l’oxydation des protéines. Il est intéressant de noter que RH-3 a des propriétés immunostimulantes, qui peuvent jouer un rôle important dans son efficacité radioprotectrice (Prakash et al., 2005).
Conclusion
Bien que de nombreuses études aient confirmé l’activité anticancéreuse de l’argousier, ses doses médicinales et prophylactiques restent inconnues, et aucun essai clinique n’a encore été réalisé: uniquement in vitro ou in vivo études impliquant des animaux de laboratoire. On sait que l’argousier peut participer à la prévention et au traitement du cancer; il accélère également le retour à la santé des patients sous chimiothérapie en améliorant de manière significative les performances du système immunitaire et en soulageant les dommages hématologiques.
Le mécanisme hypothétique par lequel l’argousier peut exercer ses réponses chimiopréventives et thérapeutiques contre le cancer est présenté sur la figure 1. Les substances bioactives présentes dans diverses parties de l’argousier ont une gamme de propriétés, y compris des activités antioxydantes, anti-inflammatoires et anti-prolifératives; ils induisent également l’apoptose et renforcent le système immunitaire; cependant, les mécanismes moléculaires restent flous. Par conséquent, avant que l’argousier puisse être considéré comme le «juste milieu» pour le traitement des cancers, il nécessite une étude plus approfondie dans une série d’études de haute qualité.
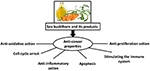
Figure 1. Mécanismes d’action hypothétiques par lesquels l’argousier peut provoquer des réponses chimiopréventives et thérapeutiques contre le cancer.
Contributions des auteurs
Tous les auteurs (BO, BS, KU) répertoriés ont apporté une contribution substantielle, directe et intellectuelle à l’œuvre, et l’ont approuvée pour publication.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Le réviseur BW et l’éditeur de traitement ont déclaré leur affiliation partagée.
Remerciements
Ce travail a été soutenu par le Centre national des sciences, Pologne 2015/19 / B / NZ9 / 03164 .
Abréviatio ns
Bagchi, D., et Preuss, H. G. (2004). Phytopharmaceutiques dans la chimioprévention du cancer, 1er éd. Bocca Raton, FL: CRC Press.
Frohne, D. (2010). Leksykon Roślin Leczniczych MedPharm. Wroclaw, 276.
Google Scholar
Hu, S. (2005). « Hippophae rhamnoides L. – Sea buckthorn, shaji », dans Food Plants of China (The Chinese University Press), 572.
Sarwa , A. (2001). Wielki Leksykon Roślin Leczniczych. Warszawa: Książka i Wiedza.
La Commission de l’état de pharmacopée de la République populaire de Chine ( 1977). Pharmacopée de la République populaire de Chine 1997, Pékin.
Zeb, A. (2006). Potentiel anticarcinogène des lipides des hippophaes – preuve de la littérature récente. Pac asiatique. J. Cancer Prev. 7, 32–34.
Résumé PubMed | Google Scholar
Zhang, P. (1989). Activités anticancéreuses de l’huile de graines d’argousier et ses effets sur le poids des organes immunitaires Seabuckthorn 2, 31–34.