Frontières de la physiologie
Introduction
Les barorécepteurs artériels servent de capteurs de première ligne pour détecter les changements de tension artérielle dans la circulation sanguine. Les modifications de la pression artérielle stimulent les terminaisons nerveuses mécanosensibles localisées dans les parois artérielles. La force mécanique est transduite en signaux électriques aux terminaisons nerveuses, ce qui entraîne des déclenchements de potentiel d’action dépendant de la pression dans les neurones barorécepteurs. Les signaux nerveux se propagent ensuite au centre de contrôle cardiovasculaire du tronc cérébral pour la régulation baroréflexe de la pression artérielle (Levy MN, 2007). De plus, les structures supra-médullaires, y compris le noyau cunéiforme du mésencéphale et le cortex préfrontal médial ventral, ont également un rôle inhibiteur dans la régulation baroréflexe (Verberne et al., 1997).
Il existe deux barorécepteurs artériels, à savoir les barorécepteurs aortiques et les barorécepteurs carotidiens, situés respectivement dans la couche adventice de l’arc aortique et des artères carotides. Les barorécepteurs aortiques détectent la pression artérielle dans l’aorte. Les corps cellulaires (soma) des barorécepteurs aortiques sont situés au niveau du ganglion nodeux (NG) (figure 1). Les signaux nerveux des terminaisons nerveuses des barorécepteurs aortiques sont transmis au ganglion nodeux par un nerf sensoriel appelé nerf dépresseur aortique (ADN) (Figure 1). Les barorécepteurs carotidiens détectent la pression artérielle dans l’artère carotide, qui alimente le cerveau en sang. Les terminaisons nerveuses des barorécepteurs carotidiens sont situées bilatéralement au niveau des bifurcations de l’artère carotide, près de l’artère carotide interne. Les signaux nerveux des barorécepteurs carotidiens voyagent le long des nerfs du sinus carotidien (CSN) jusqu’à leur soma localisé dans le ganglion pétreux (PG). Le ganglion pétreux dépasse du foramen jugulaire (figure 1) (McDonald, 1983; Shoukas et al., 1991; Vander et al., 1998; Sato et al., 1999; Donnelly et Rigual, 2000; Weijnen et al., 2000) . Comme les barorécepteurs aortiques détectent la pression artérielle dans l’aorte, qui alimente en sang toute la circulation systémique, ces barorécepteurs devraient jouer un rôle fonctionnel important dans le maintien de la pression artérielle systémique globale. D’autre part, les barorécepteurs carotidiens détectent la pression du sang qui est administré au cerveau. Ces barorécepteurs peuvent être plus importants pour le maintien d’une pression artérielle cérébrale stable et d’un flux sanguin cérébral.
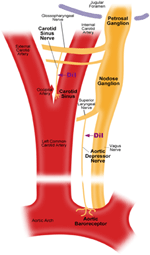
Figure 1. Schéma de principe des terminaisons et des nerfs des barorécepteurs aortiques et carotidiens. Schéma illustrant les positions anatomiques des terminaisons nerveuses des barorécepteurs aortiques et carotidiens, leurs fibres nerveuses et les régions somata. Les terminaux des barorécepteurs aortiques sont situés dans l’arc aortique. Sa fibre nerveuse afférente est un nerf dépresseur aortique. Le soma est dans le ganglion nodeux (NG). Le barorécepteur carotidien est positionné dans l’artère carotide interne à côté de la bifurcation carotidienne. Son nerf afférent est le nerf du sinus carotidien. Le soma est situé dans le ganglion pétreux (PG).
Il existe des rapports contradictoires sur les barorécepteurs, les barorécepteurs aortiques ou la carotide les barorécepteurs, sont plus sensibles au changement de tension artérielle. Certains chercheurs ont rapporté que les barorécepteurs carotidiens sont plus sensibles à la pression (Donald et Edis, 1971; Fadel et al., 2003), tandis que d’autres pensent que les barorécepteurs aortiques sont plus sensibles à la pression (Glick et Covell, 1968; Pickering et al., 2008), et d’autres encore n’ont rapporté aucune différence de sensibilité à la pression entre ces deux barorécepteurs (Hainswor et al., 1970; James et Daly, 1970). Cependant, presque toutes ces études précédentes utilisaient uniquement les réponses baroréflexes (telles que la fréquence cardiaque et l’activité du nerf sympathique rénal) comme critères de jugement pour le test de sensibilité des barorécepteurs. Il n’y a toujours pas d’étude qui enregistre et compare directement la sensibilité à la pression des neurones barorécepteurs aortiques et carotidiens en soi.
Ici, nous avons utilisé une pince de pression à haute vitesse pour modifier la pression hydrostatique à l’intérieur des neurones barorécepteurs et mesurée les réponses électrophysiologiques correspondantes de ces neurones par patch clamping de cellules entières. Nous avons également utilisé une chambre d’étirement uniaxiale pour étirer les neurones barorécepteurs et mesuré les changements correspondants du Ca2 + cytosolique dans ces neurones. En outre, pour les études animales in vivo, nous avons mesuré les incendies potentiels d’action induite par la pression dans les nerfs dépresseur aortique et sinus carotidien, qui sont respectivement les nerfs sensoriels des barorécepteurs aortique et carotidien.
Matériels et méthodes
Animaux
Toutes les expériences sur les animaux ont été menées sous l’autorité d’une licence délivrée par le gouvernement de la RAS de Hong Kong et l’approbation du Comité d’éthique de l’expérimentation animale, l’Université chinoise de Hong Kong.Des rats mâles Sprague-Dawley (S / D) (180–200 g) ont été fournis par le Laboratory Animal Services Center de l’Université chinoise de Hong Kong.
Culture primaire
S / D les rats ont été anesthésiés avec du pentobarbital sodique (100 mg / kg). La région cervicale gauche a été exposée par incision médiane sous condition stérilisée. Comme le montre la figure 1, le nerf dépresseur aortique ou le nerf du sinus carotidien a été exposé et 2 à 3 mm du nerf ont été soigneusement détachés des tissus environnants par dissection émoussée. Des cristaux de traceur lipophile fluorescent 1,1-dioctadécyl-3,3,3 ‘, 3’-tétraméthylindocarbocyanine (DiI) (Invitrogen) ont été appliqués autour du nerf et recouverts de Kwik-Sil (World Precision Instruments, USA). L’incision a ensuite été suturée. Les rats ont pu récupérer pendant 5 à 7 jours pour permettre au colorant DiI de se diffuser rétrogradement le long du nerf dépresseur aortique ou du nerf du sinus carotidien jusqu’au somata situé respectivement dans le ganglion nodeux ou le ganglion pétreux.
Ganglion nodulaire ou pétreux les neurones ont été isolés de rats marqués au DiI et coupés en morceaux dans du EBSS glacé. Ils ont été soumis à une digestion pendant 1 h à 37 ° C avec de la trypsine (1 mg / ml) et de la collagénase IA (1 mg / ml). Les neurones uniques ont été dispersés par trituration douce avec une pipette en verre Pasteur, suivie d’une centrifugation. Les neurones ont été remis en suspension et cultivés dans un milieu DMEM / F-12 supplémenté avec 5% de FBS, 1% d’antibiotique-antimycosique et 7S NGF (100 ng / ml). La cytosine arabinofuranoside (Ara-C; 10 μM) a été incluse dans le milieu de culture pour inhiber la croissance des cellules en division. Les neurones ont été cultivés pendant au moins 3 jours avant les expériences. Pour l’enregistrement du potentiel d’action, les neurones ont été fraîchement isolés et incubés dans F12 au moins 30 min avant les expériences. Pour toutes les expériences, les cellules ont été incubées sur des lames de verre pré-enduites de 0,1 mg / ml de poly-L-lysine, à l’exception des expériences d’étirement cellulaire dans lesquelles les chambres en silicone ont été pré-enduites de gélatine à 2%.
Patch Clamp
L’enregistrement de la pince de courant à cellules entières a été réalisé par un amplificateur patch clamp EPC7 (HEKA, Allemagne). Les pipettes patch avec une résistance de 3 à 5 MΩ ont été remplies avec une solution de pipette (en mM): 130 K-gluconate, 10 KCl, 2 MgCl2, 2 Na2ATP, 0,4 Tris GTP, 1 EGTA, 10 HEPES, pH 7,25-7,3 par KOH. Les cellules ont été baignées dans le liquide céphalo-rachidien artificiel (ACSF) (en mM): 120 NaCl, 2 KCl, 1,2 MgSO4 · 7H2O, 1,2 KH2PO4, 26 NaHCO3, 2,5 CaCl2, 11 glucose, équilibré avec du carbogène (95% O2 et 5 % CO2). Dans l’enregistrement de la pince de courant, les cellules ont été maintenues à son potentiel de membrane au repos. Un système de serrage à pression à haute vitesse (HSPC-1, ALA Scientific Instruments, USA) a été utilisé pour fournir une pression positive à la cellule à travers une micropipette. Les enregistrements ont été échantillonnés à 50 kHz et filtrés à 5 kHz. Les données ont été analysées avec PulseFit (HEKA). Toutes les expériences ont été réalisées à température ambiante.
Imagerie du calcium
La mesure du Ca2 + cytosolique a été réalisée comme décrit ailleurs (Wong et al., 2010). En bref, les cellules ont été chargées avec 5 uM de Fluo-4 / AM pendant 40 min. La mesure du Ca2 + cytosolique a été réalisée avec une solution tamponnée HEPES (en mM): 140 NaCl, 2,5 KCl, 1 MgCl2, 1 CaCl2,10 HEPES, 10 glucose, pH 7,4 par NaOH. Un changement cytosolique de Ca2 + en réponse à un étirement uniaxial a été réalisé avec le système d’étirement cellulaire STREX (ST-150, B-Bridge International, Inc.). Les cellules ont été stimulées par 10, 20 ou 30% d’étirement unidirectionnel pendant 1 s. La réponse cytosolique Ca2 + a été mesurée à température ambiante. La fluorescence Fluo-4 a été enregistrée et analysée par le système d’imagerie confocale à balayage laser FV1000. La variation de la réponse de fluorescence cytosolique Ca2 + a été exprimée sous la forme d’un rapport (Fx / F0) de fluorescence en temps réel, où Fx est le signal fluo-4 / AM en temps réel et F0 est le signal fluo-4 / AM de base avant l’étirement.
Enregistrement de l’activité nerveuse
Les rats ont été anesthésiés avec 100 mg / kg de pentobarbital sodique. La zone cervicale a été exposée par une incision médiane. L’artère carotide droite a été isolée et canulée par un cathéter qui était connecté au transducteur de pression (ML221, ADInstruments, USA) pour l’enregistrement de la pression artérielle. La veine fémorale gauche a été canulée pour l’injection de phényléphrine et de SNP. Le nerf dépresseur aortique gauche ou le nerf du sinus carotidien a été connecté à une électrode bipolaire d’argent, suivi d’un amplificateur (modèle 1700 Differential AC Amplifier, A-M Systems Inc., USA). La pression artérielle et l’activité nerveuse ont été enregistrées en continu par le graphique 5.0 (Instruments AD). L’activité nerveuse a été amplifiée 10 000 fois et filtrée à un passe-bande de 100 à 5 000 Hz. Les valeurs de la pression artérielle moyenne, de la fréquence cardiaque et de la fréquence des pics en réponse à la phényléphrine ont été analysées par le logiciel Chart 5.0. Modification de la fréquence des pics (fréquence des pics après la phényléphrine – fréquence des pics avant la phényléphrine) en réponse à une variation maximale de la pression artérielle (pression artérielle moyenne après phényléphrine – pression artérielle moyenne avant phényléphrine) lors de l’injection de phényléphrine (Lau et al., 2016) .
Analyse statistique
Les traces représentatives ont été tracées sous forme de traces d’évolution du temps. Les données de toutes les expériences ont été résumées dans un diagramme à barres qui a été exprimé en moyenne ± sem des expériences individuelles. Le test t de Student a été utilisé pour l’analyse statistique. Le test t par paire a été utilisé le cas échéant.
Résultats
Propriétés des neurones dépresseurs aortiques et des neurones du sinus carotidien
Dil a été appliqué soit au nerf dépresseur aortique, soit au nerf du sinus carotidien. Par conséquent, les neurones marqués Dil dans le ganglion nodeux comprenaient les neurones barorécepteurs innervant l’arc aortique et les neurones chimiorécepteurs innervant le corps aortique. D’autre part, les neurones marqués Dil dans ganglion pétreux comprenait les neurones barorécepteurs innervant le sinus carotidien et les neurones chimiorécepteurs innervant le corps carotidien. Nous avons d’abord étudié les propriétés de base de ces neurones marqueurs Dil. Les neurones marqués par DiI dans le ganglion nodose et pétrosal ont été cultivés séparément et soumis à un courant électrique dépolarisant comme illustré à la Figure 2. Deux types de réponses ont été enregistrés, l’une a répondu avec un seul potentiel d’action et l’autre avec des potentiels d’action continue après le courant de dépolarisation (Figure 2) (Belmonte et Gallego, 1983). Ces neurones ont ensuite été soumis à un protocole de pression hydrostatique afin de tester leur sensibilité aux variations de pression hydrostatique. Une rampe de pression hydrostatique positive a été appliquée de manière intracellulaire à travers une micropipette en verre par le système de serrage à pression à haute vitesse (HSPC-1, ALA Scientific Instruments, USA) jusqu’à ce que les potentiels d’action soient déclenchés. Les résultats ont montré que 45% des neurones barorécepteurs aortiques ont déclenché des potentiels d’action continue en réponse au courant électrique dépolarisant (tableau 1A). Parmi eux, 91% (41% / 45%) ont également répondu au changement de pression hydrostatique et ont montré des tirs de potentiel d’action dépendant de la pression (tableau 1A). Les 55% restants des neurones barorécepteurs aortiques n’ont déclenché qu’un seul potentiel d’action en réponse au courant de dépolarisation (tableau 1A), et parmi eux, 40% (22% / 55%) pourraient répondre au changement de pression (tableau 1A). Pour les neurones barorécepteurs carotidiens, 45% des cellules ont donné des potentiels d’action continue lorsqu’elles ont été stimulées par le courant dépolarisant (tableau 1B). Parmi eux, 82% (37% / 45%) étaient également sensibles au changement de pression (tableau 1B). De plus, parmi les neurones barorécepteurs carotidiens qui n’ont déclenché qu’un seul potentiel d’action en réponse au courant dépolarisant, 24% (13% / 55%) pourraient répondre au changement de pression (tableau 1B).
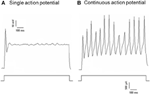
Figure 2. Enregistrement du potentiel d’action des neurones dépresseurs aortiques et sinus carotidiens en culture. Les traces de potentiels d’action qui ont été enregistrées à partir de deux neurones dépresseurs aortiques / sinus carotidiens représentatifs sur un courant dépolarisant sont illustrées. (A) Un neurones représentatifs qui ne déclenchent qu’un seul potentiel d’action lors de la stimulation actuelle; (B) Un neurones représentatifs qui ne déclenchent que des potentiels d’action continue lors de la stimulation actuelle. Panneau inférieur: protocole d’injection de courant. Barre d’échelle, horizontale, 100 ms, verticale, 10 mV (traces supérieures) et 500 pA (traces inférieures). n = 27 et n = 38 pour les neurones dépresseurs aortiques et des sinus carotidiens respectivement.

Tableau 1. Propriétés des neurones dépresseurs aortiques et des sinus carotidiens.
Qu’ils aient déclenché un potentiel d’action unique ou des potentiels d’action continue, 63% des neurones barorécepteurs aortiques marqués au Dil se sont révélés sensibles au changement de pression, tandis que seulement 50% des neurones barorécepteurs carotidiens marqués au Dil étaient sensibles au changement de pression (Tableau 1).
Sensibilité à l’étirement des neurones des barorécepteurs aortiques et carotidiens
Le seuil de pression pour la décharge potentielle d’action a été analysé. Comme le montre la figure 3, les neurones barorécepteurs aortiques avaient un seuil de pression inférieur (24 ± 4 mmHg) à celui des neurones barorécepteurs carotidiens (39 ± 4 mmHg).

Figure 3. Sensibilités des neurones barorécepteurs aortiques et carotidiens à la pression hydrostatique. (A, B) Panneau supérieur, traces représentatives de l’évolution du temps illustrant les incendies potentiels d’action dépendante de la pression dans les neurones barorécepteurs aortiques (A) et carotidiens (B). La rampe de pression (panneau inférieur) a été appliquée à l’intérieur des cellules à travers une micropipette en utilisant un système de serrage à pression à haute vitesse (HSPC). Barre d’échelle horizontale, 1 s, verticale, 20 mV et 20 mmHg. (C) Résumé montrant le seuil de pression qui initie les incendies potentiels d’action dans les neurones barorécepteurs aortiques et carotidiens. n = 13 pour les neurones barorécepteurs aortiques et n = 15 pour les neurones barorécepteurs carotidiens. *** p < 0.01, par le test t de Student.
Réponse Ca2 + induite par l’étirement dans les neurones barorécepteurs
Des neurones dépresseurs aortiques en culture ou des sinus carotidiens ont été soumis à 10, 20 ou 30% d’étirement uniaxial par STREX Cell Stretching System, en essayant d’imiter l’étirement des vaisseaux sanguins sous la pression artérielle. Les résultats ont montré qu’un étirement uniaxial de 20% induisait une augmentation marquée de la fluorescence cytosolique Ca2 + dans les neurones barorécepteurs aortiques, mais pas dans les neurones barorécepteurs carotidiens (figures 4A – C). En outre, la magnitude de la fluorescence Ca2 + augmente en réponse à 30% d’étirement uniaxial était beaucoup plus élevée dans les neurones barorécepteurs aortiques que dans les neurones barorécepteurs carotidiens (figures 4A-C).
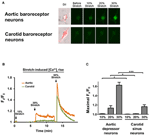
Figure 4. Sensibilités des neurones dépresseurs aortiques et des sinus carotidiens à l’étirement uniaxial. Les cellules ont été chargées avec un colorant fluorescent sensible au Ca2 + Fluo-4 / AM. Les images représentatives (A) et les traces chronologiques (B) des élévations relatives de Ca2 + cytosolique en réponse à un étirement uniaxial de 10, 20 et 30% de la longueur des cellules dans les neurones dépresseurs aortiques et des sinus carotidiens sont illustrées. (C) Résumé de l’augmentation maximale de Ca2 + cytosolique en réponse à différents degrés d’étirement. Le changement du Ca2 + cytosolique a été exprimé par Fx / F0, où Fx est le signal fluo-4 / AM en temps réel et F0 est le signal fluo-4 / AM de base avant l’étirement. Moyenne ± s.e.m. (n = 5). * p < 0,05, *** p < 0,01 par rapport au contrôle correspondant, par test t par paire.
Activité nerveuse des barorécepteurs in vivo
L’activité nerveuse des deux barorécepteurs a été étudiée in vivo. La phényléphrine a été injectée par voie intraveineuse. Les changements de pression artérielle lors de l’application de phényléphrine sont indiqués dans le panneau supérieur des figures 5A, B. Les changements de sous-séquence de l’activité nerveuse des barorécepteurs sont indiqués dans le panneau inférieur (figures 5A, B). L’activité nerveuse induite par la pression était beaucoup plus élevée dans le nerf dépresseur aortique que dans le nerf du sinus carotidien (figures 5A, B). Le changement de fréquence de pointe par mmHg d’augmentation est résumé dans la figure 5C. Le résultat a indiqué que les barorécepteurs aortiques sont plus sensibles à la pression hydrostatique que les barorécepteurs carotidiens in vivo.
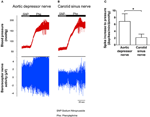
Figure 5. Activité nerveuse des barorécepteurs chez le rat in vivo. (A, B) Traces représentatives montrant le changement de l’activité du nerf dépresseur aortique (A) et du nerf du sinus carotidien (B) lors de l’élévation de la pression artérielle. Dans les deux (A, B), le panneau supérieur était le changement de la pression artérielle avant et après l’application de Phe, comme indiqué par les barres horizontales. Le panneau inférieur était le changement correspondant de l’activité nerveuse. (C) Données résumées montrant le changement de l’activité nerveuse par unité de changement de pression artérielle. Moyenne ± s.e.m. (n = 8). * p < 0,05 par rapport au contrôle dans les barorécepteurs aortiques, par test t par paire.
Expression des canaux TRP
Plusieurs canaux TRP ont été signalés comme mécanosensibles, notamment TRPC1, -C3, -C5, -C6, -V1, -V4, -P2 (O « Neil et Heller, 2005; Christensen et Corey, 2007; Pedersen et Nilius, 2007; Patel et al., 2010; Lau et al., 2016). Ici, nous avons étudié le rôle possible de ces canaux TRP mécanosensibles en relation avec l’aorte et la sensibilité des barorécepteurs carotidiens. Les expressions de l’ARNm de ces canaux dans le ganglion nodose et pétrosal ont été comparées. l’expression de canaux mécanosensibles dans le ganglion nodeux peut contribuer à une sensibilité plus élevée.
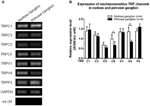
Figure 6. Expression de canaux TRP mécanosensibles dans le nodose et le ganglion pétreux. (A) Images de gel représentatives comparant le niveau d’expression de l’ARNm des canaux TRP mécanosensibles, (TRPC1, -C3, -C5, -C6, -V1, -V4, -P2) entre les neurones du ganglion nodose et pétreux. L’analyse semi-quantitative par RT-PCR a été utilisée pour comparer les niveaux d’expression d’ARNm de plusieurs canaux TRP par rapport à l’expression d’ARNm de GAPDH. Les résultats de 9 expériences ont été résumés en (B). Les valeurs étaient en moyenne ± sem. * p < 0,05, par test t par paire.
Discussion
Dans la présente étude, les propriétés mécanosensibles des barorécepteurs aortiques et carotidiens ont été comparées. Des études de patch-clamp à cellules entières ont montré que, par rapport aux neurones du sinus carotidien, un pourcentage plus élevé de neurones dépresseurs aortiques étaient sensibles à l’étirement. En outre, le seuil de pression qui pourrait déclencher des déclenchements potentiels d’action s’est avéré plus bas dans les neurones barorécepteurs aortiques que dans les neurones barorécepteurs carotidiens. L’élévation du Ca2 + cytosolique induite par l’étirement uniaxial a également été comparée entre les neurones dépresseurs aortiques et des sinus carotidiens.L’ampleur de l’élévation cytosolique de Ca2 + en réponse à l’étirement uniaxial était beaucoup plus élevée dans les neurones barorécepteurs aortiques que dans les neurones barorécepteurs carotidiens. Les neurones barorécepteurs aortiques ont également affiché un seuil inférieur de réponses cytosoliques Ca2 + à l’étirement uniaxial. Dans une autre série d’expériences, nous avons constaté que l’augmentation du potentiel d’action induite par la pression était plus élevée dans le nerf dépresseur aortique que dans le nerf du sinus carotidien. Prises ensemble, nos données fournissent des preuves solides que les barorécepteurs aortiques sont plus sensibles à la pression artérielle que les barorécepteurs carotidiens.
Auparavant, beaucoup d’efforts ont été déployés pour comprendre la différence de sensibilité entre les deux barorécepteurs. Cependant, les résultats sont controversés. Certains rapports ont conclu que les barorécepteurs aortiques sont plus sensibles au changement de pression (Glick et Covell, 1968; Fan et al., 1996; Pickering et al., 2008), tandis que d’autres ont déclaré que les barorécepteurs carotidiens sont plus sensibles au changement de pression (Donald et Edis, 1971; Fadel et al., 2003). Cependant, presque toutes ces études antérieures impliquaient des procédures chirurgicales très compliquées et utilisaient finalement des réponses baroréflexes, telles que la fréquence cardiaque et la sortie sympathique rénale, comme points finaux pour le test de sensibilité des barorécepteurs. Les procédures chirurgicales compliquées sont susceptibles d’introduire des erreurs expérimentales, ce qui peut entraîner des conclusions controversées. En outre, la variation de la sensibilité des barorécepteurs en fonction des espèces animales est également possible. De plus, la réponse baroréflexe n’est pas seulement influencée par la sensibilité des barorécepteurs, mais également par de multiples autres facteurs, notamment la conduction nerveuse, la médiation centrale, la contractilité des vaisseaux sanguins et la fonction cardiaque. Par conséquent, les preuves des études précédentes sont indirectes et à peine idéales. Jusqu’à présent, il y a un manque d’études directes comparant la sensibilité à la pression des neurones barorécepteurs aortiques et carotidiens. Dans cette étude, la mécanosensibilité a été étudiée directement dans les neurones barorécepteurs. Les données suggèrent fortement que les barorécepteurs aortiques sont plus sensibles à la pression que les barorécepteurs carotidiens. Cette information peut avoir une importance physiologique importante dans la régulation de la pression artérielle.
On ne sait pas quels mécanismes sous-tendent la différence de sensibilité à la pression entre les barorécepteurs aortiques et carotidiens. Nous avons comparé le niveau d’expression de plusieurs canaux TRP mécanosensibles (Figure 6) (O « Neil et Heller, 2005; Christensen et Corey, 2007; Pedersen et Nilius, 2007; Patel et al., 2010). Nos résultats ont montré que les neurones barorécepteurs aortiques ont une expression plus élevée de plusieurs canaux TRP mécanosensibles, y compris TRPV4 et TRPC6. Il est possible qu’une expression plus élevée de TRPV4 et / ou TRPC6 puisse contribuer à la sensibilité à haute pression des barorécepteurs aortiques. D’autres études sont nécessaires pour vérifier le rôle de ces canaux ioniques.
Il a été précédemment rapporté que le ganglion nodeux et le ganglion pétreux contiennent deux types différents de neurones (Belmonte et Gallego, 1983). L’un d’eux donne des potentiels d’action continue lors d’une stimulation électrique, tandis que l’autre ne donne qu’une seule action potentiel lors de la stimulation. Les auteurs ont attribué le premier comme les neurones sensibles à la pression, et attribué le second comme les neurones chimio-sensibles. Nos résultats indiquent qu’il peut ne pas être appropriéa te d’attribuer les neurones sensibles à la pression et les neurones insensibles à la pression simplement en fonction du fait qu’ils déclenchent un potentiel d’action unique ou des potentiels d’action continue en réponse au courant dépolarisant. En fait, un grand pourcentage de cellules qui déclenchent un potentiel d’action unique en réponse à une stimulation électrique sont également sensibles à la pression, et appartiennent donc à des neurones barorécepteurs sensibles à la pression (Figure 2 et Tableau 1).
En résumé, la présente étude fournit la preuve que les barorécepteurs aortiques sont plus sensibles à la pression que les barorécepteurs carotidiens et ajoute de nouvelles informations à la compréhension de la physiologie de base.
Contributions des auteurs
EL et XY conçoivent les expériences et rédigent le manuscrit. EL, CL et YY effectuent les expériences. XY, YH, AM et LJ ont révisé le manuscrit. Tous les auteurs ont approuvé la version finale du manuscrit.
Financement
Ce travail a été financé par des subventions du Hong Kong Research Grant Committee CUHK478710, CUHK478413, AoE / M-05/12, TBRS / T13-706 / 11, China National Science Foundation Grant 31470912 et RGC-NSFC Joint Grant N_CUHK439 / 13.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
James, JEA, et Daly, MDB (1970). Comparaison des réponses vasomotrices réflexes à la stimulation séparée et combinée des barorécepteurs du sinus carotidien et de l’arcade aortique par des pressions pulsatiles et non pulsatiles chez le chien. J. Physiol. 209, 257–293. doi: 10.1113 / jphysiol.1970.sp009165
Résumé PubMed | CrossRef Texte intégral | Google Scholar
Levy MN, P. A. (2007). Physiologie cardiovasculaire. Philadelphie, Pennsylvanie: Mosby Elsevier.
Vander, A. J., Sherman, J. H., et Luciano, D. S. (1998). Physiologie humaine: le mécanisme de la fonction corporelle. Boston, MA: WCB McGraw-Hill.