Frontières de l’immunologie
Introduction
La prééclampsie est une maladie spécifique à la grossesse affectant 3 à 5% de toutes les grossesses (1, 2). Il se manifeste par une hypertension nouvellement apparue après 20 semaines de gestation et une protéinurie. Le placenta est central dans la pathogenèse de la maladie en reliant la mère au fœtus (3). L’interface mère-fœtus est la zone où des tissus génétiquement différents d’origine fœtale se rencontrent avec la circulation maternelle, l’endothélium et le système immunitaire. Souvent appelée la maladie des théories, une idée généralement acceptée est que la prééclampsie affecte l’endothélium maternel, provoquant une perturbation de la fonction de l’endothélium, ce qui entraîne une hypertension et une protéinurie (2). Dans sa forme sévère, la prééclampsie peut entraîner un retard de croissance fœtale, une prématurité et, pour la mère, une défaillance des organes rénaux et hépatiques ainsi qu’une éclampsie. De plus, la prééclampsie peut avoir des conséquences cardiovasculaires indésirables à long terme pour la mère et le nouveau-né (4). Le développement du placenta est considéré comme insuffisant spécifiquement dans le processus de transformation de l’artère spirale maternelle, où les cellules trophoblastiques envahissent le côté maternel en caduque et transforment les artères en conduits de faible résistance, remplaçant également l’endothélium maternel (5-7). Typiquement, ce remodelage des artères utérines est absent ou incomplet en particulier dans la forme sévère de pré-éclampsie. Une résistance élevée dans les artères utérines rétrécies provoque un flux sanguin turbulent dans l’espace intervilleux du placenta provoquant un stress oxydatif et des dommages mécaniques aux arbres villeux placentaires. Les dommages qui en résultent augmentent l’excrétion placentaire des microparticules et des médiateurs inflammatoires, entraînant une activation et un dysfonctionnement endothéliaux généralisés (8, 9). Ces événements séquentiels dans l’interface mère-fœtus conduisent à une hypertension maternelle et à d’autres symptômes comme décrit ci-dessus.
Le syndrome HELLP a été caractérisé pour la première fois en 1982 par Weinstein comme un syndrome distinct, souvent associé à la prééclampsie mais vu aussi seul (10, 11). Le syndrome HELLP est caractérisé par une hémolyse, une élévation des enzymes hépatiques et une baisse des plaquettes. Cela nécessite souvent une observation au niveau des soins intensifs et un traitement symptomatique. La pathogenèse du syndrome est toujours dans l’ombre. Le syndrome HELLP partage des caractéristiques communes avec les microangiopathies thrombotiques (TMA) telles que le purpura thrombocytopénique thrombotique (TTP) et le syndrome hémolytique et urémique (SHU). Les TMA sont présents dans divers groupes de maladies avec des caractéristiques communes d’hémolyse microangiopathique, de thrombocytopénie et de lésions organiques résultant de microthrombes. Dans le TTP, un défaut génétique ou, comme dans la grande majorité des cas, des autoanticorps acquis contre une désintégrine et une métalloprotéinase avec le motif 13 de thrombospondine de type 1 (ADAMTS13), l’enzyme qui clive le facteur von Willebrand activé (vWF), provoque la formation d’un multimères de vWF activés sur les cellules endothéliales conduisant à des thrombus plaquettaires dans les petits vaisseaux et à une hémolyse. Le SHU typique est causé par une infection bactérienne produisant une Shiga-toxine (en particulier Escherichia coli), tandis que le SHU atypique (SHUa) fait référence au type de TMA, dans lequel des déficiences génétiques dans les régulateurs de la voie alternative du système du complément sous-tendent, qui, en présence d’un déclencheur peut provoquer la maladie clinique (12, 13). Le traitement approuvé par la FDA pour le SHUa est la perfusion d’éculizumab, un antagoniste du complément C5, qui empêche la formation du complexe d’attaque membranaire (MAC) (figure 1). Cliniquement, HELLP partage les mêmes symptômes que les TMA classiques: hémolyse, thrombocytopénie et troubles organiques observés dans le foie. En fonction de la classification TMA utilisée, le syndrome HELLP est généralement classé dans la catégorie des TMA secondaires ou acquises (Tableau 1).
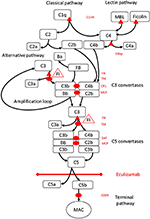
Figure 1. L’eculizumab inhibe la voie terminale de l’activation du complément. L’activation du complément peut être initiée via trois voies d’activation, qui conduisent toutes à la formation de convertases C5 qui ont la capacité d’activer la voie terminale conduisant à la formation du MAC sur la surface cible. Cette illustration schématique du système du complément montre ses activateurs les plus pertinents (en noir) et ses inhibiteurs (en rouge). Les activateurs peuvent être liés à la membrane (ovale) ou solubles (triangle). La voie alternative s’active spontanément sur toutes les surfaces qui ne permettent pas une inhibition par le facteur régulateur soluble H (FH). FH agit comme le cofacteur de l’inactivation de C3b en iC3b par le facteur I (FI). La thrombomoduline (TM) améliore l’activité du cofacteur FH. Le facteur B clivé (FB) avec l’activateur C3b forme la voie alternative convertase, qui a la capacité de cliver C3 en C3b créant une boucle d’amplification d’activation de voie alternative.La voie classique d’activation du complément peut être initiée, par exemple, par la liaison de complexes immuns à Clq, tandis que la voie de la lectine est activée par des mannoses se liant à la lectine (MBL) ou aux ficolines se liant par exemple à des schémas d’hydrates de carbone sur les microbes. L’activation de la voie de la lectine entraîne des sérine protéases 1 et 2 associées au mannose (MASP-1 et MASP-2, non illustrées) clivant les composants du complément C4 et C2 pour former la voie classique convertase C4bC2b. L’inhibiteur C1 (C1inh) et C4bp sont les régulateurs solubles de la voie classique, tandis que la protéine cofacteur membranaire (MCP) et le récepteur 1 du complément (CR1) sont des régulateurs liés à la membrane des voies précoces du complément. La formation de convertases C5 initie la voie terminale de l’activation du complément et du clivage de C5 en l’absence de régulateurs liés à la surface du facteur d’accélération de la désintégration (DAF) et du MCP. L’assemblage du MAC est régulé par le régulateur lié à la surface CD59 (protectin). Le clivage de C3 dans les voies précoces et de C5 dans la voie terminale libère les anaphylatoxines C3a et C5a et entraîne une inflammation. L’eculizumab est un anticorps recombinant humanisé contre la protéine du complément C5, qui inhibe le clivage de C5 par les convertases C5, régulant ainsi les effets prothrombotiques et pro-inflammatoires de l’activation du complément. Le patient décrit dans ce rapport de cas a été testé pour des mutations génétiques dans les gènes codant pour le facteur H (CFH), FHR5 et MCP, CFI, CFB, THBD et ADAMTS13 (ADAMTS13), un régulateur de la voie vWF de la cascade de coagulation (non illustré). Les résultats des tests génétiques ont été négatifs.

Tableau 1. Critères de diagnostic HELLP et aHUS.
Dans cette étude de cas, nous rapportons un patiente avec une TMA compliquée induite par la grossesse et le traitement réussi.
Présentation de cas
Une primigravida de 29 ans a été référée à l’âge gestationnel 34 + 2 à l’hôpital universitaire d’Helsinki clinique externe avec des douleurs dans le haut de l’estomac. Au départ, sa tension artérielle était légèrement élevée (133/91 mmHg) et la jauge urinaire était positive pour les protéines. La douleur au haut de l’estomac initialement rapportée s’améliorait progressivement. Lors de l’échographie, le fœtus avait un profil biophysique normal (BPP), l’estimation du poids était à la courbe de croissance -2 SD. La cardiotocographie (CTG) était normale. L’hémoglobine sanguine (Hb) était de 115 g / L, les plaquettes de 158 E9 / L (plage normale 150–360 E9 / L), l’alanine aminotransférase (ALT) était normale (23 U / L). La jauge urinaire était positive pour les protéines (+2) et la protéinurie calculée était de 1,6 g / 24 h. Une décision a été prise d’initier un traitement à la cortisone pour faciliter la maturation pulmonaire du bébé. Le patient a obtenu son congé avec un plan de retour le lendemain pour un contrôle de contrôle et une deuxième dose de cortisone. Comme prévu, elle est venue pour le contrôle à la semaine gestationnelle 34 + 4. La pression artérielle était de 147/87 mmHg, l’ALT 23, les plaquettes 177, le CTG et le BPP du fœtus à l’échographie était normal. Elle a été libérée et un autre contrôle était prévu. Dans l’après-midi du même jour, la douleur à l’estomac est revenue et s’est régulièrement aggravée vers le soir. Elle est retournée à l’hôpital à 2 h 20 du matin.Elle ressentait une douleur abdominale serrée, de l’agitation, et elle avait vomi deux fois et ressentait des tremblements. La pression artérielle était clairement élevée à 170/94 mmHg, la jauge de protéines urinaires était fortement positive, l’ALAT était élevée à 159, Hb 122 et plaquettes 172. Elle a été admise au service prénatal. À 4 heures du matin, elle avait mal à la tête. Un traitement antihypertenseur a été instauré (Labétalol 100 mg trois fois). L’excrétion urinaire des protéines a culminé la nuit à 13 g / 24 h. Par la suite, elle a commencé à vomir, a eu des douleurs dans le haut de l’estomac, des maux de tête et la surveillance CTG a montré des décélérations. La patiente a été transférée à 7 h 11 dans la salle d’accouchement et, comme le col de l’utérus était dilaté à trois centimètres, les membranes fœtales ont été artificiellement brisées pour le déclenchement du travail. En même temps, les tests de laboratoire ont été effectués avec Hb 122, plaquettes 172. Cependant, la lactate déshydrogénase (LD) était clairement élevée à 1 231 U / L à ce moment. Au CTG, les décélérations se sont poursuivies et la bradycardie a continué, une césarienne d’urgence a été pratiquée. Un nourrisson de sexe masculin (1960 g, -2 ET) est né à 7,25 heures du matin avec un pH de l’artère ombilicale de 7,05, BE -6,80, Apgar 1/6/8. La perte de sang lors de l’opération était de 400 ml.
À 9 heures du matin après la césarienne, les plaquettes de la mère étaient faibles à 49, avec une Hb de 102. Dans l’après-midi, l’ALT était passée à 1800, LD 3570 , le taux de créatinine sérique était de 153 (μmol / L), tandis que les plaquettes diminuaient à 33. Il y avait une perturbation de la coagulation indiquée par un faible taux de fibrinogène (1,1 g / L, valeurs de référence 2 à 4 g / L) et un taux élevé de D -dimer de fibrine (30,2 mg / L, < 0,5 mg / L). Il y avait des saignements de la plaie de césarienne, dans laquelle des sutures supplémentaires ont été placées.A ce moment, huit unités de plaquettes ont été administrées. Le taux de potassium est passé de 4,7 à 5,6 (mmol / L). Une hémolyse a été clairement observée. Le test de Coombs était négatif. L’excrétion urinaire n’était que de 10 ml / h. Le test de laboratoire a clairement montré une maladie grave avec des signes de lésions rénales et hépatiques. De plus, il y avait une perturbation du système de coagulation présentant simultanément une coagulation significative et une fibrinolyse marquée. La perfusion de sulfate de magnésium a été commencée en raison d’une hyperréflexie, qui est considérée comme un signe prédictif de convulsions, une complication sévère de la prééclampsie. La dexaméthasone intraveineuse à 10 mg a été commencée et le patient a été transféré en unité de soins intensifs (USI).
De plus, des tests de laboratoire ont été effectués à des fins de diagnostic différentiel d’autres urgences médicales (tableau 2). L’activité d’ADAMTS13 était normale de 62% (40-130%), ce qui exclut le TTP. Les taux de complément sérique en C3 (0,52 g / L, 0,71-1,41 g / L) et C4 (0,07 g / L, 0,12-0,34 g / L) étaient faibles. Le niveau de complexe terminal soluble du complément (C5b-9, 971 ng / mL, < 366 ng / mL) était élevé le premier jour du post-partum. Aucun anticorps antiphospholipide n’a été détecté, la sérologie de l’infection concernant les hépatites B et C et le VIH était négatif. À partir d’un échantillon de selles, les agents pathogènes responsables du SHU typique ont été testés négatifs.

Tableau 2. Chronologie du diagnostic et du traitement de la maladie.
La patiente a été traitée par échange plasmatique le premier et le deuxième jour du post-partum et a été hémodialysée au total trois fois au cours de son traitement (jours 2, 4 et 6 post-partum).
Le troisième jour post-partum, la patiente était stable et a été transférée à la salle de réveil de l’hôpital pour femmes. et le traitement symptomatique a été poursuivi. L’hypertension a été traitée avec de l’amlodipine 10 mg deux fois par jour et du labétalol 200 mg trois fois par jour. Le quatrième jour du post-partum, les plaquettes ont continué à diminuer et la patiente a été diagnostiquée avec un SHU. Souvent, le diagnostic différentiel de syndrome HELLP et Le SHUa réside dans la guérison spontanée des patients atteints de HELLP, généralement le troisième jour post-partum. Le traitement par eculizumab a été instauré (900 mg IV). Pati a reçu une vaccination antipneumococcique et une antibiothérapie prophylactique (pénicilline) a été lancée. La patiente a reçu en tout quatre doses hebdomadaires d’éculizumab (900 mg) et elle a commencé à récupérer rapidement. Elle n’a pas eu besoin d’hémodialyse supplémentaire après sa troisième hémodialyse le sixième jour post-partum (figure 2). La fonction rénale a été corrigée progressivement, le nombre de plaquettes a augmenté et l’hémolyse s’est résolue. Quatre semaines après l’accouchement, les taux plasmatiques de C3 et C4 ont été normalisés.
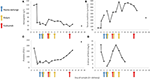
Figure 2. Certaines valeurs de laboratoire observées au cours des premiers stades de la maladie et le moment de l’échange plasmatique, de l’hémodialyse et de l’administration d’éculizumab. Dans le panneau (A) est représenté le développement des mesures d’hémoglobine sanguine, dans le panneau (B) le taux de créatinine sérique, dans le panneau (C) le nombre de plaquettes et dans le panneau (D) D-dimère des valeurs de fibrine au cours des 17 jours période de suivi.
Lors des tests génétiques, aucun polymorphisme génétique connu n’a été identifié. Elle a été testée pour des mutations dans les régulateurs du complément, le facteur H (CFH), la protéine 5 liée au facteur H (FHR5) et la protéine de co-facteur membranaire (MCP), le facteur I (CFI) d’inactivateur de voie alternative du complément, l’activateur de voie alternative facteur B (CFB ), et les composants suivants de la cascade de coagulation: ADAMTS13, la thrombomoduline (THBD) et une enzyme intracellulaire, la diacylglycérol kinase E (DGKE), dont les mutations sont une cause connue du SHU (14). De plus, les anticorps contre le facteur H n’ont pas non plus été détectés. Aucun déficit en C4 n’a été détecté.
En résumé, notre patient avait une prééclampsie sévère et remplissait les critères diagnostiques du syndrome HELLP. Bien que les tests génétiques pour le SHUa soient restés négatifs, l’évolution clinique de la maladie (en particulier, une lésion rénale aiguë sévère) et la réponse au traitement (en particulier, l’éculizumab) suggèrent que notre patiente avait un SHU induit par la grossesse.
Discussion
Le primigravida décrit ci-dessus a été diagnostiqué avec une prééclampsie sévère, un syndrome HELLP et un SHUa induit par la grossesse. Aucune mutation génétique connue, qui pourrait prédisposer au SHUa, n’a été découverte. Le diagnostic différentiel entre les types de TMA, TTP, HUS / aHUS et les TMA secondaires comme le syndrome HELLP est important. En particulier, le TTP doit être identifié tôt, car la maladie est traitée avec un échange plasmatique quotidien rapide jusqu’à la rémission (15).
À l’heure actuelle, les méthodes d’analyse de laboratoire pour tester les mutations génétiques potentiellement responsables du SHUA sont capables de montrer des mutations dans seulement jusqu’à 40 à 60% des cas de SHUa, laissant la possibilité de faux négatifs. Par conséquent, un résultat de test négatif pour les mutations n’exclut pas un vrai SHUA (16).Rarement, un SHUA a été induit après la grossesse et la parturition. Dans ces cas, au cours des trois années suivantes, environ 50% ont développé une maladie rénale chronique (MRC), voire une maladie rénale en phase terminale (ESKD). Lorsque des mutations génétiques ont été observées, jusqu’à 85% peuvent développer une CKD ou une ESKD (17).
Il est généralement admis que dans les troubles hypertensifs de la grossesse, l’inflammation placentaire entraîne un dysfonctionnement endothélial. Si l’intégrité de l’endothélium est perturbée, cela entraîne l’activation du complément et la coagulation (18). On a également émis l’hypothèse que l’endothélium maternel perturbé contribue à la morbidité maternelle tardive associée à une prééclampsie sévère et à d’autres troubles hypertensifs de la grossesse (2, 19). Il a été démontré que l’endothélium endommagé fonctionne anormalement même des années après la disparition des symptômes diagnostiques initiaux (20–23).
Chez jusqu’à 46% des patients HELLP, des mutations génétiques ont été décrites dans les régulateurs de la voie alternative du système complémentaire (24, 25). Dans les premiers stades de la grossesse, lorsque le placenta se développe, l’activation du système du complément est observée avec des taux élevés de Bb dans le sérum chez les patientes qui ont développé plus tard une prééclampsie (26). L’activation du système du complément a été observée dans la prééclampsie sévère et le syndrome HELLP, et des taux élevés de complexe terminal (C5b-9) ont été détectés dans l’urine de patients atteints de prééclampsie sévère. Chez les patients atteints du syndrome HELLP, une activation accrue du système du complément a été mise en évidence par un test fonctionnel et, en outre, par des déficiences d’expression dans CD55 et CD59, entraînant une diminution de la régulation et une activation exacerbée du système du complément (27-29).
Il existe de nombreuses similitudes partagées entre le syndrome HELLP et le SHUa. Dans les deux conditions, la perturbation de l’endothélium est clairement impliquée suivie de l’activation du complément et de la coagulation. Dans la prééclampsie sévère et le syndrome HELLP, l’éculizumab administré dès les premiers signes d’une maladie grave et la TMA seraient bénéfiques pour la protection des reins et de l’endothélium maternel (30). La préservation de l’intégrité endothéliale peut potentiellement protéger le patient des risques pour la santé à long terme tels que les maladies cardiovasculaires. En règle générale, dans les ATT liées à la grossesse, les signes cliniques d’hémolyse et de thrombocytopénie disparaissent en ~ 3 jours. Si l’activité de la maladie dure plus longtemps, les diagnostics différentiels doivent être poursuivis et ce n’est qu’alors qu’un traitement alternatif (par exemple, l’éculizumab) est envisagé. L’introduction précoce du traitement à l’éculizumab serait bénéfique pour les femmes en prévenant les lésions rénales et en minimisant les turbulences de l’endothélium et l’inflammation systémique. L’eculizumab, administré suffisamment tôt et aussi peu qu’une ou deux doses, pourrait éventuellement être suffisant pour arrêter la turbulence et être suffisant pour arrêter la cascade d’événements (31). D’une part, l’éculizumab est un médicament très coûteux, mais d’autre part, le coût des soins intensifs, des échanges plasmatiques, de l’hémodialyse, d’une éventuelle transplantation rénale, sans oublier les conséquences émotionnelles pour les mères et les familles restent inestimables.
En conclusion, notre patient était gravement malade, souffrait d’hémolyse, de troubles de la coagulation, de lésions hépatiques et d’insuffisance rénale nécessitant une hospitalisation en USI et une hémodialyse. Il est possible que l’éculizumab, s’il avait été initié plus tôt, dès les premiers signes du syndrome HELLP, ait pu être bénéfique au cours de l’évolution ultérieure de la maladie, atténuant potentiellement les lésions rénales et évitant ainsi la nécessité d’une hémodialyse et plus tard de l’IRC. Par conséquent, à l’ère de la médecine immunologique moderne, pourrions-nous faire plus pour les mères et les familles que d’attendre et d’espérer le meilleur?
Déclaration d’éthique
L’examen et l’approbation éthiques n’étaient pas requis pour l’étude sur des participants humains conformément à la législation locale et aux exigences institutionnelles. Les patients / participants ont donné leur consentement éclairé écrit pour participer à cette étude.
Contributions des auteurs
AL et JH-E ont développé l’idée du manuscrit et ont rédigé le manuscrit. JH-E et MH ont été impliqués dans la prise en charge diagnostique et thérapeutique du patient. Tous les auteurs ont révisé et édité le manuscrit et approuvé sa version finale pour publication.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprété comme un conflit d’intérêts potentiel.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Résultats défavorables de la grossesse et futures maladies cardiovasculaires maternelles. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
Résumé PubMed | CrossRef Texte intégral | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The » grands syndromes obstétricaux »sont associés à des troubles de la placentation profonde. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
Résumé PubMed | CrossRef Texte intégral | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Amorçage inflammatoire systémique dans la grossesse normale et la prééclampsie: le rôle des microparticules circulantes de syncytiotrophoblaste. J Immunol. (2007) 178: 5949-56. doi: 10.4049 / jimmunol.178.9.5949
Résumé PubMed | CrossRef Texte intégral | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I Mise à jour des vésicules extracellulaires dérivées de syncytiotrophoblastes pendant la grossesse normale et la prééclampsie. J Reprod Immunol. (2017) 119: 98-106. doi: 10.1016 / j.jri.2016.08.008
Résumé PubMed | CrossRef Texte intégral | Google Scholar
10. Weinstein L. Syndrome d’hémolyse, élévation des enzymes hépatiques et faible taux de plaquettes nombre: une conséquence grave de l’hypertension pendant la grossesse. Suis J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
Résumé PubMed | CrossRef Texte intégral | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Différenciation entre le syndrome HELLP sévère et microangiopathie thrombotique, purpura thrombocytopénique thrombotique et autres imitateurs. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
Résumé PubMed | CrossRef Texte intégral | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Altération de la fonction endothéliale chez les femmes ayant des antécédents de prééclampsie: un indicateur de risque cardiovasculaire. Suis J Physiol Hear Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
Résumé PubMed | CrossRef Texte intégral | Google Scholar
22. Kvehaugen AS, Dechend R, Ramstad HB, Troisi R, Fugelseth D , Le personnel AC. La fonction endothéliale et les biomarqueurs circulants sont perturbés chez les femmes et les enfants après la pré-éclampsie. Hypertension. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
Résumé PubMed | CrossRef Texte intégral | Google Scholar
23. Stanhewicz AE. Dysfonction vasculaire résiduelle chez les femmes ayant des antécédents de prééclampsie. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 à R71. doi: 10.1152 / ajpregu.00204.2018
Résumé PubMed | CrossRef Texte intégral | Google Scholar
25. Vaught AJ, Braunstein EM, Jasem J, Yuan X, Makhlin I , Eloundou S et coll. Les mutations germinales dans la voie alternative du complément prédisposent au syndrome HELLP. Perspicacité JCI. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
Résumé PubMed | CrossRef Texte intégral | Google Scholar
31. Elabd H, Elkholi M, Steinberg L, Acharya A. Eculizumab, un nouveau traitement potentiel pour les lésions rénales aiguës associées à la prééclampsie / syndrome HELLP. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
Résumé PubMed | CrossRef Texte intégral | Google Scholar