Géologie physique
La grande majorité des minéraux qui composent les roches de la croûte terrestre sont des minéraux silicatés. Ceux-ci comprennent des minéraux tels que le quartz, le feldspath, le mica, l’amphibole, le pyroxène, l’olivine et une grande variété de minéraux argileux. Le bloc de construction de tous ces minéraux est le tétraèdre de silice, une combinaison de quatre atomes d’oxygène et d’un atome de silicium. Ceux-ci sont disposés de telle sorte que les plans tirés à travers les atomes d’oxygène forment un tétraèdre (Figure 2.6). Puisque l’ion silicium a une charge de +4 et que chacun des quatre ions oxygène a une charge de –2, le tétraèdre de silice a une charge nette de –4.
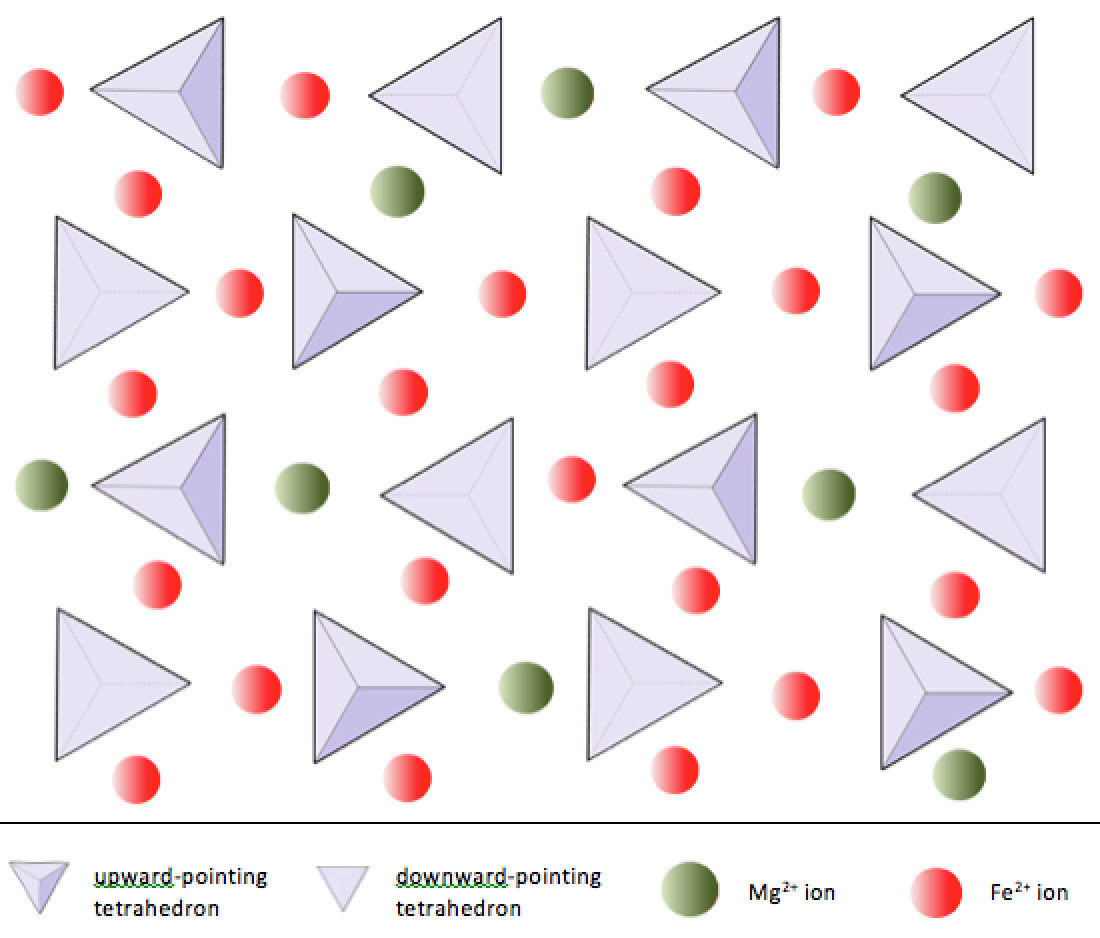
Dans les minéraux silicatés, ces tétraèdres sont disposés et reliés entre eux de diverses manières, des unités uniques aux cadres complexes (figure 2.9). La structure silicate la plus simple, celle de l’olivine minérale, est composée de tétraèdres isolés liés à des ions fer et / ou magnésium. Dans l’olivine, la charge –4 de chaque tétraèdre de silice est équilibrée par deux cations fer ou magnésium divalents (c’est-à-dire +2). L’olivine peut être Mg2SiO4 ou Fe2SiO4, ou une combinaison des deux (Mg, Fe) 2SiO4. Les cations bivalents du magnésium et du fer ont un rayon assez proche (0,73 contre 0,62 angströms). En raison de cette similitude de taille et du fait qu’ils sont tous deux des cations divalents (tous deux ont une charge de +2), le fer et le magnésium peuvent facilement se substituer l’un à l’autre dans l’olivine et dans de nombreux autres minéraux.
| Configuration du tétraèdre | Exemples de minéraux | |
|---|---|---|
 |
Isolé (nésosilicates) | Olivine, grenat, zircon, cyanite |
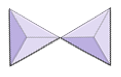 |
Paires (sorosilicates) | Épidote, zoisite |
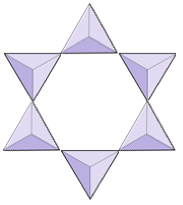 |
Anneaux (cyclosilicates) | Tourmaline |
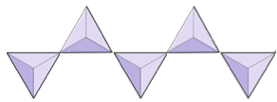 |
Chaînes simples (inosilicates) | Pyroxènes, wollastonite |
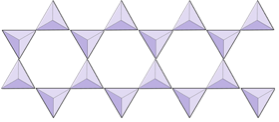 |
Double chaînes (inosilicates) | Amphiboles |
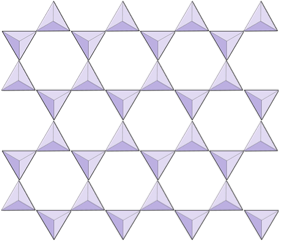 |
Feuilles (phyllosilicates) | Micas, minéraux argileux, serpentine, chlorite |
| 3 dimensions structure | Framework (tectosilicates) | Feldspaths, quartz, zéolite |
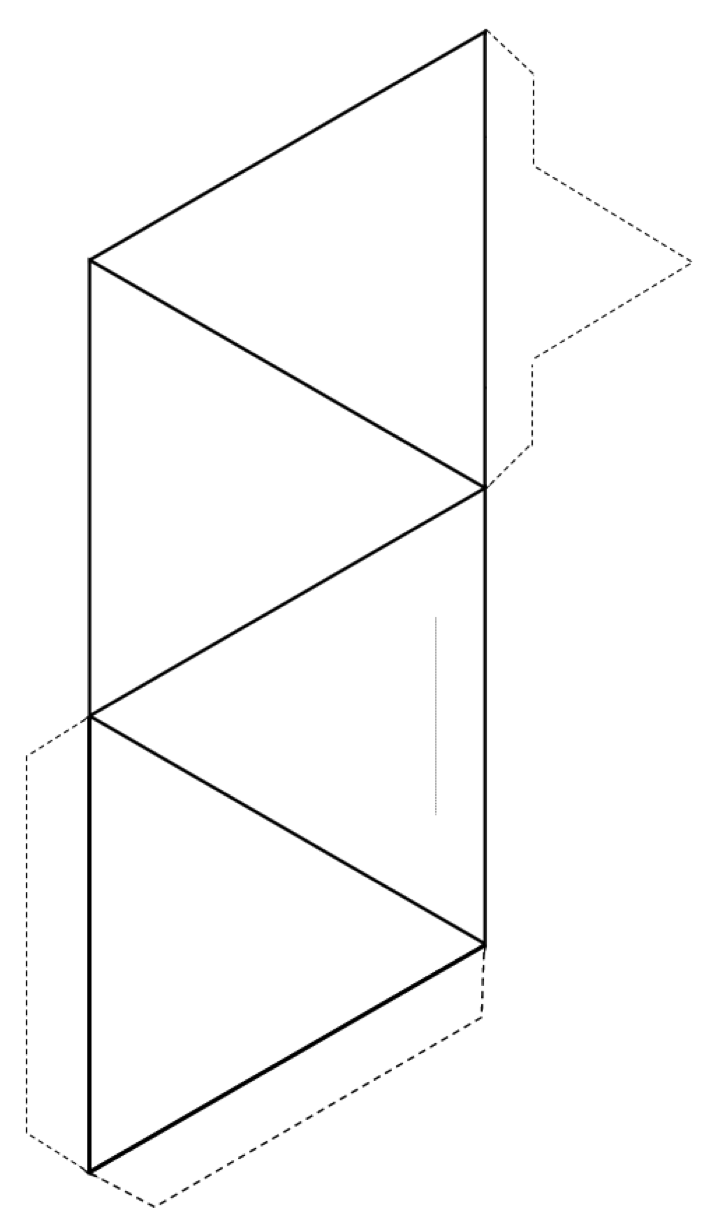
Exercice 2.3 Créer un tétraèdre
Coupez autour de l’extérieur de la forme (lignes pleines et lignes pointillées), puis pliez le long des lignes pleines pour former un tétraèdre.
Si vous avez de la colle ou du ruban adhésif, fixez le languettes au tétraèdre pour le maintenir ensemble. Si vous n’avez pas de colle ou de ruban adhésif, faites une tranche le long de la fine ligne grise et insérez la languette pointue dans la fente.
Si vous faites cela dans une salle de classe, essayez de joindre votre tétraèdre avec d’autres dans paires, anneaux, chaînes simples et doubles, feuilles et même cadres tridimensionnels.
Dans l’olivine, contrairement à la plupart des autres minéraux silicatés, les tétraèdres de silice ne sont pas liés à chacun autre. Ils sont cependant liés au fer et / ou au magnésium comme indiqué sur la figure 2.10.
Comme déjà noté, les ions +2 de fer et de magnésium ont une taille similaire (mais pas tout à fait la même). Cela leur permet de se substituer les uns aux autres dans certains minéraux silicatés. En fait, les ions communs dans les minéraux silicatés ont une large gamme de tailles, comme le montre la figure 2.11. Tous les ions représentés sont des cations, à l’exception de l’oxygène. Notez que le fer peut exister à la fois sous forme d’ion +2 (s’il perd deux électrons lors de l’ionisation) ou d’ion +3 (s’il en perd trois). Fe2 + est connu sous le nom de fer ferreux. Fe3 + est connu sous le nom de fer ferrique. Les rayons ioniques sont essentiels à la composition des minéraux silicatés, nous ferons donc à nouveau référence à ce diagramme.

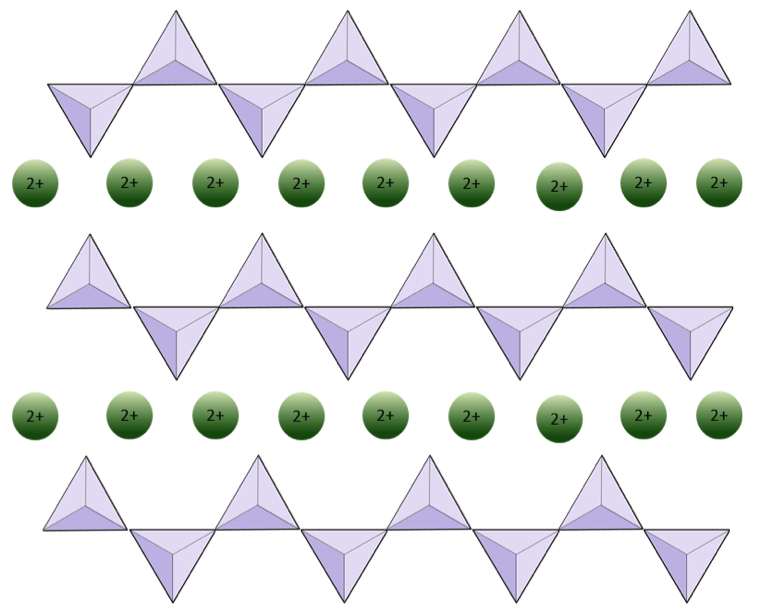
La structure de la chaîne unique le pyroxène silicate est présenté sur les figures 2.12 et 2.13. Dans le pyroxène, les tétraèdres de silice sont liés ensemble dans une seule chaîne, où un ion oxygène de chaque tétraèdre est partagé avec le tétraèdre adjacent, d’où moins d’oxygène dans la structure.Le résultat est que le rapport oxygène / silicium est inférieur à celui de l’olivine (3: 1 au lieu de 4: 1) et que la charge nette par atome de silicium est inférieure (–2 au lieu de –4), car moins de cations sont nécessaires pour équilibrer cette charge. Les compositions de pyroxène sont du type MgSiO3, FeSiO3 et CaSiO3, ou une combinaison de ceux-ci. Pyroxène peut également être écrit comme (Mg, Fe, Ca) SiO3, où les éléments entre parenthèses peuvent être présents dans n’importe quelle proportion. En d’autres termes, le pyroxène a un cation pour chaque tétraèdre de silice (par exemple, MgSiO3) tandis que l’olivine en a deux (par exemple, Mg2SiO4). Comme chaque ion silicium est +4 et chaque ion oxygène est –2, les trois oxygènes (–6) et le silicium (+4) donnent une charge nette de –2 pour la chaîne unique de tétraèdres de silice. Dans le pyroxène, le seul cation bivalent (2+) par tétraèdre équilibre cette charge –2. Dans l’olivine, il faut deux cations divalents pour équilibrer la charge –4 d’un tétraèdre isolé.
La structure du pyroxène est plus «permissive» que celle de l’olivine – ce qui signifie que les cations avec une gamme plus large de rayons ioniques C’est pourquoi les pyroxènes peuvent contenir des cations fer (rayon 0,63 Å) ou magnésium (rayon 0,72 Å) ou calcium (rayon 1,00 Å).
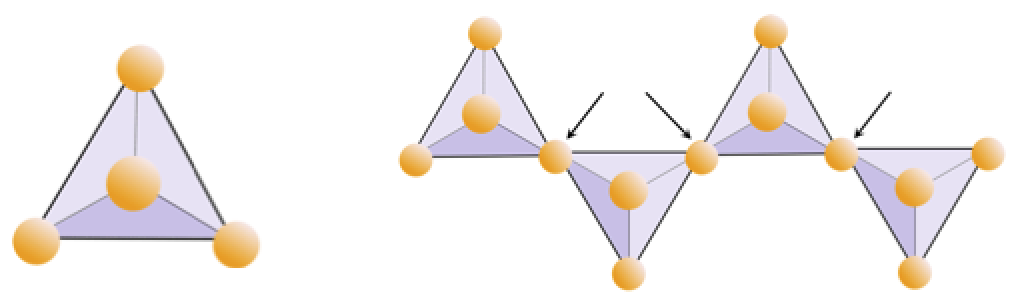
Exercice 2.4 Privation d’oxygène
Le diagramme ci-dessous représente une seule chaîne dans un minéral silicaté. Comptez le nombre de tétraèdres par rapport au nombre d’ions oxygène (sphères jaunes). Chaque tétraèdre a un ion silicium, donc cela devrait donner le rapport Si / O dans les silicates à une seule chaîne (par exemple, pyroxène).
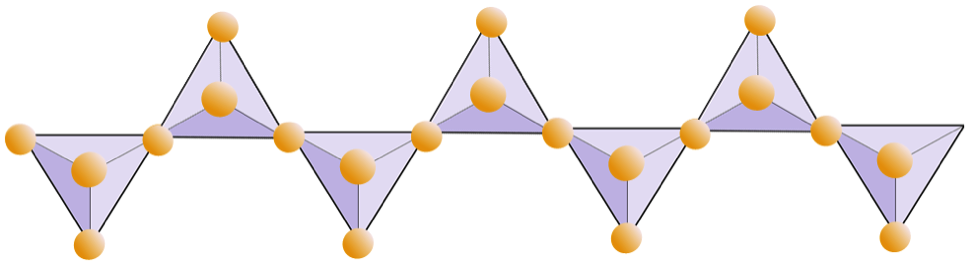
Le diagramme ci-dessous représente une double chaîne dans un minéral silicaté. Encore une fois, comptez le nombre de tétraèdres par rapport au nombre d’ions oxygène. Cela devrait vous donner le rapport de Si à O dans les silicates à double chaîne (par exemple, amphibole).
Dans les structures amphiboles, les tétraèdres de silice sont liés dans une double chaîne qui a un rapport oxygène-silicium inférieur à celui du pyroxène, et donc encore moins de cations sont nécessaires pour équilibrer la charge. L’amphibole est encore plus permissif que le pyroxène et ses compositions peuvent être très complexes. La hornblende, par exemple, peut inclure le sodium, le potassium, le calcium, le magnésium, le fer, l’aluminium, le silicium, l’oxygène, le fluor et l’ion hydroxyle (OH–).
Dans les structures en mica, le les tétraèdres de silice sont disposés en feuilles continues, où chaque tétraèdre partage trois anions oxygène avec les tétraèdres adjacents. Il y a encore plus de partage d’oxygène entre les tétraèdres adjacents et, par conséquent, moins de cations d’équilibrage de charge sont nécessaires pour les minéraux de silicate en feuille. La liaison entre les feuilles est relativement faible, ce qui explique le clivage unidirectionnel bien développé (figure 2.14). Le mica biotite peut contenir du fer et / ou du magnésium, ce qui en fait un silicate ferromagnésien minéral (comme l’olivine, le pyroxène et l’amphibole). Le chlorite est un autre minéral similaire qui comprend généralement du magnésium. Dans le mica muscovite, les seuls cations présents sont l’aluminium et le potassium; c’est donc un minéral silicate non ferromagnésien.

À part la muscovite, la biotite et la chlorite, il existe de nombreux autres silicates en feuille (ou phyllosilicates), qui existent généralement sous forme de fragments de la taille de l’argile (c’est-à-dire inférieurs à 0,004 mm). Ceux-ci incluent les minéraux argileux kaolinite, illite et smectite, et bien qu’ils soient difficiles à étudier en raison de leur très petite taille, ils sont des composants extrêmement importants des roches et en particulier des sols.
Tout le silicate en feuille les minéraux ont également de l’eau dans leur structure.
Les tétraèdres de silice sont liés dans des cadres tridimensionnels dans les feldspaths et le quartz. Ce sont des minéraux non ferromagnésiens – ils ne contiennent ni fer ni magnésium.En plus des tétraèdres de silice, les feldspaths comprennent les cations aluminium, potassium, sodium et calcium dans diverses combinaisons. Le quartz ne contient que des tétraèdres de silice.
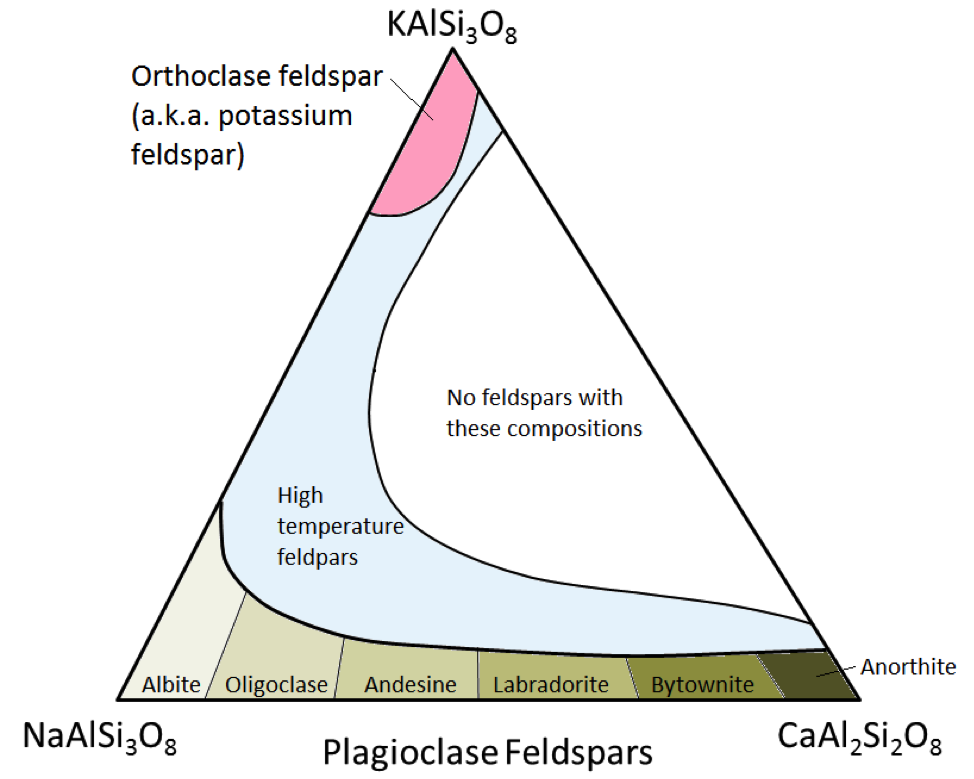
Les trois principaux minéraux feldspathiques sont le feldspath potassique (alias K-feldspath ou K-spar) et deux types de feldspath plagioclase: l’albite (sodium uniquement) et l’anorthite (calcium uniquement) . Comme c’est le cas pour le fer et le magnésium dans l’olivine, il existe une gamme continue de compositions (série de solutions solides) entre l’albite et l’anorthite dans le plagioclase. En effet, les ions calcium et sodium sont presque identiques en taille (1,00 Å contre 0,99 Å). Toute composition intermédiaire entre CaAl2Si3O8 et NaAlSi3O8 peut exister (figure 2.15). Ceci est un peu surprenant car, bien qu’ils soient de taille très similaire, les ions calcium et sodium n’ont pas la même charge (Ca2 + contre Na +). Ce problème est expliqué par la substitution correspondante de Al3 + pour Si4 +. Par conséquent, l’albite est NaAlSi3O8 (un Al et trois Si) tandis que l’anorthite est CaAl2Si2O8 (deux Al et deux Si) et les feldspaths de plagioclase de composition intermédiaire ont des proportions intermédiaires d’Al et de Si. C’est ce qu’on appelle une « substitution couplée ».
Les feldspaths plagioclases de composition intermédiaire sont l’oligoclase (10% à 30% Ca), l’andésine (30% à 50% Ca), la labradorite (50% à 70 % Ca) et bytownite (70% à 90% Ca). Le feldspath K (KAlSi3O8) a une structure légèrement différente de celle du plagioclase, en raison de la plus grande taille de l’ion potassium (1,37 Å) et en raison de cette grande taille , le potassium et le sodium ne se substituent pas facilement, sauf à des températures élevées. Ces feldspaths à haute température ne se trouvent probablement que dans les roches volcaniques, car les roches ignées intrusives refroidissent assez lentement à des températures basses pour que les feldspaths se transforment en l’un des formes à basse température.
Dans le quartz (SiO2), les tétraèdres de silice sont liés dans un cadre tridimensionnel « parfait ». Chaque tétraèdre est lié à quatre autres tétraèdres (avec un oxygène partagé à chaque coin de chaque tétraèdre), et par conséquent, le rapport du silicium à l’oxygène est de 1: 2. Puisque le cation silicium a une charge +4 et que les deux anions oxygène ont chacun une charge –2, la charge est équilibrée. Il n’y a pas besoin d’aluminium ou de l’un des autres cations tels que le sodium ou le potassium. La dureté et l’absence de clivage dans le quartz résultent des fortes liaisons covalentes / ioniques caractéristiques du tétraèdre de silice.
Exercice 2.5 Silicates ferromagnésiens?
Les minéraux silicatés sont classés comme étant ferromagnésiens ou non ferromagnésiens selon qu’ils contiennent ou non du fer (Fe) et / ou du magnésium (Mg) dans leur formule. Un certain nombre de minéraux et leurs formules sont énumérés ci-dessous. Pour chacun, indiquez s’il s’agit d’un silicate ferromagnésien.
| Minéral | Formule | Silicate ferromagnésien? |
|---|---|---|
| olivine | (Mg, Fe) 2SiO4 | |
| pyrite | FeS2 | |
| plagioclase | CaAl2Si2O8 | |
| pyroxène | MgSiO3 | |
| hématite | Fe2O3 | |
| orthoclase | KAlSi3O8 | |
| quartz | SiO2 |
| Minéral | Formule * | Silicate ferromagnésien? |
|---|---|---|
| amphibole | Fe7Si8O22 (OH) 2 | |
| muscovite | K2Al4 Si6Al2O20 (OH) 4 | |
| magnétite | Fe3O4 | |
| biotite | K2Fe4Al2Si6Al4O20 (OH) 4 | |
| dolomite | (Ca, Mg) CO3 | |
| grenat | Fe2Al2Si3O12 | |
| serpentine | Mg3Si2O5 (OH) 4 |
* Certaines des formules, en particulier les plus compliquées, ont été simplifiées.
- Un angström est l’unité couramment utilisée pour l’expression de l’atome -dimensions à l’échelle. Un angström est de 10 à 10 m ou 0,000000000001 m. Le symbole d’un angström est Å. ↵