| Politique | Permission de recherche en gastro-entérologie
Prévisibilité de la métaplasie intestinale gastrique par l’érythème tacheté par plaques vu en endoscopie
Naoyoshi Nagataa, g, Takuro Shimbob, Junichi Akiyamaa, Ryo Nakashimaa, Hyung Hun Kimc, Takeichi Yoshidad, Kazufusa Hoshimotoe, Naomi Uemuraf
aDépartement de gastroentérologie et d’hépatologie, National Center for Global Health and Medicine (NCGM), Tokyo, Japon
bDépartement de recherche clinique et d’informatique Institut international de recherche du centre de recherche clinique, NCGM, Tokyo, Japon
cDivision de médecine interne, Kosin University College of Medicine, Busan, Corée
dDépartement de gastroentérologie et d’hépatologie, Wakayama Medical University, Wakayama, Japon
eDepartment of Clinical Laboratory Pathological Division, NCGM, Tokyo, Japan
fDepartment of Gastroenterology and Hepatology, NCGM, Kohnodai Hospital, Chiba, Japon
g Auteur correspondant: Naoyoshi Nagata, Département de g astroenterology and Hepatology, National Center for Global Health and Medicine, 1-21-1 Toyama, Shinjuku-ku, Tokyo 162-8655, Japon
Manuscrit accepté pour publication le 26 septembre 2011
Titre court: Diagnostic endoscopique de la métaplasie intestinale
doi: https://doi.org/10.4021/gr357w
- Résumé
- Introduction
- Méthodes
- Résultats
- Discussion
| Résumé | ▴Haut |
Contexte: La métaplasie intestinale (MI) est considérée comme une lésion pré-maligne. Cependant, le diagnostic endoscopique de la MI a été considéré comme difficile. À l’aide de l’endoscopie, nous avons trouvé un modèle unique d’érythème, «l’érythème tacheté en plaques (MPE)», qui comprend une MI sévère. L’infection à Helicobacter pylori (Hp) elle-même peut provoquer un érythème, qui reflète des modifications histologiques de la muqueuse gastrique. Nous avons donc recruté l’éradication de Hp patients pour valider la relation entre l’EMP et les résultats pathologiques.
Méthodes: Nous avons recruté des patients atteints de gastrite chronique qui ont subi une éradication réussie de l’Hp au moins 6 mois avant l’étude. Nous avons défini l’EMP comme de multiples lésions érythémateuses plates ou dépressives. Lors de la rencontre de MPE à l’endoscopie, nous avons effectué une biopsie sur le site MPE et le site non MPE. Le site non MPE a été défini comme une muqueuse adjacente située à moins de 3 cm du site MPE. Tous les échantillons de biopsie ont été évalués par immunohistochimie pour le sous-type IM à l’aide de Coloration MUC2, MUC5AC, MUC6, CD10 et CDX2. Le degré de MI a été défini selon le système de Sydney mis à jour. La précision diagnostique des résultats de la MPE pour la MI pathologique a été calculée. la relation entre le sous-type MPE et IM a également été évaluée.
Résultats: Un total de 102 patients ont été sélectionnés pour l’étude. Parmi ceux-ci, 55 (54%) patients avaient une MPE. Des échantillons de biopsie ont été prélevés sur les sites MPE et les sites non MPE de ces 55 patients. Les pourcentages de MI et les scores médians de MI étaient tous deux significativement plus élevés sur les sites MPE (P < 0,001) que sur les sites non MPE. La sensibilité et la spécificité du MPE dans la détection de la MI histologique étaient respectivement de 72,7% et 84,1%. Aucune association significative n’a été observée dans l’expression de MUC2, MUC5AC, MUC6, CD10 et CDX2 entre les sites MPE et les sites non MPE. Il n’y avait pas de différences significatives dans les ratios (complet / incomplet) des sous-types IM entre les deux groupes.
Conclusions: MPE est une découverte endoscopique utile pour détecter IM histologique sans l’utilisation de la chromoendoscopie et de l’endoscopie grossissante. Cependant, le sous-type IM est difficile à identifier. À l’ère de l’éradication de l’Hp, le MPE a le potentiel de devenir une découverte prédictive du risque de cancer gastrique.
Mots clés: métaplasie intestinale; Lésion prémaligne; Découverte endoscopique; Érythème; Endoscopie en lumière blanche; Sous-type, éradication; Helicobacter pylori
| Introduction | ▴Haut |
On pense que le développement du cancer gastrique implique un processus en plusieurs étapes, y compris l’infection à Helicobacter pylori (Hp), la gastrite chronique, l’atrophie glandulaire, la métaplasie intestinale (MI) et enfin dysplasie. L’IM et l’atrophie gastrique sont considérées ensemble comme des facteurs de risque de développement d’un cancer gastrique de type intestinal et sont considérées comme des lésions prémalignes.L’atrophie gastrique peut être reconnue par endoscopie et est en corrélation avec l’évaluation histologique. Cependant, le diagnostic de la MI en utilisant l’endoscopie standard en lumière blanche a été considéré comme difficile en raison de l’absence de distinction de couleur de la MI et de sa présence sous forme de multiples lésions plates.
Récemment , nous avons constaté qu’une découverte érythémateuse unique à l’endoscopie pouvait être observée même après l’éradication de Hp. Nous décrivons cette découverte comme «Érythème tacheté par plaques (MPE)». L’EMP peut être reconnue comme de multiples lésions érythémateuses plates ou légèrement déprimées sous endoscopie à lumière blanche standard; pathologiquement, elle comprend une IM sévère. , nous avons recruté des patients ayant subi une éradication de l’Hp afin de valider la relation entre la MPE et les résultats pathologiques.
| Méthodes | ▴Haut |
Sélection du patient
Les patients atteints de gastrite chronique qui ont subi une éradication réussie de l’Hp au moins 6 mois avant l’étude ont été recrutés de manière prospective pour l’étude au National Center for Global Health and Medicine (NCGM) entre janvier 2008 et décembre 2008. Critères d’exclusion i Comprend l’utilisation d’anti-inflammatoires non stéroïdiens (AINS), d’antiacides et d’antithrombotiques pendant les 4 semaines précédant l’endoscopie. Nous avons également exclu les patients ayant des antécédents de chirurgie gastrique, de maladie hémorragique, de cirrhose hépatique, d’insuffisance rénale, d’insuffisance cardiaque et de cancer gastrique précoce ou avancé. Le consentement éclairé écrit a été obtenu des participants conformément à la Déclaration d’Helsinki et à sa révision ultérieure. Le protocole de l’étude a été approuvé par le comité d’éthique du NCGM.
Éradication de Helicobacter pylori
Les patients atteints de gastrite chronique et d’ulcère gastroduodénal induits par une infection à Hp ont suivi un traitement d’éradication. Les patients ont été traités avec un régime de 7 jours composé d’amoxicilline, de clarithromycine et d’un inhibiteur de la pompe à protons (IPP) deux fois par jour, qui était le schéma de première intention standard approuvé au Japon. En cas d’échec de l’éradication, un deuxième régime comprenant l’amoxicilline, le métronidazole et l’IPP était administré. L’éradication a été confirmée par un examen histologique négatif des biopsies gastriques, associé à un test respiratoire à l’urée 13C (13C-UBT) négatif 2 à 3 mois après la fin du traitement d’éradication. Lorsque tous les tests étaient négatifs, un patient était défini comme négatif pour l’infection à Hp.
Évaluation endoscopique
Au moins 6 mois après l’éradication de Hp, les patients ont subi un examen endoscopique. Nous avons utilisé un endoscope haute résolution sans grossissement (vidéoscope Olympus, modèle GIF-H260) pour observer la présence de MPE dans la muqueuse gastrique. Nous avons défini la MPE comme de multiples lésions érythémateuses plates ou légèrement déprimées qui se distinguaient de la muqueuse congestionnée, de l’hémorragie, de l’angioectasie, de l’érythème tacheté et de l’érythème linéaire (Fig.1A, B). Nous avons également distingué MPE et muqueuse rougeâtre avec un épithélium régénérant accompagné d’un ulcère ou d’une cicatrice ulcéreuse.
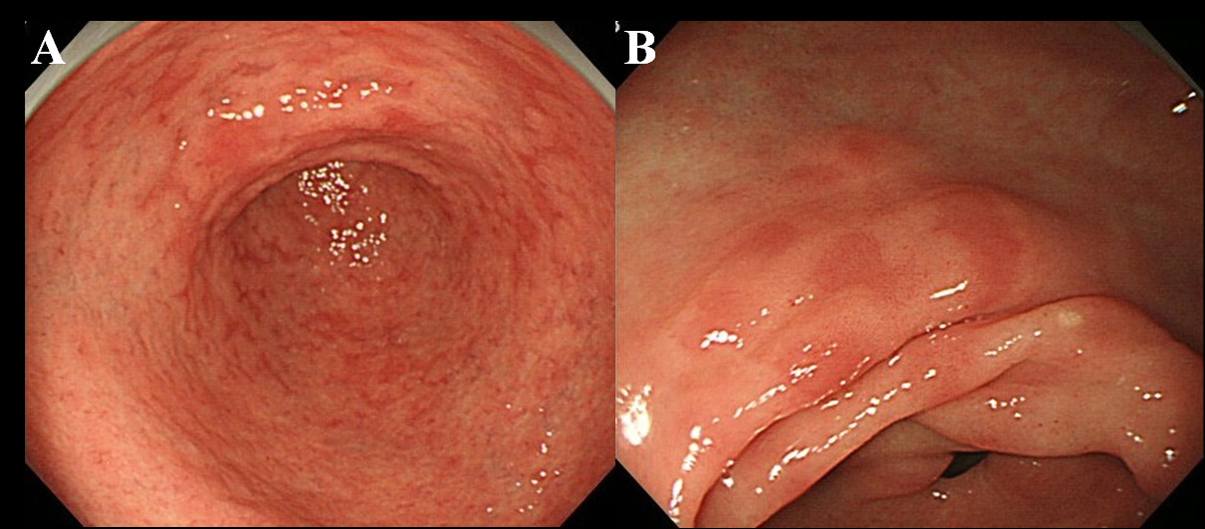 Cliquez pour une grande image |
Figure 1. Constatation endoscopique du MPE. (A) érythème multiple et plat dans l’antre; (B) Érythème plat et déprimé dans la petite courbure de l’antre. |
Lors de la découverte d’un résultat de MPE à l’endoscopie, nous avons effectué une biopsie du site MPE et du site non MPE. Le site non MPE a été défini comme une muqueuse adjacente située à moins de 3 cm du site MPE (Fig. 2).
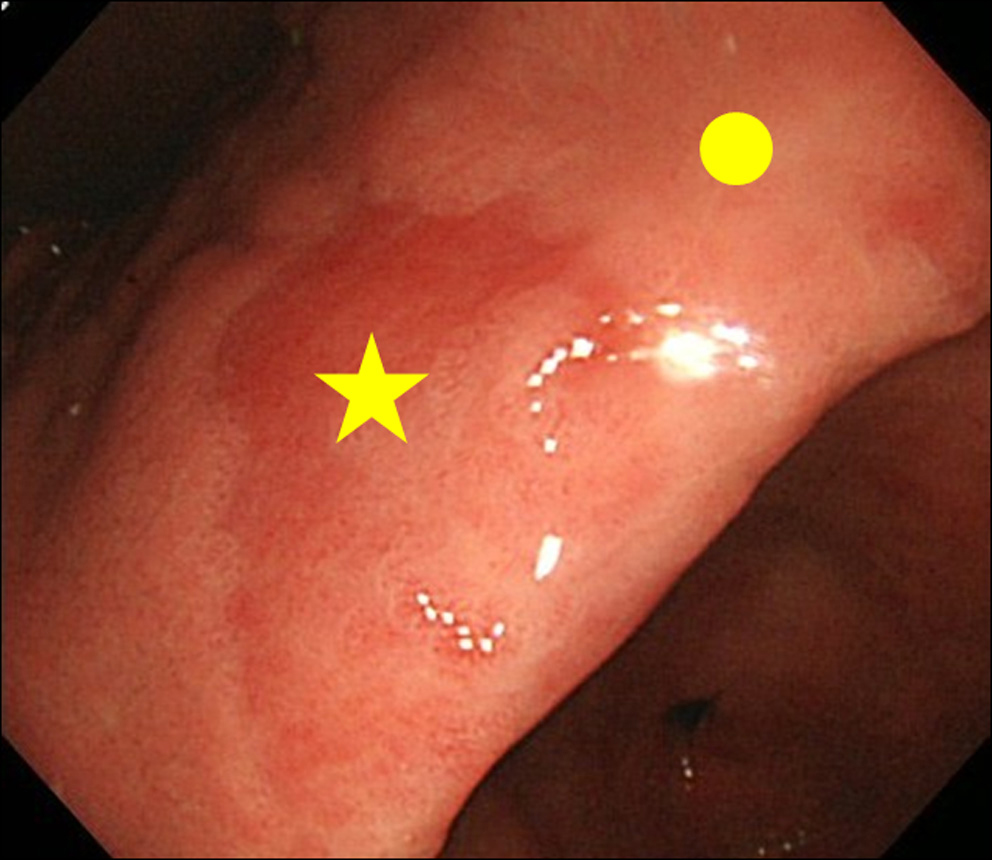 Cliquez pour une grande image |
Figure 2. Site de biopsie. (★) Site de biopsie du MPE; (•) Site de biopsie de non-MPE. Le site non MPE a été défini comme une muqueuse adjacente située à moins de 3 cm du site MPE. |
L’étendue de la frontière atrophique a été classée en 3 étapes: légère, modérée et sévère, comme défini par Kimura et Takemoto.
Bilan histologique
Des échantillons de biopsie ont été envoyés à notre laboratoire, fixés dans du formol tamponné à 10%. Les échantillons ont été traités, inclus dans de la paraffine et découpés en sections de 4 µm. Les lames de chaque échantillon ont été colorées avec de l’hématoxyline-éosine (HE) (Fig.3A) et coloration immunohistochimique. Les colorants immunohistochimiques comprenaient les éléments suivants: (1) MUC2, un marqueur de la mucine intestinale qui est utile pour détecter les cellules de gobelet (Fig.3B), (2) MUC5AC, un marqueur de la mucine gastrique, qui est exprimé dans les cellules muqueuses du cou et le Épithélium fovéolaire (Fig.3C), (3) MUC6, un marqueur de la mucine gastrique, qui est exprimée dans les cellules muqueuses de la zone du cou du corps et des glandes pyloriques de l’antre (Fig.3D), (4) CD10, un marqueur utile pour détecter la bordure en brosse de l’intestin grêle (Fig. 3E) et (5) CDX2, un marqueur de la présence de IM (Fig. 3F). Nous avons utilisé CDX2 parce que des études récentes ont montré que l’expression de CDX2 pouvait être largement observée dans les glandes IM et ne disparaissait pas après l’éradication de Hp. La présence de MI a été confirmée à la fois par HE et par coloration immunohistochimique.
Les sous-types de MI ont été classés comme des types complets ou incomplets. Le type complet a été défini comme une expression diminuée de la mucine gastrique (MUC5AC ou MUC6) et la co-expression de la mucine intestinale (MUC2) et CD10 (figures 3A-F). Le type incomplet a été défini comme l’expression de la mucine gastrique (MUC5AC ou MUC6) et MUC2. Comme il n’existe aucun critère établi pour classer un cas comme ayant à la fois les types complets et incomplets dans une section, nous avons attribué les sous-types de messagerie instantanée comme type prédominant.
Le degré de La messagerie instantanée a été notée sur la base du système de Sydney mis à jour (0: aucun, 1: léger, 2: modéré, 3: noté).
Analyse statistique
Nous avons divisé les patients en deux groupes selon que les patients étaient positifs ou négatifs pour le MPE. Nous avons utilisé le test t de Student pour comparer l’âge et la période d’éradication. Le test du chi carré ou le test de probabilité exacte de Fisher a été utilisé pour les sex-ratios et le degré d’atrophie endoscopique dans les deux groupes.
Nous avons également comparé les résultats histologiques entre les sites MPE et les sites non MPE. Pour comparer les différences entre les deux sites de biopsie, nous avons utilisé le test Wilcoxon Matched-Pairs Signed-Ranks pour l’IM score médian et test exact de Fisher pour la prévalence des sous-types IM, IM et phénotypes IM. La sensibilité, la spécificité, les valeurs prédictives positives et négatives et les rapports de vraisemblance positifs et négatifs de l’EMP observés à l’endoscopie pour la détection de l’IM pathologique ont été calculés. Les valeurs P < 0,05 ont été considérées comme significatives. Toutes les analyses statistiques ont été effectuées avec le logiciel Stata, version 10 (StataCorp LP, College Station, Texas, États-Unis).
| Résultats | ▴Haut |
Caractéristiques des patients
Au cours de la période d’étude, 157 patients qui ont subi une endoscopie supérieure et ont reçu une éradication de Hp ont été examinés. Nous avons exclu 52 des 157 patients de l’analyse pour l’un des critères suivants: utilisation d’antiacides (31), d’anti-thrombotiques (17) ou d’AINS (3); ou antécédents de cirrhose hépatique (5), d’insuffisance cardiaque (1) ou de cancer gastrique précoce (2). Plusieurs critères d’exclusion ont été appliqués à certains patients.
Un total de 102 patients a donc été sélectionné pour analyse après exclusion. Parmi ceux-ci, il y avait 55 (54%) patients atteints de MPE. Aucune différence significative n’a été notée dans l’âge moyen et le sexe entre les patients MPE-positifs et négatifs (Tableau 1). Il n’y avait aucune différence significative entre les deux groupes après la période d’éradication de Hp. Cependant, une atrophie gastrique de gravité plus élevée (modérée à sévère) est apparue significativement plus fréquemment dans le groupe MPE-positif par rapport au groupe MPE-négatif (positif 65,6% contre négatif 45,0%, P = 0,035).
 Cliquez pour afficher |
Tableau 1. Caractéristiques démographiques des patients (n = 102) |
Découvertes endoscopiques et caractéristiques pathologiques
 Cliquez pour afficher |
Tableau 2. Comparaison du score de messagerie instantanée entre les sites MPE et non MPE (n = 55) |
Aucune association significative n’a été observée dans l’expression de MUC2, MUC5AC, MUC6, C D10 et CDX2 entre les sites MPE et les sites non MPE (tableau 3). Il n’y avait pas de différence significative dans les ratios (complets / incomplets) des sous-types IM entre les deux groupes (MPE: 18/30 versus non-MPE: 8/10, p = 0,778).
 Cliquez pour voir |
Tableau 3. Phénotypes et sous-types de métaplasie intestinale |
| Discussion | ▴Haut |
Dans cette étude, nous nous sommes concentrés sur une apparence érythémateuse unique observée à l’endoscopie après l’éradication de Hp. Nous avons appelé cette constatation « MPE » et nous avons constaté que la présence de MPE comme vu à l’endoscopie était typiquement caractéristique de la MI pathologique.
Le diagnostic de MI avec l’endoscopie conventionnelle a été considérée comme difficile parce que la MI apparaît généralement dans la muqueuse plate et présente peu de changements morphologiques Kaminishi et al ont rapporté un «changement nodulaire de couleur cendrée» comme indicateur de la MI; la précision des résultats de ces chercheurs était élevée, avec une spécificité de 98 à 99%, mais la sensibilité était faible (6 à 12%). Kaminishi et al ont noté que l’endoscopie conventionnelle est moins utile pour confirmer le diagnostic de MI. Des études récentes ont émergé concernant la découverte endoscopique de la MI à l’aide de l’endoscopie grossissante. Il a été rapporté que les résultats distinctifs des fosses gastriques observées avec la chromoendoscopie au bleu de méthylène et «l’apparence des villosités» observées avec l’endoscopie confocale ont été utiles pour diagnostiquer la MI. Uedo et al ont rapporté que l’apparition d’une «crête bleu clair» ( LBC) est un signe précis de la présence d’IM, comme on le voit avec l’endoscopie à grossissement par imagerie à bande étroite (NBI). Cependant, en raison des coûts élevés de l’équipement et des compétences et du temps supplémentaires nécessaires pour un examen plus approfondi à l’aide d’outils spéciaux tels que l’IBN ou l’endoscopie à loupe, le dépistage avec cet équipement n’est pas pratique dans la pratique clinique quotidienne. En outre, il existe un risque accru de dommages à l’ADN dans la muqueuse gastro-intestinale lors de l’utilisation de la chromoendoscopie avec du bleu de méthylène suivi de lumière blanche, ce qui nécessite une utilisation prudente. Par conséquent, il est plus avantageux de diagnostiquer IM en trouvant MPE sans l’utilisation de la chromoendoscopie et de l’endoscopie agrandie. Les résultats de notre étude suggèrent que la présence de MI peut être diagnostiquée avec une endoscopie standard sans biopsie.
Pourquoi le MPE peut-il être observé même après l’éradication de Hp? Cela pourrait être attribuable aux changements histologiques dans la muqueuse gastrique. Les changements histologiques remarquables après l’éradication comprennent des améliorations de l’infiltration des cellules inflammatoires, une hyperplasie épithéliale et un œdème. Les images endoscopiques des muqueuses érythémateuses et œdémateuses qui semblent améliorées reflètent ces changements histologiques. Par conséquent, nous supposons que le MPE consiste en une zone restante de MI érythémateux persistant et une zone non-IM rapidement récupérée résultant d’une éradication réussie de Hp. L’éradication de Hp a rendu plus clair le contraste entre la zone MPE et les zones non MPE. Cependant, on ne sait pas pourquoi seul le site MPE est observé comme une muqueuse érythémateuse. On peut probablement en déduire qu’une zone très dense de microvaisseaux entoure les glandes métaplasiques; cela n’a pas été élucidé dans cette étude. De plus, le score IM sur le site MPE était significativement plus élevé que le score sur le site non MPE. Nous supposons que l’apparence de la muqueuse érythémateuse est associée à la présence de nombreuses glandes métaplasiques.
La présente étude a démontré que le sous-type IM complet était principalement trouvé dans la muqueuse gastrique . Les sous-types de MI ont été classés en type complet ou incomplet; ce sont les sous-types les plus utilisés. Plusieurs études ont montré que le type complet ne présente pas de risque accru de développer un carcinome, alors que le type incomplet est associé à un risque accru de transformation maligne. Cependant, l’association entre les sous-types et le risque de cancer gastrique n’est pas largement acceptée. À l’heure actuelle, il est difficile d’identifier l’un ou l’autre des sous-types en utilisant l’endoscopie standard.
Il a été rapporté que le traitement d’éradication de l’Hp est efficace pour prévenir à la fois l’ulcère gastro-intestinal et le développement du cancer gastrique. Ces utilisations de la thérapie d’éradication de l’Hp émergeront probablement dans la pratique clinique dans un proche avenir. Cependant, il faut être prudent contre le risque de développement d’un cancer gastrique après l’éradication de Hp. Il a été rapporté que les caractéristiques du cancer gastrique après éradication comprennent une IM pathologiquement sévère au niveau du corpus et une atrophie gastrique sévère détectée à l’endoscopie. Par conséquent, il est nécessaire d’observer attentivement la présence de MI même après l’éradication de Hp.
En conclusion, la présence de MPE à l’examen endoscopique est caractéristique de la MI pathologique.Il serait bénéfique dans la pratique clinique de pouvoir diagnostiquer une IM pathologique sans chromoendoscopie ni endoscopie grossissante. Le MPE a le potentiel de devenir une découverte prédictive du risque de cancer gastrique à l’ère de l’éradication de l’Hp.
Remerciements
Nous remercions le Dr Hidenobu Watanabe et le Dr Hiroyoshi Ota pour leurs services consultatifs à cette étude concernant les évaluations pathologiques. Nous souhaitons exprimer notre gratitude à Hisae Kawashiro, coordinateur de la recherche clinique, pour son aide dans la collecte de données.
Subvention de soutien
Ce travail a été soutenu par le Grant of National Center for Global Health and Medicine (21-108).
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
| ▴Haut |
- Correa P. Carcinogenèse gastrique humaine: un processus en plusieurs étapes et multifactoriel – Première conférence sur le cancer de l’American Cancer Society Award Épidémiologie et prévention. Cancer Res. 1992; 52 (24): 6735-6740.
pubmed - Leung WK, Sung JJ. Article de synthèse: métaplasie intestinale et carcinogenèse gastrique. Aliment Pharmacol Ther. 2002; 16 (7): 1209-1216.
pubmed doi - Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, et al. Infection à Helicobacter pylori et développement d’un cancer gastrique. N Engl J Med. 2001; 345 (11): 784-789.
pubmed doi - Kimura K, Takemoto T. Une reconnaissance endoscopique de la frontière atrophique et de son importance dans la gastrite chronique. Endoscopie. 1969; 1: 1-3.
- Satoh K, Kimura K, Taniguchi Y, Kihira K, Takimoto T, Saifuku K, Kawata H, et al. Sites de biopsie adaptés au diagnostic de l’infection à Helicobacter pylori et à l’évaluation de l’étendue de la gastrite atrophique. Am J Gastroenterol. 1998; 93 (4): 569-573.
pubmed doi - Kaminishi M, Yamaguchi H, Nomura S, Oohara T, Sakai S, Fukutomi H, Nakahara A, et al. Classification endoscopique de la gastrite chronique basée sur une étude pilote de la Research Society for Gastritis. Digest Endosc. 2002; 14: 138-151.
- Rugge M, Leandro G, Farinati F, Di Mario F, Sonego F, Cassaro M, Guido M, et al. Dysplasie épithéliale gastrique. Comment le contexte clinicopathologique est lié à la gestion. Cancer. 1995; 76 (3): 376-382.
pubmed doi - Nagata N, Akiyama J, Uemura N. Diagnostic endoscopique de métaplasie intestinale gastrique après éradication de Helicobacter pylori. Endoscopie. 2009; 41 (suppl I): A212.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classification et classement de la gastrite. Le système de Sydney mis à jour. Atelier international sur l’histopathologie de la gastrite, Houston 1994. Am J Surg Pathol. 1996; 20 (10): 1161-1181.
pubmed doi - Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Expression du gène de la mucine dans l’épithélium gastrique humain normal, prénéoplasique et néoplasique. Cancer Res. 1995; 55 (12): 2681-2690.
pubmed - Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, et al. Les mucines comme molécules clés pour la classification de la métaplasie intestinale de l’estomac. Virchows Arch. 2002; 440 (3): 311-317.
pubmed doi - Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, et al. La métaplasie intestinale de l’estomac humain présente des modèles distincts d’expression de la mucine (MUC1, MUC2, MUC5AC et MUC6). Cancer Res. 1999; 59 (5): 1003-1007.
pubmed - Groisman GM, Amar M, Livne E. CD10: un outil précieux pour le diagnostic au microscope optique de la maladie d’inclusion microvilleuse (atrophie microvilleuse familiale). Suis J Surg Pathol. 2002; 26 (7): 902-907.
pubmed doi - Carl-McGrath S, Lendeckel U, Ebert M, Wolter AB, Roessner A, Rocken C. Les ectopeptidases CD10, CD13, CD26 et Les CD143 sont régulés à la hausse dans le cancer gastrique. Int J Oncol. 2004; 25 (5): 1223-1232.
pubmed - Bai YQ, Yamamoto H, Akiyama Y, Tanaka H, Takizawa T, Koike M, Kenji Yagi O, et al. Expression ectopique de la protéine homéodomaine CDX2 dans la métaplasie intestinale et les carcinomes de l’estomac. Cancer Lett. 2002; 176 (1): 47-55.
pubmed doi - Satoh K, Mutoh H, Eda A, Yanaka I, Osawa H, Honda S, Kawata H, et al. Expression aberrante de CDX2 dans la muqueuse gastrique avec et sans métaplasie intestinale: effet de l’éradication d’Helicobacter pylori. Helicobacter. 2002; 7 (3): 192-198.
pubmed doi - Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba- Viana H et coll. Chromoendoscopie à grossissement pour le diagnostic de la métaplasie et de la dysplasie intestinales gastriques. Gastrointest Endosc. 2003; 57 (4): 498-504.
pubmed doi - Areia M, Amaro P, Dinis-Ribeiro M, Cipriano MA, Marinho C, Costa-Pereira A, Lopes C, et al. Validation externe d’une classification pour la chromoendoscopie à grossissement au bleu de méthylène dans les lésions gastriques prémalignes. Gastrointest Endosc. 2008; 67 (7): 1011-1018.
pubmed doi - Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Modèles endoscopiques de la muqueuse gastrique et sa signification clinicopathologique. Monde J Gastroenterol. 2003; 9 (11): 2552-2556.
pubmed - Uedo N, Ishihara R, Iishi H, Yamamoto S, Yamada T, Imanaka K, Takeuchi Y, et al. Une nouvelle méthode de diagnostic de la métaplasie intestinale gastrique: l’imagerie à bande étroite avec endoscopie grossissante. Endoscopie. 2006; 38 (8): 819-824.
pubmed doi - Kiesslich R, Jung M. Endoscopie par grossissement: améliore-t-elle l’analyse de la surface muqueuse pour le diagnostic des néoplasies gastro-intestinales ?. Endoscopie. 2002; 34 (10): 819-822.
pubmed doi - Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Chromoendoscopie avec bleu de méthylène et dommages à l’ADN associés dans l’oesophage de Barrett. Lancet. 2003; 362 (9381): 373-374.
pubmed doi - Oda Y , Miwa J, Kaise M, Matsubara Y, Hatahara T, Ohta Y. Étude de suivi de cinq ans sur les altérations histologiques et endoscopiques de la muqueuse gastrique après l’éradication d’Helicobacter pylori. Dig Endosc.2004; 16: 213-18.
- Tepes B, Kavcic B, Zaletel LK, Gubina M, Ihan A, Poljak M, Krizman I. Suivi histologique de deux à quatre ans de la muqueuse gastrique après Helicobacter pylori éradication. J Pathol. 1999; 188 (1): 24-29.
pubmed doi - Jass JR, Filipe MI. Les profils de mucine de l’estomac normal muqueuse, métaplasie intestinale et ses variantes et carcinome gastrique. Histochem J. 1981; 13 (6): 931-939.
pubmed doi - Filipe MI, Munoz N, Matko I, Kato I, Pompe-Kirn V, Jutersek A, Teuchmann S, et al.Types de métaplasie intestinale et risque de cancer: une étude de cohorte en Slovénie. Int J Cancer. 1994; 57 (3): 324-329.
pubmed doi - Rokkas T, Filipe MI, Sladen GE. Détection d’une incidence accrue de cancer gastrique précoce chez les patients atteints de métaplasie intestinale de type III qui sont suivis de près. Intestin. 1991; 32 (10): 1110-1113.
pubmed doi - Genta RM, Rugge M. Article de synthèse: états pré-néoplasiques de la muqueuse gastrique – une approche pratique pour le clinicien perplexe. Aliment Pharmacol Ther. 2001; 15 (Suppl 1): 43-50.
pubmed - Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, et al. Effet de l’éradication d’Helicobacter pylori sur l’incidence du carcinome gastrique métachrone après résection endoscopique d’un cancer gastrique précoce: un essai contrôlé randomisé en ouvert. Lancette. 2008; 372 (9636): 392-397.
pubmed doi - Tashiro J, Miwa J, Tomita T; Matsubara Y, Oota Y. Cancer gastrique détecté après l’éradication de Helicobacter pylori. Endoscopie digestive. 2007; 19: 167-173.
Il s’agit d’un article en libre accès distribué sous les termes de la Creative Commons Attribution License, qui permet une utilisation, une distribution et une reproduction sans restriction sur tout support, à condition que l’œuvre originale soit correctement citée.
Gastroenterology Research est publié par Elmer Press Inc.