Francium-Element-Fakten
Das chemische Element Francium wird als Alkalimetall eingestuft. Es wurde 1939 von Marguerite Perey entdeckt.

Datenzone
| Klassifizierung: | Francium ist ein Alkalimetall |
| Farbe: | silbergrau-metallisch (vermutet) |
| Atomic Gewicht: | (223), keine stabilen Isotope |
| Zustand: | fest |
| Schmelzpunkt: | 27 oC, 300 K |
| Siedepunkt: | 677 oC, 950 K |
| Elektronen: | 87 |
| Protonen: | 87 |
| Neutronen in den am häufigsten vorkommenden Isotopen: | 136 |
| Elektronenschalen: | 2, 8,18,32,18,8,1 |
| Elektronenkonfiguration: | 7s1 |
| Dichte bei 20 ° C: | 1,873 g / cm3 |
Mehr anzeigen, einschließlich: Wärme, Energie, Oxidation,
Reaktionen, Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 71,07 cm3 / mol |
| Struktur: | vermutlich bcc: kubisch raumzentriert |
| Härte: | – |
| Spezifische Wärmekapazität | – |
| Schmelzwärme | 2 kJ mol-1 |
| Zerstäubungswärme | 73 kJ mol-1 |
| Verdampfungswärme | 64 kJ mol-1 |
| 1. Ionisierungsenergie | 384 kJ mol-1 |
| 2. Ionisierungsenergie | – |
| 3. Ionisierungsenergie | – |
| Elektronenaffinität | – |
| Minimale Oxidationszahl | 0 |
| min. gemeinsame Oxidationsnummer | 0 |
| Maximale Oxidationszahl | 1 |
| Max. gemeinsame Oxidation Nr. | 1 |
| Elektronegativität (Pauling-Skala) | 0,7 |
| Polarisierbarkeit Volumen | 48,7 Å3 |
| Reaktion mit Luft | – |
| Reaktion mit 15 M HNO3 | – |
| Reaktion mit 6 M HCl | heftig, ⇒ H2, FrCl |
| Reaktion mit 6 M NaOH | heftig, ⇒ H2, FrOH |
| Oxid (e) | – |
| Hydrid (e) | – |
| Chlorid (e) | – |
| Atomradius | – |
| Ionenradius (1+ Ion) | 194 pm |
| Ionenradius (2+ Ionen) | – |
| Ionenradius (3+ Ionen) | – |
| Ionenradius (1-Ion) | – |
| Ionenradius (2-Ionen) | – |
| Ionenradius (3-Ionen) | – |
| Wärmeleitfähigkeit | 3,61 W. m-1 K-1 |
| Elektrische Leitfähigkeit | – |
| Gefrier- / Schmelzpunkt: | 27 oC, 300 K |

Diese Uranerzprobe enthält etwa 100 000 Atome Francium-223 (3,3 x 10 -20 g). Francium ist radioaktiv; Zu jedem Zeitpunkt existieren weniger als 30 g davon auf der Erde. Bildreferenz (1)
Entdeckung von Francium
Francium wurde 1939 von Marguerite Perey entdeckt, als sie den radioaktiven Zerfall von Actinium-227 untersuchte.
Die Entdeckung fand am Curie-Institut in Paris statt. Das Element hat seinen Namen vom Land seiner Entdeckung – Frankreich.
Die Entdeckung begann 1935, als Perey im Alter von 26 Jahren ein Forschungspapier las, in dem behauptet wurde, amerikanische Wissenschaftler hätten Beta-Partikel entdeckt, die von Actinium emittiert werden hatte eine höhere Energiemenge als normal.
Perey war neugierig auf diesen Befund und entschied sich bereits als Expertin für aktiniumbezogene Arbeiten, ihre eigenen Experimente mit Aktinium durchzuführen. Sie produzierte eine ultrareine Actiniumprobe und untersuchte deren Strahlung. Perey entdeckte, dass etwa 1% der Radioaktivität von Actiniums durch die Emission von Alpha-Partikeln und nicht von Beta-Partikeln verursacht wurde.
Perey hatte entdeckt, dass Actinium-227 durch Emission eines Heliumkerns (auch Alpha-Partikel genannt) zerfallen kann seinen eigenen Kern. Der gebildete Tochterkern war ein zuvor unentdecktes Element, das sie zu Ehren ihres Heimatlandes Francium Francium nannte.
227Ac → 223Fr + 4He
Mit 87 Protonen gehörte das neue Element dazu Gruppe 1 des Periodensystems, die die anderen fünf Alkalimetalle verbindet: Lithium, Natrium, Kalium, Rubidium und Cäsium.
Die Entdeckung von Francium vervollständigte die Entdeckung natürlich vorkommender Elemente durch die Menschheit.
Alle seitdem entdeckten Elemente wurden entdeckt, als das Element im Labor hergestellt wurde.

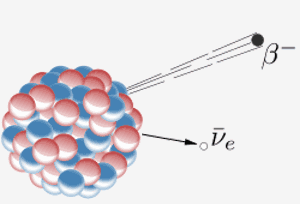
Ein Kern emittiert ein Beta-Teilchen ( ein Elektron) und ein Antineutrino. Das Ergebnis ist, dass ein Neutron im Kern zu einem Proton wird. Wenn Element 87 im Periodensystem (Francium) dies tut, bedeutet das zusätzliche Proton, dass es zu Element 88 (Radium) wird.
Aussehen und Eigenschaften
Schädliche Wirkungen:
Francium ist hochradioaktiv.
Eigenschaften:
Francium ist ein schweres, instabiles, radioaktives Metall mit eine maximale Halbwertszeit von nur 22 Minuten. Es hat einen niedrigen Schmelzpunkt (27 oC, 81 oF) und wenn sich genug davon ansammeln könnte, wäre es in einem warmen Raum flüssig.
Francium ist das zweit seltenste Element in der Erdkruste. neben Astatine. Zu jedem Zeitpunkt gibt es auf der Erde weniger als 30 Gramm Francium.
Francium ist das am wenigsten elektronegative aller Elemente, daher sollte es das chemisch reaktivste Alkalimetall sein. Leider ist es nicht in ausreichenden Mengen verfügbar, um zu zeigen, dass es mit Wasser reagiert – es wird in winzigen Mengen in Teilchenbeschleunigern hergestellt. Theoretisch wäre seine Reaktion mit Wasser heftiger als die von Cäsium und sehr viel heftiger als die von Natrium.
Francium wurde zuletzt an der Stony Brook University in New York untersucht. Dort haben Wissenschaftler mit Laserstrahlen in einem Magnetfeld bis zu zehntausend Franciumatome gleichzeitig eingefangen, um ihre Eigenschaften zu messen.
Verwendung von Francium
Kommerziell gibt es aufgrund seiner Seltenheit und Instabilität keine Verwendung für Francium. Es wird nur zu Forschungszwecken verwendet.
Francium-Zerfall
Francium-Isotope mit Massenzahlen zwischen 200 und 232 unterliegen am häufigsten einem Alpha- oder Beta-Zerfall.
Hier nur einige Beispiele für die Zerfallspfade von Francium:
Francium-223 ist das langlebigste Isotop des Elements. Es hat eine Halbwertszeit von 22 Minuten. Es kann ein Alpha-Teilchen (einen Heliumkern) emittieren, um Astatin-219 zu bilden, oder ein Beta-Teilchen, um Radium-223 zu bilden. (Ein Beta-Teilchen ist ein Elektron, das von einem Kern emittiert wird, wenn sich ein Neutron in ein Proton umwandelt.)
Francium-221 hat eine Halbwertszeit von 5 Minuten. Es kann ein Alpha-Teilchen emittieren, um Astatin-217 zu bilden, oder ein Beta-Teilchen, um Radium-221 zu werden.
Francium-216 hat eine Halbwertszeit von 0,7 Mikrosekunden. Es kann ein Alpha-Teilchen emittieren, um Astatin-212 zu bilden, oder ein Positron, um Radon-216 zu bilden.
Francium-212 hat eine Halbwertszeit von 19 Minuten. Es kann ein Alpha-Teilchen emittieren, um Astatin-208 zu bilden, oder ein Orbitalelektron einfangen, um Radon-212 zu bilden. (2) (Während des Einfangens von orbitalen Elektronen fängt der Kern eines der eigenen Elektronen des Atoms ein und emittiert ein Neutrino.)
Häufigkeit und Isotope
Häufigkeit der Erdkruste: ~ 0 Teile pro Million , ~ 0 Teile pro Million
Sonnensystem im Überfluss: ~ 0 Teile pro Milliarde nach Gewicht, ~ 0 Teile pro Milliarde nach Mol
Kosten, rein: $ pro 100 g
Kosten, Volumen: $ pro 100 g
Quelle: Francium kommt auf natürliche Weise als Folge des alpha-radioaktiven Zerfalls von Actinium vor.
Isotope: Francium hat 33 Isotope, deren Halbwertszeiten sind bekannt, mit Massenzahlen von 200 bis 232. Keine sind stabil. 223Fr hat mit 21,8 Minuten die längste Halbwertszeit.

- Foto von Konrad Roeder
- EK Hyde, a. Ghiorso, G.T. Seaborg, Physical Review., 1950, 77, S. 765, Ausgabe 6.
Diese Seite zitieren
Für Online-Links kopieren Sie bitte eine der folgenden Seiten und fügen Sie sie ein:
<a href="https://www.chemicool.com/elements/francium.html">Francium</a>
oder
<a href="https://www.chemicool.com/elements/francium.html">Francium Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Angabe:
"Francium." Chemicool Periodic Table. Chemicool.com. 11 Jan. 2015. Web. <https://www.chemicool.com/elements/francium.html>.