Grenzen der Immunologie
Einleitung
Präeklampsie ist eine schwangerschaftsspezifische Erkrankung, von der 3–5% aller Schwangerschaften betroffen sind (1, 2). Es manifestiert sich mit neu auftretender Hypertonie nach 20 Schwangerschaftswochen und Proteinurie. Die Plazenta spielt eine zentrale Rolle bei der Pathogenese der Krankheit, indem sie die Mutter mit dem Fötus verbindet (3). Die Schnittstelle zwischen Mutter und Fötus ist die Zone, in der genetisch unterschiedliches Gewebe fetalen Ursprungs auf mütterlichen Kreislauf, Endothel und Immunsystem trifft. Eine allgemein anerkannte Erkenntnis, die oft als Krankheit der Theorien bezeichnet wird, ist, dass Präeklampsie das mütterliche Endothel beeinflusst und die Funktion des Endothels stört, was zu Bluthochdruck und Proteinurie führt (2). In ihrer schweren Form kann Präeklampsie zu einer Verzögerung des fetalen Wachstums, zu Frühgeburten und bei der Mutter zu Organversagen in Nieren und Leber sowie zu Eklampsie führen. Darüber hinaus kann Präeklampsie langfristige nachteilige kardiovaskuläre Folgen für Mutter und Neugeborenes haben (4). Die Entwicklung der Plazenta wird speziell im Prozess der Transformation der Spiralarterien der Mutter als unzureichend angesehen, bei dem die Trophoblastenzellen in die Mutterseite in Decidua eindringen und die Arterien in Leitungen mit geringem Widerstand umwandeln, wodurch auch das Endothel der Mutter ersetzt wird (5–7). Typischerweise fehlt diese Umgestaltung der Uterusarterien, insbesondere bei schwerer Form der Präeklampsie. Ein hoher Widerstand in den verengten Uterusarterien führt zu einem turbulenten Blutfluss in den Zwischenraum der Plazenta, der oxidativen Stress und mechanische Schäden an den Zottenbäumen der Plazenta verursacht. Die daraus resultierende Schädigung erhöht die Plazentaausscheidung von Mikropartikeln und Entzündungsmediatoren, was zu einer generalisierten endothelialen Aktivierung und Dysfunktion führt (8, 9). Diese sequentiellen Ereignisse in der Schnittstelle zwischen Mutter und Fötus führen zu mütterlicher Hypertonie und anderen oben beschriebenen Symptomen. Das HELLP-Syndrom wurde erstmals 1982 von Weinstein als separates Syndrom charakterisiert, das häufig zusammen mit Präeklampsie auftritt, aber auch allein gesehen wird (10, 11). Das HELLP-Syndrom ist durch Hämolyse, erhöhte Leberenzyme und niedrige Blutplättchen gekennzeichnet. Es erfordert oft eine Beobachtung auf der Intensivstation und eine symptomatische Therapie. Die Pathogenese des Syndroms liegt noch im Schatten. Das HELLP-Syndrom hat gemeinsame Merkmale mit thrombotischen Mikroangiopathien (TMAs) wie der thrombotischen thrombozytopenischen Purpura (TTP) und dem hämolytisch-urämischen Syndrom (HUS). TMAs treten bei verschiedenen Krankheitsgruppen mit gemeinsamen Merkmalen der mikroangiopathischen Hämolyse, Thrombozytopenie und Organschäden infolge von Mikrothromben auf. Bei TTP führt ein genetischer Defekt von oder wie in den allermeisten Fällen erworbenen Autoantikörpern gegen ein Desintegrin und eine Metalloproteinase mit Thrombospondin Typ 1-Motiv 13 (ADAMTS13), dem Enzym, das den aktivierten von Willebrand-Faktor (vWF) spaltet, zur Bildung von ungewöhnlich großen aktivierte vWF-Multimere auf Endothelzellen, die zu Thrombozyten in kleinen Gefäßen und Hämolyse führen. Typisches HUS wird durch eine Shiga-Toxin-produzierende bakterielle Infektion (insbesondere Escherichia coli) verursacht, während sich atypisches HUS (aHUS) auf die Art von TMA bezieht, bei der genetische Defizite in den Regulatoren des alternativen Weges des Komplementsystems zugrunde liegen, die in Gegenwart vorliegen eines Auslösers kann die klinische Erkrankung verursachen (12, 13). Die von der FDA zugelassene Behandlung für aHUS ist die Infusion des Komplement-C5-Antagonisten Eculizumab, der die Bildung des Membranangriffskomplexes (MAC) verhindert (Abbildung 1). Klinisch hat HELLP die gleichen Symptome wie klassische TMAs: Hämolyse, Thrombozytopenie und Organstörung in der Leber. Abhängig von der verwendeten TMA-Klassifizierung wird das HELLP-Syndrom normalerweise als Teil sekundärer oder erworbener TMAs kategorisiert (Tabelle 1).
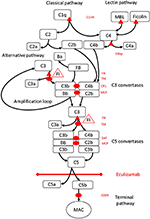
Abbildung 1. Eculizumab hemmt den terminalen Weg der Komplementaktivierung. Die Komplementaktivierung kann über drei Aktivierungswege initiiert werden, die alle zur Bildung von C5-Konvertasen führen, die den terminalen Weg aktivieren können, der zur Bildung des MAC auf der Zieloberfläche führt. Diese schematische Darstellung des Komplementsystems zeigt die wichtigsten Aktivatoren (in schwarzer Schrift) und Inhibitoren (in roter Schrift). Die Aktivatoren können membrangebunden (oval) oder löslich (Dreieck) sein. Der alternative Weg wird spontan auf allen Oberflächen aktiviert, die keine Hemmung durch den löslichen Regulatorfaktor H (FH) zulassen. FH fungiert als Cofaktor für die Inaktivierung von C3b zu iC3b durch Faktor I (FI). Thrombomodulin (TM) erhöht die FH-Cofaktoraktivität. Der gespaltene Faktor B (FB) bildet zusammen mit dem Aktivator C3b die Konvertase des alternativen Weges, die die Fähigkeit besitzt, C3 in C3b zu spalten, wodurch eine Amplifikationsschleife der Aktivierung des alternativen Weges erzeugt wird.Der klassische Weg der Komplementaktivierung kann beispielsweise durch Bindung von Immunkomplexen an C1q initiiert werden, während der Lektinweg durch Mannosen-Bindungslektin (MBL) oder Ficoline aktiviert wird, die beispielsweise an Muster von Kohlenhydraten auf Mikroben binden. Die Aktivierung des Lektinweges führt dazu, dass Mannose-assoziierte Serinproteasen 1 und 2 (MASP-1 und MASP-2, nicht abgebildet) die Komplementkomponenten C4 und C2 spalten, um die klassische Wegkonvertase C4bC2b zu bilden. C1-Inhibitor (C1inh) und C4bp sind die löslichen Regulatoren des klassischen Weges, während Membran-Cofaktor-Protein (MCP) und Komplementrezeptor 1 (CR1) membrangebundene Regulatoren früher Komplement-Wege sind. Die Bildung von C5-Konvertasen initiiert den terminalen Weg der Komplementaktivierung und -spaltung von C5 in Abwesenheit von oberflächengebundenen Regulatoren, die den Beschleunigungsfaktor (DAF) und MCP zerfallen. Die Montage des MAC wird durch den oberflächengebundenen Regler CD59 (Protectin) reguliert. Die Spaltung von C3 in den frühen Pfaden und C5 im terminalen Pfad setzt die Anaphylatoxine C3a und C5a frei und führt zu Entzündungen. Eculizumab ist ein humanisierter rekombinanter Antikörper gegen das Komplementprotein C5, der die Spaltung von C5 durch die C5-Konvertasen hemmt und dadurch die prothrombotischen und proinflammatorischen Wirkungen der Komplementaktivierung reguliert. Der in diesem Fallbericht beschriebene Patient wurde auf genetische Mutationen in Genen getestet, die für Faktor H (CFH), FHR5 und MCP, CFI, CFB, THBD und ADAMTS13 (ADAMTS13), einen Regulator des vWF-Weges der Gerinnungskaskade, kodieren (nicht) gezeigt). Die Ergebnisse der Gentests waren negativ.

Tabelle 1. HELLP- und aHUS-Diagnosekriterien.
In dieser Fallstudie berichten wir über a Patientin mit einer komplizierten schwangerschaftsinduzierten TMA und dem erfolgreichen Behandlungsverlauf.
Falldarstellung
Die 29-jährige Primigravida wurde im Gestationsalter 34 + 2 an das Universitätsklinikum Helsinki überwiesen Ambulanz mit Schmerzen im Oberbauch. Anfangs war ihr Blutdruck leicht erhöht (133/91 mmHg) und der Urinmessstab proteinpositiv. Die anfänglich berichteten Schmerzen im oberen Magen besserten sich allmählich. Im Ultraschall hatte der Fötus ein normales biophysikalisches Profil (BPP), die Gewichtsschätzung lag bei der –2 SD-Wachstumskurve. Die Kardiotokographie (CTG) war normal. Das Bluthämoglobin (Hb) betrug 115 g / l, die Blutplättchen 158 E9 / l (Normalbereich 150–360 E9 / l), die Alaninaminotransferase (ALT) war normal (23 U / l). Der Urinmessstab war positiv für Protein (+2) und die berechnete Proteinurie betrug 1,6 g / 24 h. Es wurde beschlossen, eine Cortison-Behandlung einzuleiten, um die Lungenreifung des Babys zu erleichtern. Der Patient wurde mit dem Plan entlassen, am nächsten Tag zur Kontrolluntersuchung und zur zweiten Dosis Cortison zurückzukehren. Wie geplant kam sie in der Gestationswoche 34 + 4 zur Kontrolle. Der Blutdruck betrug 147/87 mmHg, ALT 23, Thrombozyten 177, CTG und der BPP des Fetus im Ultraschall war normal. Sie wurde entlassen und eine weitere Untersuchung war geplant. Am Nachmittag desselben Tages kehrten die Schmerzen im oberen Magen zurück und verschlechterten sich gegen Abend stetig. Sie kehrte um 2.20 Uhr morgens ins Krankenhaus zurück. Sie hatte starke Schmerzen im Oberbauch und Unruhe. Sie hatte sich zweimal übergeben und fühlte Zittern. Der Blutdruck war bei 170/94 mmHg deutlich erhöht, der Urinprotein-Teststreifen war stark positiv, die ALT war bei 159, Hb 122 und die Blutplättchen 172 erhöht. Sie wurde in die pränatale Abteilung aufgenommen. Um 4 Uhr morgens hatte sie Kopfschmerzen. Es wurde mit blutdrucksenkenden Medikamenten begonnen (Labetalol 100 mg dreimal). Die Proteinausscheidung im Urin erreichte in der Nacht einen Höchstwert von 13 g / 24 h. Anschließend begann sie sich zu übergeben, hatte Schmerzen im Oberbauch, Kopfschmerzen und die CTG-Überwachung zeigte eine Verlangsamung. Der Patient wurde um 7.11 Uhr morgens auf die Entbindungsstation gebracht, und da der Gebärmutterhals drei Zentimeter erweitert war, wurden die fetalen Membranen zur Einleitung der Wehen künstlich gebrochen. Gleichzeitig wurden die Labortests mit Hb 122, Thrombozyten 172, abgeschlossen. Die Lactatdehydrogenase (LD) war jedoch zu diesem Zeitpunkt bei 1231 U / l deutlich erhöht. In der CTG wurden die Verzögerungen fortgesetzt, und als die Bradykardie fortgesetzt wurde, wurde ein Notfall-Kaiserschnitt durchgeführt. Männliches Kind (1960 g, –2 SD) wurde um 7,25 Uhr morgens mit einem pH-Wert der Nabelarterie von 7,05, BE –6,80, Apgar 1/6/8 geboren. Der Blutverlust bei der Operation betrug 400 ml.
Um 9 Uhr nach dem Kaiserschnitt waren die Blutplättchen der Mutter bei 49 mit einem Hb von 102 niedrig. Am Nachmittag war die ALT auf 1800 angestiegen, LD 3570 Der Serumkreatininspiegel betrug 153 (μmol / l), während die Blutplättchen auf 33 abnahmen. Es gab eine Störung der Gerinnung, die durch einen niedrigen Fibrinogenspiegel (1,1 g / l, Referenzwerte 2–4 g / l) und einen hohen D-Spiegel angezeigt wurde -Dimer von Fibrin (30,2 mg / l, < 0,5 mg / l). Es gab einige Blutungen aus der Kaiserschnittwunde, in die zusätzliche Nähte gelegt wurden.Zu diesem Zeitpunkt wurden acht Einheiten Blutplättchen verabreicht. Der Kaliumspiegel stieg von 4,7 auf 5,6 (mmol / l). Eine Hämolyse wurde deutlich beobachtet. Der Coombs-Test war negativ. Die Urinausscheidung betrug nur 10 ml / h. Der Labortest zeigte eindeutig eine schwere Erkrankung mit Anzeichen einer Schädigung sowohl der Nieren als auch der Leber. Zusätzlich gab es eine Störung im Gerinnungssystem, die gleichzeitig eine signifikante Gerinnung und eine ausgeprägte Fibrinolyse zeigte. Die Magnesiumsulfat-Infusion wurde aufgrund einer Hyperreflexie begonnen, die als prädiktives Zeichen für Krämpfe angesehen wird, eine schwere Komplikation der Präeklampsie. Es wurde mit intravenösem Dexamethason 10 mg begonnen und der Patient auf die Intensivstation gebracht.
Ferner wurden Labortests für Differentialdiagnosezwecke anderer medizinischer Notfälle durchgeführt (Tabelle 2). Die Aktivität von ADAMTS13 betrug 62% (40–130%), was TTP ausschließt. Die Serumkomplement-Spiegel C3 (0,52 g / l, 0,71–1,41 g / l) und C4 (0,07 g / l, 0,12–0,34 g / l) waren niedrig. Der Gehalt an löslichem terminalem Komplex des Komplements (C5b-9, 971 ng / ml, < 366 ng / ml) war am ersten Tag nach der Geburt erhöht. Antiphospholipid-Antikörper wurden nicht nachgewiesen, die Infektionsserologie bezüglich Hepatitis B und C und HIV waren negativ. Aus der Stuhlprobe wurden die Krankheitserreger, die ein typisches HUS verursachen, negativ getestet.

Tabelle 2. Zeitplan der Krankheitsdiagnose und -behandlung.
Der Patient wurde am ersten und zweiten Tag nach der Geburt mit einer Plasmaaustauschbehandlung behandelt und wurde im Verlauf ihrer Behandlung (Tage 2, 4 und 6 nach der Geburt) insgesamt dreimal hämodialysiert.
Am dritten Tag nach der Geburt war die Patientin stabil und wurde in den Aufwachraum des Frauenkrankenhauses zurückgebracht Die symptomatische Therapie wurde fortgesetzt. Die Hypertonie wurde zweimal täglich mit 10 mg Amlodipin und dreimal täglich mit 200 mg Labetalol behandelt. Am vierten Tag nach der Geburt nahmen die Blutplättchen weiter ab und bei dem Patienten wurde aHUS diagnostiziert. Oft wurde die Differentialdiagnose mit HELLP-Syndrom und aHUS liegt in der spontanen Genesung von HELLP-Patienten, normalerweise am dritten Tag nach der Geburt. Die Behandlung mit Eculizumab wurde begonnen (900 mg iv). Pati ent erhielt eine Pneumokokkenimpfung und es wurde mit einem prophylaktischen Antibiotikum (Penicillin) begonnen. Die Patientin erhielt insgesamt vier wöchentliche Dosen Eculizumab (900 mg) und begann sich schnell zu erholen. Nach ihrer dritten Hämodialyse am sechsten postpartalen Tag benötigte sie keine weitere Hämodialyse (Abbildung 2). Die Nierenfunktion wurde allmählich korrigiert, die Thrombozytenzahl erhöht und die Hämolyse behoben. Vier Wochen nach der Geburt wurden die Plasmaspiegel von C3 und C4 normalisiert.
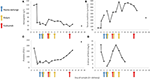
Abbildung 2. Ausgewählte Laborwerte, die in den frühen Stadien der Krankheit und zum Zeitpunkt des Plasmaaustauschs, der Hämodialyse und der Verabreichung von Eculizumab beobachtet wurden. In Tafel (A) ist die Entwicklung von Bluthämoglobinmessungen dargestellt, in Tafel (B) der Serumkreatininspiegel, in Tafel (C) die Anzahl der Blutplättchen und in Tafel (D) das D-Dimer der Fibrinwerte über den 17. Tag Nachbeobachtungszeit.
Bei Gentests wurden keine bekannten Genpolymorphismen identifiziert. Sie wurde auf Mutationen in den Komplementregulatoren Faktor H (CFH), Faktor H-verwandtem Protein 5 (FHR5) und Membran-Co-Faktor-Protein (MCP), Komplement-Inaktivatorfaktor I (CFI) und Aktivatorfaktor B (CFB) getestet ) und die folgenden Komponenten der Gerinnungskaskade: ADAMTS13, Thrombomodulin (THBD) und ein intrazelluläres Enzym, Diacylglycerinkinase E (DGKE), deren Mutationen eine bekannte Ursache für aHUS sind (14). Darüber hinaus wurden auch keine Antikörper gegen Faktor H nachgewiesen. Es wurde kein C4-Mangel festgestellt.
Zusammenfassend hatte unser Patient eine schwere Präeklampsie und erfüllte die diagnostischen Kriterien für das HELLP-Syndrom. Obwohl die Gentests auf aHUS negativ blieben, deuteten der klinische Krankheitsverlauf (insbesondere schwere akute Nierenverletzung) und das Ansprechen auf die Behandlung (insbesondere Eculizumab) darauf hin, dass unsere Patientin schwangerschaftsinduziertes aHUS hatte.
Diskussion
Bei der oben beschriebenen Primigravida wurde eine schwere Präeklampsie, ein HELLP-Syndrom und ein schwangerschaftsinduzierter aHUS diagnostiziert. Es wurden keine bekannten Genmutationen entdeckt, die für aHUS prädisponieren könnten. Die Differentialdiagnose zwischen TMA-, TTP-, HUS / aHUS- und sekundären TMA-Typen wie dem HELLP-Syndrom ist wichtig. Insbesondere TTP muss frühzeitig identifiziert werden, da die Krankheit bis zur Remission mit einem schnellen täglichen Plasmaaustausch behandelt wird (15).
Derzeit können Laboranalysemethoden zum Testen genetischer Mutationen, die möglicherweise aHUS verursachen, Mutationen in zeigen nur bis zu 40–60% der aHUS-Fälle, so dass die Möglichkeit falsch negativer Fälle besteht. Ein negatives Testergebnis für Mutationen schließt daher einen echten aHUS nicht aus (16).Selten wurde aHUS nach Schwangerschaft und Geburt induziert. In diesen Fällen entwickelten ~ 50% in den folgenden drei Jahren eine chronische Nierenerkrankung (CKD), einige sogar eine Nierenerkrankung im Endstadium (ESKD). Wenn genetische Mutationen beobachtet wurden, können bis zu 85% CKD oder ESKD entwickeln (17).
Es ist allgemein anerkannt, dass bei hypertensiven Schwangerschaftsstörungen eine Plazentaentzündung zu einer endothelialen Dysfunktion führt. Wenn die Integrität des Endothels gestört ist, führt dies zur Aktivierung des Komplements und zur Gerinnung (18). Es wurde auch angenommen, dass ein gestörtes mütterliches Endothel zur späteren Morbidität der Mutter im Zusammenhang mit schwerer Präeklampsie und anderen hypertensiven Schwangerschaftsstörungen beiträgt (2, 19). Es wurde gezeigt, dass beschädigtes Endothel auch Jahre nach Abklingen der anfänglichen diagnostischen Symptome abnormal funktioniert (20–23).
Bei bis zu 46% der HELLP-Patienten wurden Genmutationen in den Regulatoren des alternativen Signalwegs beschrieben des Komplementsystems (24, 25). In den frühen Stadien der Schwangerschaft, wenn sich die Plazenta entwickelt, wird bei Patienten, die später eine Präeklampsie entwickelten, eine Aktivierung des Komplementsystems in erhöhten Bb-Spiegeln im Serum beobachtet (26). Bei schwerer Präeklampsie und HELLP-Syndrom wurde eine Aktivierung des Komplementsystems beobachtet, und bei Patienten mit schwerer Präeklampsie wurden im Urin erhöhte Spiegel an terminalem Komplex (C5b-9) festgestellt. Bei Patienten mit HELLP-Syndrom wurde eine erhöhte Aktivierung des Komplementsystems durch Funktionstests und darüber hinaus durch Expressionsmängel bei CD55 und CD59 gezeigt, was zu einer verminderten Regulation und einer verstärkten Aktivierung des Komplementsystems führte (27–29).
Es gibt viele Gemeinsamkeiten zwischen dem HELLP-Syndrom und aHUS. In beiden Fällen ist eindeutig eine Endothelstörung beteiligt, gefolgt von einer Komplement- und Gerinnungsaktivierung. Bei schwerer Präeklampsie und HELLP-Syndrom wäre Eculizumab, das bei den ersten Anzeichen einer schweren Erkrankung und TMA verabreicht wird, für den Schutz der Nieren und des mütterlichen Endothels von Vorteil (30). Die Wahrung der Endothelintegrität kann den Patienten möglicherweise vor langfristigen Gesundheitsrisiken wie Herz-Kreislauf-Erkrankungen schützen. Typischerweise klingen bei schwangerschaftsbedingten TMAs die klinischen Befunde der Hämolyse und der Thrombozytopenie innerhalb von ~ 3 Tagen ab. Wenn die Krankheitsaktivität länger anhält, muss die Differentialdiagnostik fortgesetzt werden, und erst dann wird eine alternative Behandlung (z. B. Eculizumab) in Betracht gezogen. Eine frühere Einführung der Eculizumab-Behandlung würde Frauen zugute kommen, indem Nierenschäden verhindert und die Turbulenzen im Endothel und systemische Entzündungen minimiert werden. Eculizumab, das früh genug und mit nur einer oder zwei Dosen verabreicht wird, könnte möglicherweise ausreichen, um die Turbulenzen zu stoppen und um die Ereigniskaskade zu stoppen (31). Einerseits ist Eculizumab ein sehr teures Medikament, andererseits bleiben die Kosten für Intensivbehandlung, Plasmaaustausch, Hämodialyse, mögliche Nierentransplantation und die emotionalen Folgen für Mütter und Familien unschätzbar.
Zusammenfassend war unser Patient schwer krank und litt unter Hämolyse, Gerinnungsstörungen, Leberschäden und Nierenversagen, die eine Aufnahme auf die Intensivstation und eine Hämodialyse erforderten. Es ist möglich, dass Eculizumab, wenn es bei den ersten Anzeichen eines HELLP-Syndroms früher eingeleitet wird, im späteren Krankheitsverlauf von Vorteil ist, möglicherweise die Nierenverletzung lindert und somit die Notwendigkeit einer Hämodialyse und einer späteren CNI verhindert. Könnten wir in dieser Ära der modernen immunologischen Medizin mehr für die Mütter und Familien tun, als nur zu warten und auf das Beste zu hoffen?
Ethikerklärung
Eine ethische Überprüfung und Genehmigung war dies nicht erforderlich für die Studie an menschlichen Teilnehmern in Übereinstimmung mit den lokalen Gesetzen und institutionellen Anforderungen. Die Patienten / Teilnehmer gaben ihre schriftliche Einverständniserklärung zur Teilnahme an dieser Studie ab.
Autorenbeiträge
AL und JH-E entwickelten die Idee zum Manuskript und verfassten das Manuskript. JH-E und MH waren an der diagnostischen und therapeutischen Versorgung des Patienten beteiligt. Alle Autoren haben das Manuskript geprüft und bearbeitet und seine endgültige Fassung zur Veröffentlichung freigegeben.
Interessenkonflikt
Die Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde könnte als potenzieller Interessenkonflikt ausgelegt werden.
4. Hauspurg A, Ying W, Hubel CA, Michos ED, Ouyang P. Unerwünschte Schwangerschaftsergebnisse und zukünftige kardiovaskuläre Erkrankungen der Mutter. Clin Cardiol. (2018) 41: 239–46. doi: 10.1002 / clc.22887
PubMed Abstract | CrossRef Volltext | Google Scholar
5. Brosens I, Pijnenborg R, Vercruysse L, Romero R. große geburtshilfliche Syndrome “sind mit Störungen der tiefen Plazentation verbunden. Am J Obstet Gynecol. (2011) 204: 193–201. doi: 10.1016 / j.ajog.2010.08.009
PubMed Abstract | CrossRef Volltext | Google Scholar
8. Germain SJ, Sacks GP, Soorana SR, Sargent IL, Redman CW . Systemisches entzündliches Priming bei normaler Schwangerschaft und Präeklampsie: die Rolle von zirkulierenden Syncytiotrophoblasten-Mikropartikeln. J Immunol. (2007) 178: 5949–56. doi: 10.4049 / jimmunol.178.9.5949
PubMed Abstract | CrossRef Volltext | Google Scholar
9. Tannetta D, Masliukaite I, Vatish M, Redman C, Sargent I. Aktualisierung von extrazellulären Vesikeln aus Syncytiotrophoblasten bei normaler Schwangerschaft und Präeklampsie. J Reprod Immunol. (2017) 119: 98–106. doi: 10.1016 / j.jri.2016.08.008
PubMed Abstract | CrossRef Volltext | Google Scholar
10. Weinstein L. Syndrom der Hämolyse, erhöhte Leberenzyme und niedrige Blutplättchen Anzahl: eine schwere Folge von Bluthochdruck in der Schwangerschaft. Am J Obstet Gynecol. (1982) 142: 159–67. doi: 10.1016 / S0002-9378 (16) 32330-4
PubMed Abstract | CrossRef Volltext | Google Scholar
15. Pourrat O, Coudroy R, Pierre F. Unterscheidung zwischen schwerem HELLP-Syndrom und thrombotische Mikroangiopathie, thrombotische thrombozytopenische Purpura und andere Nachahmer. Eur J Obstet Gynecol Reprod Biol. (2015) 189: 68–72. doi: 10.1016 / j.ejogrb.2015.03.017
PubMed Abstract | CrossRef Volltext | Google Scholar
20. Agatisa PK, Ness RB, Roberts JM, Costantino JP, Kuller LH , McLaughlin MK. Beeinträchtigung der Endothelfunktion bei Frauen mit Präeklampsie in der Vorgeschichte: ein Indikator für das kardiovaskuläre Risiko. Am J Physiol Hear Circ Physiol. (2004) 286: 1–3. doi: 10.1152 / ajpheart.00298.2003
PubMed Abstract | CrossRef Volltext | Google Scholar
22. Kvehaugen AS, Dechend R., Ramstad HB, Troisi R., Fugelseth D. , Mitarbeiter AC. Endothelfunktion und zirkulierende Biomarker sind bei Frauen und Kindern nach Präeklampsie gestört. Hypertonie. (2011) 58: 63–9. doi: 10.1161 / HYPERTENSIONAHA.111.172387
PubMed Abstract | CrossRef Volltext | Google Scholar
23. Stanhewicz AE. Restliche vaskuläre Dysfunktion bei Frauen mit Präeklampsie in der Vorgeschichte. Am J Physiol Regul Integr Comp Physiol. (2018) 315: R1062 – R71. doi: 10.1152 / ajpregu.00204.2018
PubMed Abstract | CrossRef Volltext | Google Scholar
25. Vaught AJ, EM Braunstein, Jasem J, Yuan X, Makhlin I. Eloundou S. et al. Keimbahnmutationen im alternativen Komplementweg prädisponieren für das HELLP-Syndrom. JCI Einblick. (2018) 3: 0–13. doi: 10.1172 / jci.insight.99128
PubMed Abstract | CrossRef Volltext | Google Scholar
31. Elabd H., Elkholi M., Steinberg L., Acharya A. Eculizumab, Eine neuartige potenzielle Behandlung für akute Nierenverletzungen im Zusammenhang mit Präeklampsie / HELLP-Syndrom. BMJ Case Rep. (2019) 12: e228709. doi: 10.1136 / bcr-2018-228709
PubMed Abstract | CrossRef Volltext | Google Scholar