Grenzen der Pharmakologie
Einführung
Sanddorn ist ein Mitglied der Elaeagnaceae. Es wird derzeit im Produktionsmaßstab hauptsächlich in Russland und China sowie in einer wachsenden Anzahl von Sorten auf der ganzen Welt (dh in Finnland, Deutschland und Estland) angebaut.
Sowohl in vitro als auch bei Menschen und Tieren In-vivo-Studien an Sanddorn haben eine Reihe bioaktiver Chemikalien in seinen Blättern, Wurzeln, Samen und Beeren gefunden, die als Seebeere oder sibirische Ananas bekannt sind, sowie das daraus gewonnene Öl. Diese Verbindungen zeigen ein breites Spektrum an entzündungshemmenden, krebserregenden, antioxidativen und anti-atherosklerotischen Aktivitäten (Zeb, 2006; Basu et al., 2007; Kumar et al., 2011; Suryakumar und Gupta, 2011; Xu et al., 2011; Christaki, 2012; Teleszko et al., 2015; Olas, 2016; Ulanowska et al., Im Druck). Einige Spurenelemente und Vitamine (insbesondere A, C und E), Lipide, Carotinoide, Aminosäuren, ungesättigte Fettsäuren und Phenolverbindungen, die in den Beeren gefunden werden, sind in Tabelle 1 aufgeführt (Olas, 2016; Gradt et al., 2017; Ulanowska et al., Im Druck). Ihre Konzentration in den Beeren hängt vom Klima, der Größe, der Reife der Pflanze und dem Verfahren zur Verarbeitung und Lagerung des Pflanzenmaterials ab (Fatima et al., 2012; Malinowska und Olas, 2016). Gao et al. (2000) berichten über Veränderungen der antioxidativen Eigenschaften sowie anderer Arten der biologischen Aktivität von Sanddornbeeren während der Reifung, die stark mit dem Gehalt an Gesamtphenolverbindungen und Ascorbinsäure korrelierten. Darüber hinaus nahm die antioxidative Aktivität des lipophilen Extrakts signifikant zu und entsprach dem Anstieg des Gesamtcarotinoidgehalts.
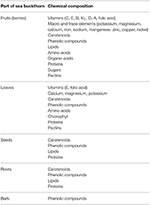
Tabelle 1. Die chemische Zusammensetzung einzelner Teile des Sanddorns (44; modifiziert).
Eine Fülle gesunder Zutaten findet sich nicht nur in den rohen Früchten, sondern auch in einer Vielzahl von Zubereitungen wie Marmeladen, Säften, Marmeladen oder Tinkturen. Sanddornbeeren können auch zur Herstellung von Kuchen und Likören verwendet werden (Li und Hu, 2015). Hu (2005) berichtet, dass Sanddornsamen zur Herstellung von Öl und die Blätter zur Herstellung von Tee verwendet werden können. Während aus den Samen hergestellte Tees abführende Eigenschaften haben und beim Abnehmen helfen, haben Infusionen der Blätter antidiarrhoische Eigenschaften; Darüber hinaus stärken Früchtetees das Immunsystem und zeigen Aktivität gegen Hautkrankheiten (Frohne, 2010; Sarwa, 2001).
Die positiven und einzigartigen Eigenschaften von Sanddorn sind seit mindestens dem VII. Jahrhundert bekannt BC (Suryakumar und Gupta, 2011; Li und Hu, 2015). Die Pflanze wurde nicht nur in der Naturmedizin, sondern auch in der Veterinärmedizin eingesetzt, um die Helminthiasis bei Pferden zu lindern und ihnen mehr Masse und ein schönes, glänzendes Fell zu verleihen. Derzeit werden seine Produkte in vielen Branchen eingesetzt, insbesondere in der Pharma-, Kosmetik- und Lebensmittelindustrie, aber auch als dekoratives Element, als Brennholz oder sogar als Werkzeug für die Sanierung degradierter Gebiete. Historischen Aufzeichnungen zufolge wurde Sanddorn erstmals in China als Medikament verwendet, und in der Neuzeit wurde die Pflanze 1977 offiziell im chinesischen Arzneibuch aufgeführt (Kommission für das Arzneibuch der VR China, 1977).
Moderne Studien haben gezeigt, dass die Teile des Sanddorns als natürliche Heilmittel gegen Herz-Kreislauf-Erkrankungen sowie gegen Haut-, Leber- und Magenerkrankungen dienen können. Das therapeutische Potenzial seiner bioaktiven Verbindungen ist in Tabelle 2 dargestellt. Dieser Übersichtsartikel fasst das aktuelle Wissen über die verschiedenen Sanddornorgane zusammen und erörtert, ob sie ein „goldenes Mittel“ für die Behandlung von Krebs darstellen können. Es ist wichtig zu beachten dass die Quellinformationen für dieses Papier nicht nur von In-vitro-Modellen, sondern auch von In-vivo-Modellen abgeleitet sind.
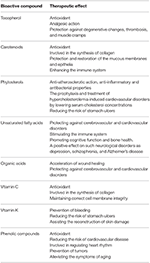
Tabelle 2. Bioaktive Sanddornverbindungen und ihre therapeutischen Wirkungen (44; modifiziert).
Antikrebsaktivität von Sanddorn
Es wurde festgestellt, dass eine Reihe von Phytopharmazeutika, insbesondere solche phenolischen Verbindungen wie Proanthocyanidine, Curcumin und Resveratrol, signifikante Vorteile bei der Krebschemoprävention bieten (Barrett, 1993; Bagchi und Preuss, 2004; Bagchi et al., 2014; Shanmugam et al., 2015; Ko et al., 2017) und Strahlentherapie (Cetin et al., 2008). Es ist gut dokumentiert Es wurde darauf hingewiesen, dass eine höhere Aufnahme von Phenolverbindungen über die Nahrung, insbesondere von Procyanidinen und Flavonoiden, mit einem geringeren Krebsrisiko verbunden ist (Barrett, 1993; Bagchi und Preuß, 2004; Duthie et al., 2006; Zafra-Stone et al., 2007; Cetin et al., 2008; Seeram, 2008; Bagchi et al., 2014; Chen et al., 2014; Wang et al., 2014; Giampieri et al., 2016; Kristo et al., 2016).Sanddorn besitzt eine breite Palette von biologischen und pharmakologischen Aktivitäten, einschließlich Antikrebseigenschaften. Obwohl die ihnen zugrunde liegenden molekularen Mechanismen unklar bleiben, ist bekannt, dass diese Verbindungen in verschiedenen Organen und ihren Produkten vorhanden sind, insbesondere in Saft und Öl (Xu et al., 2011). Die Antitumoraktivität von Sanddorn kann auf antioxidative Verbindungen zurückgeführt werden, insbesondere auf phenolische Verbindungen wie Flavonoide, einschließlich Kaempferol, Quercetin und Isorhamnetin; Diese schützen Zellen vor oxidativen Schäden, die zu genetischen Mutationen und Krebs führen können (Christaki, 2012).
In-Vitro-Studien
Verschiedene In-vitro-Studien haben gezeigt, dass Sanddorn eine Antikrebsaktivität aufweist . Zum Beispiel haben Zhang et al. (2005) untersuchten Veränderungen in der Expression von Apoptose-verwandten Genen in der menschlichen Brustkarzinom-Zelllinie Bcap-37, die durch Flavonoide aus Sanddornsamen induziert wurden. Ihre bioinformatische Analyse ergab, dass die Expression von 32 analysierten Genen, einschließlich CTNNB1, IGFBP4, GADD34 und Caspase 3, die mit der Apoptose von Bcap-37-Zellen assoziiert sind, durch Flavonoidbehandlung beeinflusst wurde.
Teng et al. (2006) fanden heraus, dass Isorhamnetin (3′-Methoxy-3,4’5,7-tetrahydroxylflavon; ein aus Sanddorn isoliertes Flavonoid) zytotoxische Wirkungen gegen humane hepatozelluläre Karzinomzellen (BEL-7402) mit einem IC50 von etwa hat 75 μg / ml nach 72-stündiger Behandlung. Li et al. (2015) fanden auch, dass Isorhamnetin in vitro bei Anwendung in Konzentrationen von 10 bis 320 μg / ml und in vivo bei C57BL / 6-Mäusen bei oraler Verabreichung (50 mg / kg / Tag) eine Anti-Proliferationswirkung auf Lungenkrebszellen hat. für 7 Tage. Die Autoren schlagen vor, dass der Mechanismus der Isorhamnetin-Wirkung die Apoptose von Zellen beinhalten könnte, die durch die Herunterregulierung von Onkogenen und die Hochregulierung von apoptotischen Genen induziert wird. Andere Beobachtungen zeigten, dass Isorhamnetin die Proliferation von Zellen aus den menschlichen Darmkrebszelllinien (HT-29, HCT 116 und SW480) unterdrückt, einen Zellzyklusstillstand in der G2 / M-Phase induziert und die Zellproliferation durch Hemmung des PI3K-Akt unterdrückt -mTOR-Pfad. Darüber hinaus reduzierte Isorhamnetin die Phosphorylierungsniveaus von Akt (Ser473), Phosph-p70S6-Kinase und Phosph-4E-BP1 (t37 / 46) -Protein und erhöhte die Expression von Cyclin B1-Protein bei Konzentrationen von 20 und 40 μM (Li et al., 2014).
In einer Studie an menschlichen MDA-MB-231-Brustkrebszellen haben Wang et al. (2014) stellten fest, dass Sanddorn-Procyanidine, die aus den Samen isoliert wurden, hemmende Wirkungen auf die Fettsäuresynthase (FAS) haben: ein Schlüsselenzym für die De-novo-Biosynthese langkettiger Fettsäuren, von denen hohe Konzentrationen in Krebszellen gefunden werden. Diese Hemmung war bei Konzentrationen im Bereich von 0 bis 0,14 μg / ml dosisabhängig. Eine Konzentration von 0,087 & mgr; g / ml inhibierte 50% der FAS-Aktivität. Darüber hinaus wurde das Zellwachstum durch Behandlung mit Sanddorn-Procyanidinen in Konzentrationen zwischen 10 und 60 μg / ml unterdrückt. Zusätzlich wurde festgestellt, dass die getesteten Procyanidine dosisabhängig die Zellapoptose induzieren. Die Autoren schlagen vor, dass diese Procyanidine die MDA-MB-231-Zellapoptose induzieren können, indem sie die intrazelluläre FAS-Aktivität hemmen. Olsson et al. (2004) verglichen die Wirkung von 10 verschiedenen Extrakten von Früchten und Beeren, einschließlich Sanddornbeeren, auf die Proliferation von HT29-Semikolonkrebszellen und MCF-7-Brustkrebszellen. Sie beobachteten, dass Sanddorn bei seinen beiden höchsten verabreichten Konzentrationen (0,25 und 0,5%) die höchste Hemmwirkung auf die Proliferation von HT29- und MCF-7-Zellen hatte. Die Autoren schlagen vor, dass die Hemmung der Proliferation von Krebszellen mit den Konzentrationen von Carotinoiden und Vitamin C korreliert. Darüber hinaus schlagen sie das Vorhandensein einer synergistischen Wirkung zwischen Carotinoiden, Vitamin C und Anthocyanen vor. Darüber hinaus haben McDougall et al. (2008) stellen fest, dass Sanddornbeerenextrakt eine leicht antiproliferative Wirkung gegen in vitro gezüchtete Gebärmutterhals- und Semikolonkrebszellen besitzt.
Boivin et al. (2007) bestimmten die antiproliferative Aktivität der Säfte von 13 Beerenarten, einschließlich Sanddorn, in Konzentrationen von 10–50 μg / ml gegen fünf Krebszelllinien in vitro: AGS – Magenadenokarzinom, ACF-7 – Brustdrüsenadenokarzinom, PC-3 – Prostataadenokarzinom, Caco-2 – kolorektales Adenokarzinom und MDA-MB-231 – Brustdrüsenadenokarzinom. Es wurde festgestellt, dass Sanddorn-Beerensaft wie Brombeer- und schwarze Apfelbeersäfte antiproliferative Eigenschaften hatte. Es wurde jedoch keine Korrelation zwischen den antiproliferativen Eigenschaften der Beerensäfte und ihrer antioxidativen Kapazität gefunden, und die Hemmung der Proliferation von Krebszellen durch die Säfte beinhaltete keine Caspase-abhängige Apoptose. Trotzdem wurde eine Unterdrückung der durch Tumornekrosefaktor (TNF) induzierten Aktivierung des Kernfaktor-Kappa-Leichtketten-Enhancers von aktivierten B-Zellen (NF & kgr; B) beobachtet. Kürzlich haben Guo et al.(2017) untersuchten die phytochemische Zusammensetzung der Beeren von vier verschiedenen Unterarten von Sanddorn sowie ihre antioxidativen und antiproliferativen Eigenschaften gegen menschliche HepG2-Leberkrebszellen in vitro: H. rhamnoides L. subsp. sinensis (Sinensis), H. rhamnoides L. subsp. Yunnanensis (Yunnanensis), H. rhamnoides L. subsp. Mongolica (Mongolica) und H. rhamnoides L. subsp. turkestanica (Turkestanica). Von diesen Unterarten ist H. rhamnoides L. subsp. sinensis zeigte den höchsten Gesamtphenolgehalt und die entsprechende Gesamtantioxidationsaktivität, während die größten zellulären Antioxidations- und antiproliferativen Eigenschaften bei H. rhamnoides L. subsp. yunnanensis. Diese Eigenschaften wurden auf die Wirkung von Phenolsäuren und Flavonoidaglykonen zurückgeführt. Zhamanbaeva et al. (2014) untersuchten die Auswirkungen von Ethanolextrakt aus Sanddornblättern auf das Wachstum und die Differenzierung menschlicher akuter myeloischer Leukämiezellen (KG-1a, HL60 und U937). Obwohl festgestellt wurde, dass ein Pflanzenextrakt das Zellwachstum je nach Zellstamm und Extraktdosis hemmt, identifiziert die Studie den chemischen Gehalt des getesteten Extrakts nicht. Sie verwendeten drei Konzentrationen des Extrakts: 25, 50 und 100 μg / ml. Die Ergebnisse legen nahe, dass die antiproliferative Wirkung von Sanddorn-Extrakt auf akute myeloische Leukämiezellen teilweise durch Aktivierung des S-Phasen-Checkpoints bestimmt wurde, was wahrscheinlich zu einer Verlangsamung des Zellzyklus und zur Induktion von Apoptose führte.
Anderswo, Zhamanbayeva et al. (2016) untersuchten die antiproliferative und differenzierungsfördernde Aktivität verschiedener Pflanzenextrakte (10–100 μg / ml), einschließlich Wasser-Ethanol-Extrakt aus Sanddornblättern: Es wurde ein Gesamtpolyphenolgehalt von ca. 46 mg GA-Äquivalent festgestellt / g getrockneter Extrakt, Gesamtflavonoidgehalt von ungefähr 23 mg Quercetinäquivalent / g getrockneter Extrakt. Die Autoren beobachteten, dass die getesteten Extrakte, einschließlich Sanddorn-Extrakt, das Wachstum und die Lebensfähigkeit von akuten myeloischen Leukämiezellen verringerten; Darüber hinaus potenzierten sie bei nicht zytotoxischen Dosen auch die durch eine niedrige Konzentration von 1α, 25-Dihydroxyvitamin D3 induzierte Zelldifferenzierung in Abhängigkeit vom Zelltyp. Darüber hinaus hemmten die getesteten Extrakte die mikrosomale Lipidperoxidation stark und schützten normale Erythrozyten vor hypoosmotischem Schock.
Eine kürzlich durchgeführte Studie von Kim et al. (2017) schlägt vor, dass Sanddornblattextrakt, der etwa 70 mg / g Phenolverbindungen und etwa 460 μg / g Catechin enthält, die schnelle Proliferation von Ratten-C6-Gliomzellen hemmen kann, wenn er mit 0,62, 6,2 und 62 μg / ml verabreicht wird. wahrscheinlich durch Induzieren der frühen Ereignisse der Apoptose. Die Autoren schlagen auch vor, dass die Verringerung der Proliferation und Lebensfähigkeit von C6-Gliomzellen nach Verabreichung des Pflanzenextrakts mit einer Verringerung der Produktion reaktiver Sauerstoffspezies einherging, die für die Proliferation von Tumorzellen kritisch sind. Darüber hinaus regulierte Sanddorn nicht nur die Expression des proapoptotischen Proteins Bcl-2-assoziiertes X (Bax), sondern förderte auch dessen Lokalisierung im Kern. Verschiedene Studien berichten, dass Sanddornöl auch besitzt Antitumor-Eigenschaften. Dieses Öl kann in Kapseln, Gelatine und orale Flüssigkeiten eingearbeitet werden (Yang und Kallio, 2002). Darüber hinaus berichten Toxizitätsstudien über keine nachteiligen Auswirkungen bei Probanden, denen Sanddornöl verabreicht wurde (Upadhyay et al., 2009). Kumar et al. (2011) weisen darauf hin, dass Sanddornöl eine wichtige Rolle in der Krebstherapie spielt, einschließlich Chemotherapie und Strahlentherapie, und dass die Einnahme von Sanddornöl dazu beitragen kann, vielen Nebenwirkungen oder Behandlungen entgegenzuwirken, die Nieren- und Leberfunktion wiederherzustellen, den Appetit zu steigern und die Patienten im Allgemeinen zu halten gute Gesundheit. Wang et al. (1989) beobachteten, dass Samenöl das Tumorwachstum um 3–50% verzögerte. Zhang et al. (Zhang, 1989) zeigten, dass die Injektion von Samenöl (1,59 g / kg Körpergewicht) die Wachstumsrate von transplantierten Melanom- (B16) und Sarkomtumoren (S180) bei Mäusen signifikant inhibierte. Wu et al. (1989) führen die Schutzwirkung von Sanddornsamenöl gegen Gebärmutterhalskrebs auf das Vorhandensein der Vitamine A und E zurück. Schließlich haben Sun et al. (2003) stellen fest, dass Flavonoide aus Öl, das aus Sanddornsamen extrahiert wurde, eine hemmende Wirkung auf die Leberkrebszelllinie BEL-7402 ausüben, indem sie Apoptose induzieren.
Die Samen und Beerenpulpe von Sanddorn enthalten verschiedene andere bioaktive Verbindungen einschließlich ungesättigter Fettsäuren und Phytosterole. Es ist bekannt, dass ungesättigte Fettsäuren einen multidirektionalen Einfluss auf die menschliche Gesundheit haben, indem sie beispielsweise das Immunsystem stimulieren. Darüber hinaus haben Phytosterole Antikrebseigenschaften (Sajfratova et al., 2010; Dulf, 2012). Weitere Einzelheiten zur Zusammensetzung und zu den gesundheitsfördernden Aspekten von Sanddornöl liefert Olas (2018). Die Wirkung von Sanddorn auf Krebszellen in verschiedenen In-vitro-Modellen ist in Tabelle 3 beschrieben.

Tabelle 3.Die Wirkung von Sanddorn auf Krebszellen in In-vitro-Modellen.
In-vivo-Studien
Sanddorn Es wurde festgestellt, dass es sowohl in In-vitro- als auch in-vivo-Studien an Tiermodellen Antikrebseigenschaften aufweist. Eine Studie über die chemopräventive Wirkung von Sanddornfrüchten von Padmavathi et al. (2005) fanden heraus, dass sie die Dimethylobenzenoantracen-induzierte Hautpapillomagenese bei Mäusen hemmen. Die Autoren schlagen vor, dass die Hemmung der Karzinogenese auf die gleichzeitige Induktion von Phase-II-Enzymen, d. H. Glutathion-S-Transferase, Glutathionperoxidase, Katalase, Superoxiddismutase und Glutathionreduktase in der Mausleber, zurückgeführt werden kann. Darüber hinaus schlagen die Autoren vor, dass die Antikrebswirkung von Sanddornfrüchten auf der Verstärkung der DNA-Bindungsaktivität von Interferon-Regulationsfaktor 1 (IRF-1) beruhen könnte, einem bekannten antionkogenen Transkriptionsfaktor, der Wachstumsunterdrückung und Apoptose verursacht / p>
Nersesyan und Muradyan (2004) berichten, dass Sanddornsaft Mäuse vor der genotoxischen Wirkung von Cisplatin schützt: einem bekannten Krebsmedikament, das auch für normale Zellen sehr toxisch ist. Sanddornsaft (300 ml), der ex tempore hergestellt wurde, wurde Mäusen über einen Zeitraum von 5 oder 10 Tagen per Sonde verabreicht. 3 h nach der letzten Sonde erhielten die Mäuse Cisplatin in Konzentrationen von 1,2 oder 2,4 mg / kg. Yasukawa et al. (2009) fanden in einem zweistufigen In-vivo-Karzinogenese-Test mit zwei Gruppen von 15 Mäusen, dass 70% iger Ethanolextrakt aus Sanddornzweigen (1 mg Pflanzenextrakt / Maus) Antitumoreigenschaften aufweist; 7,12-Dimethylbenzanthracen als Indikator und 12-O-Tetracecanoylphorbol-13-acetat als Promotor. Von den drei Phenolverbindungen (Catechin, Gallocatechin und Epigallocatechin) und der aus dem Extrakt isolierten Triterpenoidursolsäure erwiesen sich Epigallocatechin und Ursolsäure als die aktivsten. Wang et al. (2015) fanden heraus, dass nicht nur die Phenolverbindungen oder Phenolextrakte / Fraktionen von Sanddorn Antikrebseigenschaften aufweisen: HRWP-A, ein wasserlösliches homogenes Polysaccharid mit sich wiederholenden Einheiten von (1 → 4) -β-D-Galactopyranosyluronsäureresten, von die 85,2% mit Methylgruppen verestert sind, zeigt auch in vivo Antikrebs- und immunstimulierende Aktivitäten. Ein Antitumoraktivitätsassay zeigte, dass HRWP-A das Wachstum des Lewis-Lungenkarzinoms (LLC) in tumortragenden Mäusen signifikant hemmen kann. Zusätzlich verstärkte diese Verbindung die Lymphozytenproliferation, erhöhte die Makrophagenaktivitäten und förderte die Aktivität natürlicher Killerzellen in tumortragenden Mäusen. Die Autoren verwendeten drei verschiedene Dosen von Polysaccharid (50, 100 und 200 mg / kg), die 14 Tage lang jeden Tag intragastrisch verabreicht wurden.
Strahlenschutzfähigkeit von Sanddorn
Due Sanddorn ist aufgrund seines hohen Gehalts an biologisch aktiven Verbindungen und Antioxidantien aufgrund seiner Strahlenschutzaktivität in der Krebstherapie enthalten, was in einer Reihe von Studien von Goel et al. (2002, 2003a, b, 2004, 2005). Agrawala und Goel (2002) stellten fest, dass der gesamte Extrakt aus frischen Sanddornbeeren schützende Eigenschaften aufweist (H. rhamnoides – RH-3; 25–35 mg / kg Körpergewicht), insbesondere für strahleninduzierte Mikrokerne im Knochenmark von Mäusen. Darüber hinaus haben Goel et al. (2002) fanden heraus, dass RH-3 die Fenton-Reaktion und die strahlenvermittelte Produktion von Hydroxylradikalen in vitro inhibierte.
Kumar et al. (2002) berichten, dass RH-3 DNA-Strangbrüche, die durch Strahlung und tertiäres Butylhydroperoxid induziert wurden, dosisabhängig inhibierte, wie durch den Comet-Assay gezeigt wurde. Sie stellen auch eine starke Verdichtung von Chromatin fest, die bei Konzentrationen von 100 und 120 pg / ml RH-3 und darüber auftritt, wodurch die Kerne selbst bei einer Dosis von 1000 Gy strahlenresistent wurden. Goel et al. (2003a) berichten über den Schutz von Jejunalkrypten durch RH-3 gegen tödliche Ganzkörper-Gammabestrahlung (10 Gy), und dass die Caspase-3-Aktivität bei Mäusen, denen RH-3 vor der Bestrahlung verabreicht wurde, im Vergleich zu bestrahlten Kontrollen ebenfalls signifikant geringer war. Interessanterweise induzierte eine Strahlenschutzdosis von RH-3 (30 mg / kg Körpergewicht) eine signifikante DNA-Fragmentierung (spektrofluorimetrisch untersucht) in Thymozyten bei Mäusen in vivo. Darüber hinaus wurde festgestellt, dass eine Sanddornbehandlung vor der Bestrahlung die strahleninduzierte Apoptose in vivo verstärkt (Goel et al., 2004). Goel et al. (2005) schlagen auch vor, dass die Vorbestrahlungsbehandlung von Mäusen mit 30 mg / kg Sanddornbeerenextrakt die Funktionsintegrität von Mitochondrien vor strahleninduziertem oxidativem Stress schützt. Diese Experimente untersuchten die Spiegel verschiedener Biomarker für oxidativen Stress, einschließlich Superoxidanion, Lipidperoxidation und Proteinoxidation. Interessanterweise wurde festgestellt, dass RH-3 immunstimulatorische Eigenschaften aufweist, die eine wichtige Rolle für seine Strahlenschutzwirkung spielen können (Prakash et al., 2005).
Schlussfolgerung
Obwohl viele Studien die Antikrebsaktivität von Sanddorn bestätigt haben, sind seine medizinischen und prophylaktischen Dosen unbekannt, und es wurden noch keine klinischen Studien durchgeführt: nur in vitro oder in vivo Studien mit Versuchstieren. Es ist bekannt, dass Sanddorn an der Prävention und Behandlung von Krebs beteiligt sein kann. Es beschleunigt auch die Wiederherstellung der Gesundheit von Patienten, die eine Chemotherapie erhalten, indem es die Leistung des Immunsystems signifikant verbessert und hämatologische Schäden lindert.
Der hypothetische Mechanismus, durch den Sanddorn seine chemopräventiven und therapeutischen Reaktionen gegen Krebs ausüben kann, wird vorgestellt in Abbildung 1. Die bioaktiven Substanzen in verschiedenen Teilen des Sanddorns haben eine Reihe von Eigenschaften, einschließlich antioxidativer, entzündungshemmender und antiproliferativer Aktivitäten; Sie induzieren auch Apoptose und stärken das Immunsystem. Die molekularen Mechanismen bleiben jedoch unklar. Bevor Sanddorn als „goldenes Mittel“ für die Behandlung von Krebs angesehen werden kann, müssen daher weitere Untersuchungen in einer Reihe hochwertiger Studien durchgeführt werden.
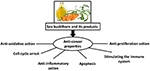
Abbildung 1. Hypothetische Wirkmechanismen, durch die Sanddorn chemopräventive und therapeutische Reaktionen gegen Krebs hervorrufen kann.
Autorenbeiträge
Alle aufgeführten Autoren (BO, BS, KU) haben einen wesentlichen, direkten und intellektuellen Beitrag zur Arbeit geleistet und diese genehmigt Veröffentlichung.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Der Gutachter BW und der Bearbeiter haben ihre gemeinsame Zugehörigkeit erklärt.
Danksagung
Diese Arbeit wurde vom National Science Center, Polen 2015/19 / B / NZ9 / 03164 unterstützt .
Abkürzung ns
Bagchi, D. und Preuss, H. G. (2004). Phytopharmaceuuticals in Cancer Chemoprevention, 1. Aufl. Bocca Raton, FL: CRC Press.
Frohne, D. (2010). Leksykon Roślin Leczniczych MedPharm. Wroclaw, 276.
Google Scholar
Hu, S. (2005). „Hippophae rhamnoides L. – Sanddorn, Shaji“ in Food Plants of China (Chinesische Universitätspresse), 572.
Sarwa A. (2001). Wielki Leksykon Roślin Leczniczych. Warszawa: Książka i Wiedza. 1977). Pharmacopeia der Volksrepublik China 1997, Peking.
Zeb, A. (2006). Antikarzinogenes Potenzial von Lipiden aus Nilpferden – Hinweise aus der neueren Literatur. Asian Pac. J. Cancer Prev. 7, 32–34.
PubMed Abstract | Google Scholar
Zhang, P. (1989). Antikrebsaktivitäten von Sanddornsamenöl und seine Auswirkungen auf das Gewicht der Immunorgane Sanddorn 2, 31–34.