Grenzen der Zell- und Infektionsmikrobiologie
Einführung
Staphylococcus aureus ist ein wichtiger humanpathogener Erreger, der aus Krankenhauspatienten weltweit isoliert wird und sowohl im Krankenhaus als auch in der Gemeinde erworbene Infektionen verursacht ( Lowy, 1998). Dieser Erreger ist der ätiologische Erreger verschiedener systemischer Infektionen, die Haut und Weichgewebe sowie den Bewegungsapparat und das Kreislaufsystem betreffen (Lowy, 1998; Changchien et al., 2016). Es wurde berichtet, dass S. aureus in von menschlichen Monozyten abgeleiteten Makrophagen überleben kann (Kubica et al., 2008). Die Virulenz von S. aureus ist eng mit einer Vielzahl von sekretierten Enzymen und Toxinen verbunden, die von den Bakterien produziert werden (Otto, 2014). Hämolysin, Leukocidin (Panton-Valentine-Leukocidin, PVL) und das Toxin-Schock-Syndrom Toxin-1 (TSST-1), das die Schädigung der Membran roter Blutkörperchen erleichtert, die phagozytische Funktion von Leukozyten verletzt und das toxische Schock-Syndrom induziert, sind für das pathogene Prozesse von S. aureus (Löffler et al., 2010; Vandenesch et al., 2012; Berube und Bubeck Wardenburg, 2013; Andrey et al., 2015; Al Laham et al., 2015). Neuere Studien haben gezeigt, dass Hämolysin auch an der Bildung des S. aureus-Biofilms beteiligt ist (den Reijer et al., 2016). Die zunehmende Verbreitung multiresistenter S. aureus-Stämme in Krankenhäusern und Gemeinden erhöht die Gefahren von S. aureus weiter und stellt eine ernsthafte Herausforderung für die klinische Therapie dar (Voss und Doebbeling, 1995; Evangelista Sde und de Oliveira, 2015).
Kürzlich wurde in unserem Krankenhaus eine Reihe von Stämmen gefunden, die zu einer Klasse von S. aureus mit einem unvollständigen hämolytischen Phänotyp (SIHP) gehören. Die durch diese SIHP-Stämme verursachte Hämolyse unterscheidet sich signifikant von dem vollständigen hämolytischen Ring (β-hämolytischer Phänotyp), der in anderen S. aureus-Stämmen produziert wird. Diese SIHP-Stämme wurden jedoch noch nicht umfassend identifiziert und charakterisiert. Um die mikrobiologischen Eigenschaften dieser SIHP-Stämme zu untersuchen, haben wir 60 SIHP-Stämme gesammelt und anhand mehrerer Kriterien untersucht, darunter hämolytischer Phänotyp, Expression des Hämolysin-Gens, Arzneimittelresistenzmerkmale und Virulenz. Diese Studie zeigt, dass SIHPs Methicillin-resistente Stämme sind, die β-Hämolysin stark exprimieren und ein hohes Virulenzpotential besitzen.
Materialien und Methoden
Bakterienstämme
60 SIHP Stämme wurden aus Patienten isoliert, die zwischen 2013 und 2015 im zweiten angegliederten Krankenhaus der Universität Soochow aufgenommen wurden. Von jedem Patienten wurden doppelte Proben zur Analyse entnommen. Diese Isolate wurden dann auf Columbia-Schafblutagarplatten (CHROMagar Company, Shanghai, China) bei 35 ° C in einer Atmosphäre mit 5% CO 2 (v / v) kultiviert. Die Identität der Stämme als S. aureus wurde unter Verwendung des automatisierten Mikrobiologiesystems Phoenix-100 (Becton, Dickinson and Company, USA) bestätigt. Die Kontrollstämme von S. aureus mit vollständigem hämolytischen Phänotyp wurden im gleichen Zeitraum aus Patienten in unserem Krankenhaus isoliert. Hier wurde S. aureus mit dem vollständigen hämolytischen Phänotyp SCHP-Stämme genannt. Der S. aureus ATCC25923-Referenzstamm (Shanghai Center for Clinical Laboratory, China) weist den vollständigen hämolytischen Phänotyp auf und fungierte auch als Kontrollstamm. Die Medizinische Ethikkommission des zweiten angegliederten Krankenhauses der Universität Soochow genehmigte diese Studie, und alle Isolate wurden mit Zustimmung des Patienten in dieser Studie gesammelt.
Vergleichende Analysen des unvollständigen hämolytischen Phänotyps
Der S. aureus Die Stämme wurden auf kommerziellen Blutagarplatten von verschiedenen Unternehmen (CHROMagar, Autobio Diagnostics Co., Ltd., China und BioMérieux, China) sowie auf selbst hergestellten Schafblutagarplatten unter Verwendung von Columbia-Blutagarpulver (OXIDE, UK) kultiviert. Die Bakterien wurden bei 35 ° C in einer Atmosphäre, die 5% CO 2 (v / v) enthielt, 24 Stunden lang kultiviert und dann einer seriellen Passage unterzogen. Das hämolytische Phänomen wurde dann beobachtet. Klinisch isolierte Stämme mit vollständigem hämolytischen Phänotyp und der ATCC25923-Referenzstamm wurden ebenfalls als Kontrolle für Vergleichsanalysen beobachtet.
Bestimmung der mRNA-Spiegel von vier Hämolysin-Genen von S. aureus unter Verwendung von Reverse Transcription Real-Time Quantitative PCR (qPCR)
Die Gesamt-RNA-Extraktion aus dem SIHP- und dem ATCC25923-Referenzstamm wurde wie zuvor beschrieben durchgeführt (Qin et al., 2014). Anfänglich wurden die Zellen unter Verwendung von Lysostaphin, Lysozym und Proteinase K lysiert. Die RNA wurde dann extrahiert und unter Verwendung des RNeasy Mini Kit (Qiagen) gemäß dem vom Hersteller empfohlenen Protokoll gereinigt. Die RNA-Qualität und -Konzentration wurde unter Verwendung des NanoDrop1000 bewertet. Die RNA wurde dann umgekehrt -transkribiert in cDNA unter Verwendung eines reversen Transkriptionskits (Thermo Fisher Scientific Inc., USA) gemäß den Anweisungen des Herstellers.Kurz gesagt wurde qPCR wie folgt durchgeführt: Vordenaturierung bei 94 ° C für 3 Minuten, Denaturierung bei 94 ° C für 30 Sekunden, Tempern bei 52 ° C für 30 Sekunden, Dehnung bei 72 ° C für 40 Sekunden, insgesamt 45 Zyklen . Jede Probe hatte drei technische und drei biologische Wiederholungen. Das Transkriptionsprofil jedes der vier Hämolysin-Gene und des 16s-rRNA-Gens wurde unter Verwendung der 2-ΔΔCt-Methode bestimmt. Das Transkriptionsniveau wurde relativ zur Expression des 16s-rRNA-Gens bestimmt. Die Sequenzen von vier Hämolysin-Genen (hla, hlb, hlgC und hld) wurden aus der GenBank-Datenbank abgerufen. Primer 5.0-Software wurde verwendet, um die Primer zu entwerfen (Tabelle 1), und diese Primer wurden von Sangon Biotech Co., Ltd. (Shanghai, China) synthetisiert.
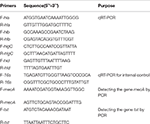
Tabelle 1. In dieser Studie verwendete Primer.
SPSS 17.0 wurde für die Datenanalyse verwendet. Messdaten werden als x̄ ± s dargestellt. Der T-Test für zwei unabhängige Proben wurde verwendet, um die relative Expression jedes der vier Hämolysin-Gene zu vergleichen. Die statistische Signifikanz wurde definiert als p < 0,05.
Nachweis der α-Hämolysin (Hla) -Expression durch Western Blot
Die Konzentration der SIHP und der Referenzstamm S. aureus ATCC25923 wurden unter Verwendung eines Trübungsmessers auf 5,0 McFarland eingestellt. Das Gesamtprotein wurde dann aus jeder Probe extrahiert, auf die gleiche Konzentration eingestellt und einer Elektrophorese auf einem SDS-PAGE-Gel unterzogen. Die Proteine wurden dann auf eine Nitrocellulosemembran übertragen und die Membran wurde 1 h mit 5% Magermilch blockiert. Polyklonale α-Hämolysin-Antikörper gegen Ziegen-Anti-Staphylokokken (Abcam) wurden in einer Endkonzentration von 2 & mgr; g / ml zugegeben. Das Reaktionsgemisch wurde dann über Nacht bei 4 ° C inkubiert. Nach dem Waschen der Membran wurden 1: 1000 verdünnte HRP-markierte Kaninchen-Anti-Ziegen-IgG-Antikörper zugegeben und 2 h bei 37 ° C inkubiert. Schließlich wurden chemilumineszierende Substrate zur Farbentwicklung zugesetzt. Die Expression von α-Hämolysin wurde schließlich unter dem Imager beobachtet.
Antimikrobielle Empfindlichkeitsprüfung von SIHP
Das Mikrotiter-Bouillon-Verdünnungsverfahren wurde verwendet, um ein antimikrobielles Empfindlichkeits-Screening durchzuführen. Das Verfahren wurde gemäß dem Betriebshandbuch des automatisierten Mikrobiologiesystems Phoenix-100 durchgeführt. Die Ergebnisse dieses Screenings wurden unter Verwendung der M100-S24-Kriterien interpretiert, die vom Clinical and Laboratory Standards Institute (CLSI; Clinical and Laboratory Standards Institute, 2014) eingeführt wurden. Der Methicillin-resistente S. aureus (MRSA) -Status wurde unter Verwendung der MHK (minimale Hemmkonzentration) von zwei Antibiotika bestimmt. Für die SIHP-Stämme war ≥4 μg / ml die MHK für Oxallicin und ≥8 μg / ml war die MHK für Cefoxitin.
Nachweis von mecA- und tst-Genen
Alle 60 SIHP Die Stämme wurden auf das Arzneimittelresistenzgen mecA und das Virulenzgen tst getestet. Die kochende Extraktion genomischer DNA wurde nach zellulärer Lyse unter Verwendung von Lysostaphin durchgeführt. Die mecA- und tst-Gene wurden dann aus der genomischen DNA unter Verwendung des DreamGreen Taq-Kits amplifiziert. Die PCR-Bedingungen waren wie folgt: Vordenaturierung bei 94 ° C für 3 Minuten, Denaturierung bei 94 ° C für 30 Sekunden, Annealing bei 50 ° C für 30 Sekunden, Verlängerung bei 72 ° C für 1 Minute. PCR-Produkte wurden von BLAST sequenziert und analysiert, um die erwarteten Produkte zu validieren. Die Sequenzen des Arzneimittelresistenzgens mecA und des Virulenzgens tst von S. aureus wurden aus der GenBank-Datenbank abgerufen. Primer 5.0-Software wurde verwendet, um die Primer zu entwerfen (Tabelle 1), und diese Primer wurden von Sangon Biotech Co., Ltd. (Shanghai, China) synthetisiert.
Nachweis des Überlebens von S. aureus SIHP-Stämmen in Makrophagen
Um das Überleben von S. aureus SIHP-Stämmen in Makrophagen mit dem von tst negativen S. aureus SCHP-Stämmen zu vergleichen, wurde die humane Monozytenzelllinie THP-1 in RPMI-1640 mit 10% (v / v) FBS bei 37 ° C in einer Atmosphäre mit 5% (v / v) CO2. Zur Makrophageninfektion wurden THP-1-Zellen mit 5 × 10 5 Zellen pro Vertiefung in Gewebekulturschalen mit 24 Vertiefungen ausgesät und zur Differenzierung durch 10–7 M Phorbol 12-Myristat 13-Acetat (PMA) für 48 Stunden induziert. Ungefähr 3 × 108 koloniebildende Einheiten (KBE) von Bakterien der logarithmischen Phase (OD600 0,5–0,6) wurden durch Zentrifugation pelletiert, zweimal mit PBS gewaschen und in 1 ml RPMI-1640 resuspendiert. Dann wurden Bakterien mit einer MOI von 20: 1 zu der Zellmonoschicht gegeben und 5 min bei 1000 U / min zentrifugiert. Infizierte Zellen wurden 20 Minuten bei 37 ° C inkubiert, dann dreimal mit vorgewärmtem PBS (pH 7,4) gewaschen und weitere 1 Stunde in Medium inkubiert, das 100 μg / ml Gentamicin enthielt, um extrazelluläre Bakterien abzutöten. Die Zellen wurden gewaschen und lysiert, um das intrazelluläre Bakterium als Zeit-Null-Probe (T0) zu quantifizieren. Zusätzliche Zellen wurden nach 12 oder 24 h Inkubation in Gegenwart von frischem ergänztem Gewebekulturmedium, das 12 & mgr; g / ml Gentamicin enthielt, gesammelt.Das Wachstum von Bakterien in THP-1-Zellen wurde durch Teilen der Anzahl intrazellulärer Bakterien nach 12 h oder 24 h durch die Anzahl zum Zeitpunkt 0 (T12 / T0 oder T24 / T0) bestimmt. Das Experiment wurde unabhängig dreimal wiederholt.
Nachweis der Cytokinsekretion von Makrophagen, die mit S. aureus SIHP-Stämmen infiziert waren
Die Kulturüberstände von THP-1-Makrophagen, die 12 Stunden lang mit Bakterien infiziert waren, waren gesammelt. Die Zytokinspiegel wurden durch FACSCalibur-Durchflusszytometrie (BD) unter Verwendung eines CBA-Human-Thl / Th2-Zytokin-Kits II (BD) gemäß den Anweisungen des Herstellers gemessen.
Multilocus Sequence Typing and Analysis
Ergebnisse
Hämolytischer Phänotyp von SIHP-Stämmen auf Schafagarblutplatten
Wie in 1A, B gezeigt, wurde der vollständige hämolytische Ring (β-hämolytischer Phänotyp) in Kontrolle S beobachtet Aureus-Stämme nach 24-stündiger Kultivierung von Stämmen auf Blutagarplatten. In SIHP-Stämmen wurden jedoch unterschiedliche hämolytische Phänotypen (hier als unvollständiger hämolytischer Phänotyp bezeichnet) gezeigt. Darüber hinaus konnte der unvollständige hämolytische Phänotyp in den SIHP-Stämmen beobachtet werden, die in verschiedenen Umgebungen gewachsen waren Bedingungen, einschließlich mikroaerophiler, aerober bzw. anaerober Bedingungen (1C – E). Zusätzlich wurde dieser unvollständige hämolytische Phänotyp nach 10 seriellen Passagen immer noch beibehalten (1F).
Relativ mRNA-Expressionsniveaus von vier Hämolysin-Genen
Wie in 2 gezeigt, zeigten die Expressionsniveaus der vier Hämolysin-Gene hla, hlb, hlgC und hld in SCHP-Stämmen keine statistisch signifikanten Unterschiede (p > 0,05) im Vergleich zu dem der Kontrollstämme ATCC25923. Die Expressionsniveaus von hla, hlgC und hld in SIHP-Stämmen wurden jedoch im Vergleich zu denen von 0,05 signifikant um das 50-, 16,7- bzw. 8,3-fache (p < 0,05) unterdrückt Kontrollstämme ATCC25923 und SCHP-Stämme, während die Expression von hlb in SIHP-Stämmen im Vergleich zu den Kontrollen 7,7-fach signifikant erhöht war (p < 0,05).
Nachweis von α-Hämolysin durch Western Blot
Das von codierte α-Hämolysin Das Gen hla ist ein porenbildendes Toxin, das von S. aureus sekretiert wird und dessen Molekulargewicht 33 kDa beträgt (Andrey et al., 2015; Al Laham et al., 2015). Die Western-Blot-Analyse zeigte, dass die Expression von α-Hämolysin in SIHP-Stämmen 40-fach niedriger war als die der SCHP- und Kontrollstämme, was mit den qRT-PCR-Daten übereinstimmt (3).

Abbildung 3. Western Blot von α-Hämolysin in S. aureus. ATCC29213: Kontrolle S. aureus mit dem vollständigen hämolytischen Phänotyp; SCHP: S. aureus mit dem vollständigen hämolytischen Phänotyp, der im gleichen Zeitraum aus klinischen Proben isoliert wurde; SIHP: S. aureus mit einem unvollständigen hämolytischen Phänotyp.
Arzneimittelresistenz von SIHP
Arzneimittelanfälligkeit getestet Die Verwendung von Mikrotiterbrühenverdünnungen zeigte, dass die MHK-Werte für Oxacillin und Cefoxitin alle > 2 und > 8 μg / ml in 60 SIHP-Färbungen waren . Gemäß den CLSI M100-S24-Richtlinien werden alle 60 SIHP-Stämme als MRSA-Stämme klassifiziert. Die PCR detektierte auch das mecA-Gen in allen 60 Stämmen.
Testen auf das tst-Gen
Das tst-Gen ist ein wichtiger Virulenzfaktor bei S. aureus. Die PCR zeigte, dass alle 50 SIHP-Stämme tst-Gene trugen.
Die Überlebensfähigkeit von S. aureus-SIHP-Stämmen in Makrophagen ist größer als die von tst-negativen S. aureus
Wir verglichen die intrazellulären Überlebensfähigkeiten von SIHP-Stämmen und tst negativen SCHP-Stämmen in Makrophagen. Durch Zählen der Anzahl von Bakterien, die aus den Platten gewonnen wurden, fanden wir, dass die intrazelluläre Überlebensfähigkeit des SIHP-Stammes viel höher war als die des tst-negativen S. aureus-Stammes nach infizierten THP-1-abgeleiteten Makrophagen 12 oder 24 Stunden (4). Vorläufig spekulierten wir, dass SIHP-Stämme eine potenziell hohe Virulenz besitzen, und es wurde vorgeschlagen, SIHP im Krankenhaus mehr Aufmerksamkeit zu schenken.
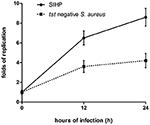
Abbildung 4. Überleben von SIHP-Stämmen und tst negativem S. aureus in von THP-1 abgeleiteten Makrophagen. Nachdem die Makrophagen 12 und 24 Stunden lang mit Bakterien infiziert worden waren, wurden die Makrophagen lysiert und die intrazellulär überlebenden Bakterien auf LB-Agar ausplattiert. Die Replikationsfalten von intrazellulär überlebenden Bakterien wurden gemäß der Anzahl der Kolonien auf der obigen LB-Agarplatte berechnet.
Die Sekretionsunterschiede von Zytokinen und Chemokinen von Makrophagen, die mit S. aureus SIHP-Stämmen und tst-negativem S. aureus
infiziert sind Zum Vergleich der Sekretionsunterschiede von Zytokinen und Chemokinen in von THP-1 abgeleiteten Makrophagen, die mit SIHP-Stamm und tst negativem S. infiziert sind.Aureus-Stamm, wir haben proinflammatorische Zytokine durch Durchflusszytometrie im Kulturüberstand von Makrophagen nachgewiesen, die mit SIHP-Stämmen und dem ersten negativen S. aureus-Stamm infiziert waren. Die Ergebnisse zeigten eine signifikant höhere Induktion von IL-2, IL-6 und IL-17A in SIHP-Stämmen, jedoch nicht durch tst-negativen S. aureus, was darauf hindeutet, dass SIHP-Stämme Cytokin / Chemokin-Reaktionen in den Makrophagen induzieren (5). Die anderen Zytokine IL-4, IL-10, INF-γ und TNF, die von Makrophagen sekretiert wurden, waren keine offensichtlichen Unterschiede zwischen SIHP-Stämmen und tst negativen S. aureus-betroffenen Gruppen.
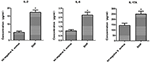
Abbildung 5. Nachweis von Zytokinen und Chemokinen, die von mit S. aureus infizierten Makrophagen sekretiert werden. * P < 0,05.
Multilocus Sequence Typing
Wir haben den Multilocus-Genotyp von 60 SIHP-Isolaten bestimmt, die von Patienten gesammelt wurden, die zwischen 2013 und 2014 in unserem Krankenhaus aufgenommen wurden. Das in der S. aureus MLST-Datenbank empfohlene Sieben-Locus-Schema wurde angewendet. Die MLST-Analyse zeigte, dass alle SIHP-Stämme in ST5-Klone klassifiziert wurden.
Diskussion
Hämolysin ist einer der wichtigsten Virulenzfaktoren für S. aureus (Wiseman, 1975). Die kombinierten Wirkungen jeder der vier Arten von Hämolysin führen zur Zerstörung der Erythrozytenmembran, was zur Bildung des vollständig transparenten hämolytischen Rings auf Blutagarplatten führt. In den letzten Jahren wurden SIHP in den klinischen Proben des zweiten angeschlossenen Krankenhauses der Universität Soochow gefunden. In dieser Studie haben wir versucht, diese Stämme zu identifizieren und ihre Eigenschaften in der Mikrobiologie zu untersuchen. Anfänglich verwendeten wir verschiedene kommerzielle oder selbst hergestellte Schafblutagarplatten, um die Stämme zu isolieren, zu inkubieren und seriell zu passieren. Wir haben gezeigt, dass es einige Stämme gibt, die auch nach längerer Subkultur einen unvollständigen hämolytischen Phänotyp aufweisen und beibehalten. Somit kann die Möglichkeit ausgeschlossen werden, dass dieser Phänotyp durch nicht bakterielle Faktoren induziert wird. Unsere Studien legen nahe, dass SIHP eine Untergruppe einzigartiger S. aureus-Stämme sein könnte.
Frühere Studien deuteten darauf hin, dass rote Blutkörperchen von Kaninchen hochempfindlich gegenüber α-Hämolysin sind (Hildebrand et al., 1991). Berube et al. berichteten, dass die Wirkung von α-Hämolysin auf die Lyse roter Blutkörperchen konzentrationsabhängig ist (Berube und Bubeck Wardenburg, 2013). γ-Hämolysin kann die roten Blutkörperchen von Mensch und Tier schädigen (Kaneko und Kamio, 2004). Während δ-Hämolysin rote Blutkörperchen nur in hohen Konzentrationen schädigt, bildet es eine Transmembranpore, die die Zellmembran lysiert (Verdon et al., 2009). In dieser Studie haben wir gezeigt, dass die Expression von vier Hämolysinen von SIHP-Stämmen und SCHP-Stämmen signifikant unterschiedliche Transkriptions-Expressionsprofile aufweist. Die Expression von α-, γ-, δ-Hämolysin in den SIHP-Stämmen, die die roten Blutkörperchen direkt schädigen könnten, ist viel geringer als die der SCHP-Stämme, während β-Hämolysin im Vergleich zu den SCHP-Stämmen weitaus höhere Expressionsniveaus aufweist. Zusätzlich wurde das Proteinexpressionsniveau von α-Hämolysin durch Western Blot weiter validiert. Es wurde berichtet, dass β-Hämolysin vorwiegend die Empfindlichkeit roter Blutkörperchen gegenüber anderen Toxinen erhöht, anstatt die Zellen direkt zu lysieren, es sei denn, die Zellen werden bei niedrigeren Temperaturen kultiviert (Vandenesch et al., 2012). In dieser Studie wurde die hohe Expression von β-Hämolysin in SIHP-Stämmen nachgewiesen, aber der vollständige hämolytische Ring wurde in den SIHP-Stämmen selbst bei Inkubation bei 4 ° C nie beobachtet. Diese Ergebnisse legen nahe, dass der beobachtete unvollständige Phänotyp von SIHP-Stämmen höchstwahrscheinlich die Wirkung aller vier Hämolysine ist, die im Vergleich zu den SCHP-Stämmen anders exprimiert werden. Frühere Studien haben gezeigt, dass während der chronischen Pathogenese die kombinierte Wirkung von selektivem Druck, der aus Antibiotika wie Ciprofloxacin und Trimethoprim resultiert, sowie die Immunantwort des Wirts zu einer erhöhten Expression von α-Hämolysin führen kann, was für die Besiedlung von S sehr wichtig ist Aureus in der Schleimhaut, insbesondere bei Infektionen der Atemwege (Goerke et al., 2006; Huseby et al., 2010). In dieser Studie erhielten alle mit SIHP infizierten Patienten eine Langzeitbehandlung mit Breitbandantibiotika. Ob dieser selektive Druck eine Überexpression von arzneimittelresistenten Genen induzierte und die Expression der Hämolysin-Gene störte, bleibt eine Möglichkeit, die weiter benötigt wird Untersuchung.
Um die mikrobiologischen Eigenschaften von SIHP zu untersuchen, führten wir antimikrobielle Empfindlichkeitstests durch und wählten das Virulenzgen tst aus, das mit der Pathogenität von S. aureus assoziiert ist. Wir fanden heraus, dass alle 60 SIHP-Stämme als MRSA-Stämme klassifiziert werden konnten und das mecA-Gen trugen. Die Ergebnisse von antimikrobiellen Empfindlichkeitstests zeigten, dass sich die MHK-Werte von Linezolid und Teicoplanin von nur drei SIHP-Stämmen selbst nach 10 Passagen dieser 60 SIHP-Stämme kaum verändert haben.Diese Änderungen der MHK-Werte hatten jedoch keinen Einfluss auf die Bewertung der Ergebnisse der antimikrobiellen Empfindlichkeit. Das Virulenzgen tst kodiert für das Toxin des Toxic-Shock-Syndroms (TSST-1) (Kreiswirth, 1989). Als Superantigen verstärkt TSST-1 die durch Endotoxine induzierten Schock- und Immunsuppressionsreaktionen (Kulhankova et al., 2014). PCR-Tests ergaben, dass alle 60 SIHP-Stämme das tst-Gen besaßen, was auf eine erhöhte Virulenz hinweist. Kürzlich haben viele Berichte gezeigt, dass S. aureus in den von menschlichen Monozyten abgeleiteten Makrophagen überleben kann und diese S. aureus-Stämme virulenter sind (Kubica et al., 2008; Tranchemontagne et al., 2015; Münzenmayer et al., 2016; Nandi und Bishayi, 2016). Daher verglichen wir die intrazellulären Überlebensfähigkeiten von SIHP-Stämmen und SCHP-Stämmen, die in Makrophagen tst negativ sind, und stellten fest, dass die intrazelluläre Überlebensfähigkeit des SIHP-Stammes viel höher war als die des tst negativen S. aureus-Stammes. Darüber hinaus zeigte die Analyse der Patientendaten, dass die Wirkung einer antiinfektiösen Therapie bei den meisten mit SIHP-Stämmen infizierten Patienten schlechter war als bei den mit SCHP-Stämmen infizierten ähnlichen Patienten (Daten nicht gezeigt). Unsere Studie liefert vorläufige experimentelle Beweise für die Spekulation, dass SIHP-Stämme eine potenziell hohe Virulenz besitzen.
Während des Infektionsprozesses von invasivem S. aureus initiieren Pathogen-assoziierte Moleküle das angeborene Immunsystem, was zur Aktivierung und Rekrutierung führt von Neutrophilen und Makrophagen und die Produktion von proinflammatorischen Zytokinen, insbesondere TNF-α, IL-1β und IL-6 (Bekeredjian-Ding et al., 2015; Giai et al., 2016; Zhao et al., 2016) ). Es wurde berichtet, dass die Sekretion der entzündlichen Zytokine IL-6 mit zunehmenden Konzentrationen von S. aureus zunahm (Chen et al., 2016). Darüber hinaus stimulieren superantigene S. aureus besonders wirksam die IL-17-Produktion (Islander et al., 2010). In dieser Studie zeigten SIHP-Stämme eine signifikant höhere Induktion von IL-2, IL-6 und IL-17A von Makrophagen im Vergleich zu tst-negativen SCHP-Stämmen, was darauf hindeutet, dass SIHP-Stämme eine stärkere Sekretion von Zytokinen gegen die Abtötungswirkung von Makrophagen induzieren könnten. Zusätzlich zeigte die MLST-Analyse, dass alle SIHP-Stämme in ST5-Klone klassifiziert wurden. Darüber hinaus wurden diese SIHP-Stämme im Spa-Typ von t2460 zusammengefasst (Daten nicht gezeigt).
Zusammengenommen kann SIHP eine neue Untergruppe von MRSA mit potenziell hoher Virulenz sein, und es sollte mehr Aufmerksamkeit geschenkt werden Kontrolle und Behandlung dieser Stämme in Krankenhäusern.
Autorenbeiträge
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher Werbung durchgeführt wurde oder finanzielle Beziehungen, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Diese Studie wurde von der National Natural Science Foundation of China (81572032, 81401636), der Naturwissenschaft, unterstützt Stiftung für Hochschulen und Universitäten in der Provinz Jiangsu (16KJB320006) und das Wissenschafts- und Technologieprogramm von Suzhou (SYSD2014094, SYS201551, SS201638).
Klinisch und Labor Standards Institute (2014). M100-S24-Leistungsstandards für die Prüfung der Empfindlichkeit gegenüber antimikrobiellen Wirkstoffen; Vierundzwanzigste Informationsergänzung. Wayne, PA: CLSI.
Nandi, A. und Bishayi, B. (2016). Intrazellulär überlebter Staphylococcus aureus nach Phagozytose induziert virulenter eine Zytotoxizität in frischen peritonealen Makrophagen der Maus, wobei TLR-2 als mögliches Ziel verwendet wird. Microb. Pathog. 97, 131–147. doi: 10.1016 / j.micpath.2016.06.007
PubMed Abstract | CrossRef Volltext | Google Scholar
Wiseman, G. M. (1975). Die Hämolysine von Staphylococcus aureus. Bakteriol. Rev. 39, 317–344.
PubMed Abstract | Google Scholar